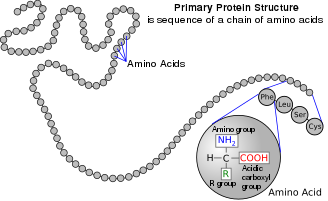
Acide aminé -Amino acid
Les acides aminés sont des composés organiques qui contiennent des acides aminés ( -NH+3) et des fonctions acide carboxylique ( -CO 2 H ) , ainsi qu'une chaîne latérale (groupe R) spécifique à chaque acide aminé. Les éléments présents dans chaque acide aminé sont le carbone (C), l'hydrogène (H), l'oxygène (O) et l'azote (N) ( CHON ); de plus, le soufre (S) est présent dans les chaînes latérales de la cystéine et de la méthionine , et le sélénium (Se) dans la sélénocystéine , un acide aminé moins courant.. Plus de 500 acides aminés naturels sont connus pour constituer des unités monomères de peptides , y compris des protéines , à partir de 2020 bien que seulement 22 apparaissent dans le code génétique , dont 20 ont leurs propres codons désignés et dont 2 ont des mécanismes de codage spéciaux : la sélénocystéine qui est présent chez tous les eucaryotes et la pyrrolysine qui est présente chez certains procaryotes .
Les acides aminés sont officiellement nommés par la Commission mixte IUPAC-IUBMB sur la nomenclature biochimique en termes de structure fictive "neutre" montrée dans l'illustration. Par exemple, le nom systématique de l'alanine est acide 2-aminopropanoïque, basé sur la formule CH 3 -CH(NH 2 )-COOH . La Commission a justifié cette approche comme suit :
Les noms et formules systématiques donnés se réfèrent à des formes hypothétiques dans lesquelles les groupes amino sont non protonés et les groupes carboxyle sont non dissociés. Cette convention est utile pour éviter divers problèmes de nomenclature mais ne doit pas être interprétée comme impliquant que ces structures représentent une fraction appréciable des molécules d'acides aminés.
Ils peuvent être classés en fonction de l'emplacement des groupes fonctionnels structuraux centraux, en tant qu'acides aminés alpha- (α-) , bêta- (β-) , gamma- (γ-) ou delta- (δ-) ; d'autres catégories concernent la polarité , l' ionisation et le type de groupe de chaîne latérale ( aliphatique , acyclique , aromatique , contenant de l' hydroxyle ou du soufre , etc.). Sous forme de protéines, les résidus d'acides aminés forment le deuxième composant le plus important ( l'eau étant le plus grand) des muscles humains et d'autres tissus . Au-delà de leur rôle de résidus dans les protéines, les acides aminés participent à un certain nombre de processus tels que le transport des neurotransmetteurs et la biosynthèse .
Histoire
Les premiers acides aminés ont été découverts au début des années 1800. En 1806, les chimistes français Louis-Nicolas Vauquelin et Pierre Jean Robiquet ont isolé un composé de l'asperge qui a ensuite été nommé asparagine , le premier acide aminé découvert. La cystine a été découverte en 1810, bien que son monomère, la cystéine , soit resté inconnu jusqu'en 1884. La glycine et la leucine ont été découvertes en 1820. Le dernier des 20 acides aminés communs à être découvert était la thréonine en 1935 par William Cumming Rose , qui a également déterminé l' essentiel acides aminés et établi les besoins quotidiens minimaux de tous les acides aminés pour une croissance optimale.
L'unité de la catégorie chimique a été reconnue par Wurtz en 1865, mais il ne lui a pas donné de nom particulier. La première utilisation du terme "acide aminé" dans la langue anglaise date de 1898, alors que le terme allemand, Aminosäure , était utilisé plus tôt. Les protéines se sont révélées produire des acides aminés après digestion enzymatique ou hydrolyse acide . En 1902, Emil Fischer et Franz Hofmeister ont proposé indépendamment que les protéines sont formées à partir de nombreux acides aminés, grâce à quoi des liaisons sont formées entre le groupe amino d'un acide aminé avec le groupe carboxyle d'un autre, résultant en une structure linéaire que Fischer a appelée " peptide ".
Structure générale

Dans la structure présentée en haut de la page R représente une chaîne latérale spécifique à chaque acide aminé. L' atome de carbone à côté du groupe carboxyle est appelé le carbone α . Les acides aminés contenant un groupe amino lié directement au carbone α sont appelés acides α-aminés . Ceux-ci comprennent la proline et l' hydroxyproline , qui sont des amines secondaires . Dans le passé, ils étaient souvent appelés iminoacides , un terme impropre car ils ne contiennent pas de groupement imine HN=C . Le terme obsolète reste fréquent.
isomérie
Les formes naturelles courantes d'acides aminés ont la structure -NH+3( −NH+2− dans le cas de la proline) et −CO−2des groupes fonctionnels attachés au même atome C, et sont donc des acides α-aminés. A l'exception de la glycine achirale, les acides aminés naturels ont la configuration L , et sont les seuls présents dans les protéines lors de la traduction dans le ribosome.
La convention L et D pour la configuration des acides aminés ne fait pas référence à l'activité optique de l'acide aminé lui-même mais plutôt à l'activité optique de l'isomère du glycéraldéhyde à partir duquel cet acide aminé peut, en théorie, être synthétisé ( le D -glycéraldéhyde est dextrogyre ; Le L -glycéraldéhyde est lévogyre).
Une autre convention consiste à utiliser les désignateurs ( S ) et ( R ) pour spécifier la configuration absolue . Presque tous les acides aminés des protéines sont ( S ) au niveau du carbone α, la cystéine étant ( R ) et la glycine non chirale . La cystéine a sa chaîne latérale au même emplacement géométrique que les autres acides aminés, mais la terminologie R / S est inversée car le soufre a un numéro atomique plus élevé par rapport à l'oxygène carboxylique, ce qui donne à la chaîne latérale une priorité plus élevée par le Cahn-Ingold-Prelog règles de séquence , alors que les atomes de la plupart des autres chaînes latérales leur donnent une priorité inférieure par rapport au groupe carboxyle.
Des résidus d'acides aminés D se trouvent dans certaines protéines, mais ils sont rares.
Chaînes latérales
Les acides aminés sont désignés par α- lorsque l'atome d'azote aminé est attaché au carbone α, l'atome de carbone adjacent au groupe carboxylate.
Dans tous les cas ci-dessous dans cette section, les valeurs (le cas échéant) se réfèrent à l'ionisation des groupes en tant que résidus d'acides aminés dans les protéines. Ce ne sont pas des valeurs pour les acides aminés libres (qui ont peu d'importance biochimique).
Chaînes latérales aliphatiques
Plusieurs chaînes latérales ne contiennent que du H et du C et ne s'ionisent pas. Ce sont les suivants (avec des symboles à trois et une lettres entre parenthèses):
- Glycine (Gly, G): H−
- Alanine (Ala, A) : CH 3 −
- Valine (Val, V) : (CH 3 ) 2 CH−
- Leucine (Leu, L) : (CH 3 ) 2 CHCH 2 −
- Isoleucine (Ile, I): CH 3 CH 2 CH(CH 3 )
- Proline (Pro, P) : -CH 2 CH 2 CH 2 - cyclisé sur l'amine
Chaînes latérales neutres polaires
Deux acides aminés contiennent des chaînes latérales d'alcool. Ceux-ci ne s'ionisent pas dans les conditions normales, bien que l'un, la sérine, se déprotonise lors de la catalyse par les sérine protéases : c'est un exemple de perturbation sévère, et n'est pas caractéristique des résidus sérine en général.
- Sérine (Ser, S, non lorsqu'elle n'est pas gravement perturbée) : HOCH 2 −
- Thréonine (Thr, T, no ) : CH 3 CHOH−
La thréonine a deux centres chiraux, non seulement le centre chiral L (2 S ) au carbone α partagé par tous les acides aminés à l'exception de la glycine achirale, mais aussi (3 R ) au carbone β. La spécification stéréochimique complète est la L - thréonine (2 S ,3 R ).
Chaînes latérales amide
Deux acides aminés ont des chaînes latérales amide, comme suit :
- Asparagine (Asn, N) : NH 2 COCH 2 −
- Glutamine (Gln, Q) : NH 2 COCH 2 CH 2 −
Ces chaînes latérales ne s'ionisent pas dans la plage normale de pH.
Chaînes latérales contenant du soufre
Deux chaînes latérales contiennent des atomes de soufre, dont l'une s'ionise dans la plage normale (avec indiqué) et l'autre non :
- Cystéine (Cys, C, ) : HSCH 2 −
- Méthionine (Met, M, no ): CH 3 SCH 2 CH 2 −
Chaînes latérales aromatiques
Trois acides aminés ont des structures cycliques aromatiques en tant que chaînes latérales, comme illustré. Parmi ceux-ci, la tyrosine s'ionise dans la plage normale; les deux autres non).
- Phénylalanine (Phe, F, no ): à gauche sur l'illustration
- Tyrosine (Tyr, Y, ): milieu de l'illustration
- Tryptophane (Trp, W, no ) : à droite dans l'illustration
Chaînes latérales anioniques
Deux acides aminés ont des chaînes latérales qui sont des anions à pH ordinaire. Ces acides aminés sont souvent appelés acides carboxyliques, mais sont plus correctement appelés carboxylates, car ils sont déprotonés aux valeurs de pH les plus pertinentes. Les groupes carboxylate anioniques se comportent comme des bases de Brønsted en toutes circonstances, à l'exception des enzymes comme la pepsine qui agissent dans des environnements à pH très bas comme l'estomac des mammifères.
- Aspartate ("acide aspartique", Asp, D, ): - O 2 CCH 2 −
- Glutamate ("acide glutamique", Glu, E, ): - O 2 CCH 2 CH 2 −
Chaînes latérales cationiques
Il existe trois acides aminés avec des chaînes latérales qui sont des cations à pH neutre (bien que dans un, les formes histidine, cationique et neutre existent toutes les deux). Ils sont communément appelés acides aminés basiques , mais ce terme est trompeur : l'histidine peut agir à la fois comme un acide de Brønsted et comme une base de Brønsted à pH neutre, la lysine agit comme un acide de Brønsted et l'arginine a une charge positive fixe et ne s'ionise pas dans conditions neutres. Les noms histidinium, lysinium et argininium seraient des noms plus précis pour les structures, mais n'ont essentiellement aucune devise.
- Histidine (His, H, ): Les formes protonées et déprotonées en équilibre sont représentées à gauche de l'image
- Lysine (Lys, K, ): Montré au milieu de l'image
- Arginine (Arg, R, ): Montré à droite de l'image
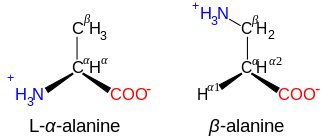
acides aminés β et γ
Acides aminés de structure NH+3−CXY−CXY−CO−2, comme la β-alanine , un composant de la carnosine et de quelques autres peptides, sont des acides β-aminés. Ceux de structure NH+3−CXY−CXY−CXY−CO−2sont des acides γ-aminés, et ainsi de suite, où X et Y sont deux substituants (dont l'un est normalement H).
Zwittérions
En solution aqueuse, les acides aminés à pH modéré existent sous forme de zwitterions , c'est-à-dire sous forme d'ions dipolaires avec à la fois NH+3et CO−2dans les états chargés, la structure globale est donc NH+3−CHR−CO−2. Au pH physiologique, les dites "formes neutres" -NH 2 -CHR-CO 2 H ne sont pas présentes à un degré mesurable. Bien que les deux charges dans la structure réelle totalisent zéro, il est trompeur et erroné d'appeler une espèce avec une charge nette de zéro "non chargée".
À un pH très bas (inférieur à 3), le groupe carboxylate devient protoné et la structure devient un acide ammoniocarboxylique, NH+3-CHR-CO 2 H . Ceci est pertinent pour les enzymes comme la pepsine qui sont actives dans des environnements acides tels que l'estomac et les lysosomes des mammifères , mais ne s'applique pas de manière significative aux enzymes intracellulaires. A pH très élevé (supérieur à 10, pas normalement observé dans des conditions physiologiques), le groupe ammonio est déprotoné pour donner NH 2 -CHR-CO−2.
Bien que diverses définitions des acides et des bases soient utilisées en chimie, la seule qui soit utile pour la chimie en solution aqueuse est celle de Brønsted : un acide est une espèce qui peut donner un proton à une autre espèce, et une base est celle qui peut accepter un proton. Ce critère est utilisé pour étiqueter les groupes dans l'illustration ci-dessus. Notez que l'aspartate et le glutamate sont les principaux groupes qui agissent comme des bases de Brønsted, et les références courantes à ceux-ci en tant qu'acides aminés acides (avec le terminal C) sont complètement fausses et trompeuses. De même, les acides aminés dits basiques comprennent un (l'histidine) qui agit à la fois comme un acide de Brønsted et une base, un (la lysine) qui agit principalement comme un acide de Brønsted et un (l'arginine) qui est normalement sans rapport avec le comportement acido-basique. car il a une charge positive fixe. De plus, la tyrosine et la cystéine, qui agissent principalement comme des acides à pH neutre, sont généralement oubliées dans la classification habituelle.
Point isoelectrique

Pour les acides aminés avec des chaînes latérales non chargées, le zwitterion prédomine à des valeurs de pH entre les deux valeurs de p Ka , mais coexiste en équilibre avec de petites quantités d'ions nets négatifs et nets positifs. Au point médian entre les deux valeurs de p Ka , la trace d'ions négatifs nets et la trace d'ions positifs nets s'équilibrent, de sorte que la charge nette moyenne de toutes les formes présentes est nulle. Ce pH est appelé point isoélectrique p I , donc p I =1/2(p K a1 + p K a2 ).
Pour les acides aminés avec des chaînes latérales chargées, le p Ka de la chaîne latérale est impliqué. Ainsi, pour l'aspartate ou le glutamate avec des chaînes latérales négatives, le groupe amino terminal est essentiellement entièrement sous la forme chargée NH+3, mais cette charge positive doit être équilibrée par l'état avec un seul groupe carboxylate C-terminal chargé négativement. Cela se produit à mi-chemin entre les deux valeurs de carboxylate p K a : p I =1/2(p K a1 + p K a(R) ), où p K a(R) est la chaîne latérale p K a .
Des considérations similaires s'appliquent à d'autres acides aminés avec des chaînes latérales ionisables, y compris non seulement le glutamate (similaire à l'aspartate), mais aussi la cystéine, l'histidine, la lysine, la tyrosine et l'arginine avec des chaînes latérales positives.
Les acides aminés ont une mobilité nulle en électrophorèse à leur point isoélectrique, bien que ce comportement soit plus généralement exploité pour les peptides et les protéines que pour les acides aminés simples. Les zwitterions ont une solubilité minimale à leur point isoélectrique, et certains acides aminés (en particulier, avec des chaînes latérales non polaires) peuvent être isolés par précipitation dans l'eau en ajustant le pH au point isoélectrique requis.
Propriétés physicochimiques des acides aminés
La CA. 20 acides aminés canoniques peuvent être classés selon leurs propriétés. Les facteurs importants sont la charge, l' hydrophilie ou l' hydrophobicité , la taille et les groupes fonctionnels. Ces propriétés influencent la structure des protéines et les interactions protéine-protéine . Les protéines hydrosolubles ont tendance à avoir leurs résidus hydrophobes ( Leu , Ile , Val , Phe et Trp ) enfouis au milieu de la protéine, tandis que les chaînes latérales hydrophiles sont exposées au solvant aqueux. (Notez qu'en biochimie , un résidu fait référence à un monomère spécifique dans la chaîne polymère d'un polysaccharide , d'une protéine ou d'un acide nucléique .) Les protéines membranaires intégrales ont tendance à avoir des anneaux externes d' acides aminés hydrophobes exposés qui les ancrent dans la bicouche lipidique . Certaines protéines membranaires périphériques ont un patch d'acides aminés hydrophobes sur leur surface qui se verrouille sur la membrane. De la même manière, les protéines qui doivent se lier à des molécules chargées positivement ont des surfaces riches en acides aminés chargés négativement comme le glutamate et l' aspartate , tandis que les protéines se liant à des molécules chargées négativement ont des surfaces riches en chaînes chargées positivement comme la lysine et l'arginine . Par exemple, la lysine et l'arginine sont fortement enrichies en régions de faible complexité de protéines de liaison aux acides nucléiques. Il existe différentes échelles d'hydrophobicité des résidus d'acides aminés.
Certains acides aminés ont des propriétés spéciales telles que la cystéine, qui peut former des liaisons disulfure covalentes avec d'autres résidus de cystéine, la proline qui forme un cycle vers le squelette polypeptidique et la glycine qui est plus flexible que les autres acides aminés.
De plus, la glycine et la proline sont fortement enrichies dans les régions de faible complexité des protéines eucaryotes et procaryotes, alors que l'inverse (sous-représenté) a été observé pour les acides aminés hautement réactifs, complexes ou hydrophobes, tels que la cystéine, la phénylalanine, le tryptophane, la méthionine. , valine, leucine, isoleucine.
De nombreuses protéines subissent une gamme de modifications post -traductionnelles , par lesquelles des groupes chimiques supplémentaires sont attachés aux chaînes latérales d'acides aminés. Certaines modifications peuvent produire des lipoprotéines hydrophobes ou des glycoprotéines hydrophiles . Ce type de modification permet le ciblage réversible d'une protéine vers une membrane. Par exemple, l'addition et l'élimination de l'acide palmitique d'acide gras aux résidus de cystéine dans certaines protéines de signalisation provoquent l'attachement et le détachement des protéines des membranes cellulaires.
Tableau des abréviations et propriétés standard des acides aminés
Bien que les symboles à une lettre soient inclus dans le tableau, l'IUPAC-IUBMB recommande que "l'utilisation des symboles à une lettre soit limitée à la comparaison de longues séquences".
| Acide aminé | Symboles à 3 et 1 lettres | Chaîne latérale |
Indice d'hydropathie |
Absorptivité molaire | Masse moléculaire | Abondance en protéines (%) |
Codage génétique standard, notation IUPAC |
||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 3 | 1 | Classer | Polarité | Charge nette à pH 7,4 |
Longueur d'onde, λ max (nm) |
Coefficient ε (mM −1 ·cm −1 ) |
|||||
| Alanine | Ala | UN | Aliphatique | Non polaire | Neutre | 1.8 | 89.094 | 8,76 | GCN | ||
| Arginine | Arg | R | Cation fixe | Polaire de base | Positif | −4,5 | 174.203 | 5,78 | MGR, CGY | ||
| asperge | Asn | N | Amide | Polaire | Neutre | −3,5 | 132.119 | 3,93 | AAI | ||
| Aspartate | Aspic | ré | Anion | Base Bronsted | Négatif | −3,5 | 133.104 | 5.49 | GAIS | ||
| Cystéine | Cys | C | Thiol | Acide de Brønsted | Neutre | 2.5 | 250 | 0,3 | 121.154 | 1.38 | UGY |
| Glutamine | Gn | Q | Amide | Polaire | Neutre | −3,5 | 146.146 | 3.9 | AUTO | ||
| Glutamate | Glu | E | Anion | Base Bronsted | Négatif | −3,5 | 147.131 | 6.32 | GAR | ||
| Glycine | Gly | g | Aliphatique | Non polaire | Neutre | −0,4 | 75.067 | 7.03 | GGN | ||
| Histidine | Le sien | H | Cation aromatique | Acide et base de Brønsted | Positif, 10 % Neutre, 90 % |
−3,2 | 211 | 5.9 | 155.156 | 2.26 | BANC DE SABLE |
| Isoleucine | Ile | je | Aliphatique | Non polaire | Neutre | 4.5 | 131.175 | 5.49 | AUH | ||
| Leucine | Leu | L | Aliphatique | Non polaire | Neutre | 3.8 | 131.175 | 9.68 | YUR, CUY | ||
| Lysine | Lys | K | Cation | Acide de Brønsted | Positif | −3,9 | 146.189 | 5.19 | RAA | ||
| Méthionine | Rencontré | M | Thioéther | Non polaire | Neutre | 1.9 | 149.208 | 2.32 | AOÛT | ||
| Phénylalanine | Phé | F | Aromatique | Non polaire | Neutre | 2.8 | 257, 206, 188 | 0,2, 9,3, 60,0 | 165.192 | 3,87 | UUY |
| Proline | Pro | P | Cyclique | Non polaire | Neutre | −1,6 | 115.132 | 5.02 | CCN | ||
| Sérine | Ser | S | Hydroxylique | Polaire | Neutre | −0,8 | 105.093 | 7.14 | UCN, AGY | ||
| Thréonine | Thr | J | Hydroxylique | Polaire | Neutre | −0,7 | 119.119 | 5.53 | ACN | ||
| Tryptophane | Trp | O | Aromatique | Non polaire | Neutre | −0,9 | 280, 219 | 5.6, 47.0 | 204.228 | 1.25 | UGG |
| Tyrosine | Tyr | Oui | Aromatique | Acide de Brønsted | Neutre | −1,3 | 274, 222, 193 | 1.4, 8.0, 48.0 | 181.191 | 2,91 | UAY |
| Valine | Val | V | Aliphatique | Non polaire | Neutre | 4.2 | 117.148 | 6,73 | PISTOLET | ||
Deux acides aminés supplémentaires sont chez certaines espèces codés par des codons qui sont généralement interprétés comme des codons stop :
| 21e et 22e acides aminés | 3 lettres | 1 lettre | Masse moléculaire |
|---|---|---|---|
| Sélénocystéine | Seconde | tu | 168.064 |
| Pyrrolysine | Pyl | O | 255.313 |
En plus des codes d'acides aminés spécifiques, des espaces réservés sont utilisés dans les cas où l'analyse chimique ou cristallographique d'un peptide ou d'une protéine ne peut pas déterminer de manière concluante l'identité d'un résidu. Ils sont également utilisés pour résumer les motifs de séquences de protéines conservées . L'utilisation de lettres simples pour indiquer des ensembles de résidus similaires est similaire à l'utilisation de codes d'abréviation pour les bases dégénérées .
| Acides aminés ambigus | 3 lettres | 1 lettre | Acides aminés inclus | Codons inclus |
|---|---|---|---|---|
| Tout / inconnu | Xaa | X | Tout | NNN |
| Asparagine ou aspartate | Asx | B | D, N | RAYON |
| Glutamine ou glutamate | Gx | Z | E, Q | DAS |
| Leucine ou isoleucine | Xle | J | Je, L | YTR, ATH, CTY |
| Hydrophobe | Φ | V, I, L, F, W, Y, M | NTN, TAY, TGG | |
| Aromatique | Ω | F, W, Y, H | YWY, ATS, TGG | |
| Aliphatique (non aromatique) | Ψ | V, I, L, M | VTN, TTR | |
| Petit | π | P, G, A, S | BCN, RGY, GGR | |
| Hydrophile | ζ | S, T, H, N, Q, E, D, K, R | VAN, WCN, CGN, AGY | |
| Chargé positivement | + | K, R, H | ARR, CRY, CGR | |
| Chargé négativement | − | D, E | GAN |
Unk est parfois utilisé à la place de Xaa , mais est moins standard.
Ter ou * (de la terminaison) est utilisé dans la notation des mutations dans les protéines lorsqu'un codon d'arrêt se produit. Il ne correspond à aucun acide aminé du tout.
De plus, de nombreux acides aminés non standard ont un code spécifique. Par exemple, plusieurs médicaments peptidiques, tels que Bortezomib et MG132 , sont synthétisés artificiellement et conservent leurs groupes protecteurs , qui ont des codes spécifiques. Bortezomib est Pyz -Phe-boroLeu et MG132 est Z -Leu-Leu-Leu-al. Pour faciliter l'analyse de la structure des protéines, des analogues d'acides aminés photoréactifs sont disponibles. Ceux-ci comprennent la photoleucine ( pLeu ) et la photométhionine ( pMet ).
Occurrence et fonctions en biochimie
Les acides aminés qui ont le groupe amine attaché à l' atome de carbone (alpha-) à côté du groupe carboxyle ont une importance primordiale dans les organismes vivants car ils participent à la synthèse des protéines. Ils sont connus sous le nom d'acides 2- , alpha- ou α-aminés ( formule générique H 2 NCHRCOOH dans la plupart des cas, où R est un substituant organique appelé « chaîne latérale ») ; souvent le terme "acide aminé" est utilisé pour se référer spécifiquement à ceux-ci. Ils comprennent les 22 acides aminés protéinogènes ("protéines de construction"), qui se combinent en chaînes peptidiques ("polypeptides") pour former les éléments constitutifs d'un vaste éventail de protéines. Ce sont tous des stéréoisomères L ( énantiomères " gauchers " ) , bien que quelques acides aminés D (" droitiers " ) soient présents dans les enveloppes bactériennes , comme neuromodulateur ( D - sérine ) et dans certains antibiotiques .
De nombreux acides aminés protéinogènes et non protéinogènes ont des fonctions biologiques. Par exemple, dans le cerveau humain , le glutamate ( acide glutamique standard ) et l'acide gamma-aminobutyrique ("GABA", acide aminé gamma non standard) sont, respectivement, les principaux neurotransmetteurs excitateurs et inhibiteurs . L'hydroxyproline , composant majeur du collagène du tissu conjonctif , est synthétisée à partir de la proline . La glycine est un précurseur biosynthétique des porphyrines utilisées dans les globules rouges . La carnitine est utilisée dans le transport des lipides . Neuf acides aminés protéinogènes sont dits « essentiels » pour l'homme car ils ne peuvent pas être produits à partir d'autres composés par le corps humain et doivent donc être absorbés par l'alimentation. D'autres peuvent être conditionnellement essentiels pour certains âges ou conditions médicales. Les acides aminés essentiels peuvent également varier d' une espèce à l'autre. En raison de leur importance biologique, les acides aminés sont importants dans la nutrition et sont couramment utilisés dans les suppléments nutritionnels , les engrais , les aliments pour animaux et la technologie alimentaire . Les utilisations industrielles comprennent la production de médicaments , de plastiques biodégradables et de catalyseurs chiraux .
Acides aminés protéinogènes
Les acides aminés sont les précurseurs des protéines. Ils se rejoignent par des réactions de condensation pour former de courtes chaînes polymères appelées peptides ou des chaînes plus longues appelées polypeptides ou protéines. Ces chaînes sont linéaires et non ramifiées, chaque résidu d'acide aminé dans la chaîne étant attaché à deux acides aminés voisins. Dans Nature, le processus de fabrication de protéines codées par du matériel génétique ADN/ARN est appelé traduction et implique l'ajout étape par étape d'acides aminés à une chaîne protéique en croissance par un ribozyme appelé ribosome . L'ordre dans lequel les acides aminés sont ajoutés est lu dans le code génétique à partir d'une matrice d' ARNm , qui est une copie d' ARN d'un des gènes de l'organisme .
Vingt-deux acides aminés sont naturellement incorporés dans les polypeptides et sont appelés acides aminés protéinogènes ou naturels. Parmi ceux-ci, 20 sont codés par le code génétique universel. Les 2 autres, la sélénocystéine et la pyrrolysine , sont incorporées dans les protéines par des mécanismes de synthèse uniques. La sélénocystéine est incorporée lorsque l'ARNm en cours de traduction comprend un élément SECIS , ce qui amène le codon UGA à coder la sélénocystéine au lieu d'un codon stop. La pyrrolysine est utilisée par certaines archées méthanogènes dans les enzymes qu'elles utilisent pour produire du méthane . Il est codé avec le codon UAG, qui est normalement un codon stop dans d'autres organismes. Ce codon UAG est suivi d'une séquence PYLIS en aval .
Plusieurs études évolutives indépendantes ont suggéré que Gly, Ala, Asp, Val, Ser, Pro, Glu, Leu, Thr pourraient appartenir à un groupe d'acides aminés qui constituaient le code génétique précoce, alors que Cys, Met, Tyr, Trp, His, Phe peut appartenir à un groupe d'acides aminés qui ont constitué des ajouts ultérieurs du code génétique.
Acides aminés standard vs non standard
Les 20 acides aminés qui sont codés directement par les codons du code génétique universel sont appelés acides aminés standards ou canoniques . Une forme modifiée de méthionine ( N -formylméthionine ) est souvent incorporée à la place de la méthionine comme acide aminé initial des protéines dans les bactéries, les mitochondries et les chloroplastes. D'autres acides aminés sont dits non standards ou non canoniques . La plupart des acides aminés non standard sont également non protéinogènes (c'est-à-dire qu'ils ne peuvent pas être incorporés dans les protéines lors de la traduction), mais deux d'entre eux sont protéinogènes, car ils peuvent être incorporés de manière traductionnelle dans les protéines en exploitant des informations non codées dans le code génétique universel.
Les deux acides aminés protéinogènes non standard sont la sélénocystéine (présente chez de nombreux non-eucaryotes ainsi que la plupart des eucaryotes, mais non codée directement par l'ADN) et la pyrrolysine (présente uniquement chez certaines archées et au moins une bactérie ). L'incorporation de ces acides aminés non standards est rare. Par exemple, 25 protéines humaines incluent la sélénocystéine dans leur structure primaire, et les enzymes structurellement caractérisées (sélénoenzymes) utilisent la sélénocystéine comme fraction catalytique dans leurs sites actifs. La pyrrolysine et la sélénocystéine sont codées via des codons variants. Par exemple, la sélénocystéine est codée par le codon stop et l'élément SECIS .
La N -formylméthionine (qui est souvent l'acide aminé initial des protéines dans les bactéries, les mitochondries et les chloroplastes ) est généralement considérée comme une forme de méthionine plutôt que comme un acide aminé protéinogène distinct. Des combinaisons codon- ARNt introuvables dans la nature peuvent également être utilisées pour « étendre » le code génétique et former de nouvelles protéines appelées alloprotéines incorporant des acides aminés non protéinogènes .
Acides aminés non protéinogènes
Outre les 22 acides aminés protéinogènes , de nombreux acides aminés non protéinogènes sont connus. Ceux-ci ne se trouvent pas dans les protéines (par exemple la carnitine , le GABA , la lévothyroxine ) ou ne sont pas produits directement et isolément par la machinerie cellulaire standard (par exemple, l' hydroxyproline et la sélénométhionine ).
Les acides aminés non protéinogènes présents dans les protéines sont formés par modification post-traductionnelle , c'est-à-dire modification après traduction lors de la synthèse des protéines. Ces modifications sont souvent essentielles pour la fonction ou la régulation d'une protéine. Par exemple, la carboxylation du glutamate permet une meilleure liaison des cations calcium , et le collagène contient de l'hydroxyproline, générée par hydroxylation de la proline . Un autre exemple est la formation d' hypusine dans le facteur d'initiation de la traduction EIF5A , par modification d'un résidu lysine. De telles modifications peuvent également déterminer la localisation de la protéine, par exemple, l'ajout de longs groupes hydrophobes peut amener une protéine à se lier à une membrane phospholipidique .
Certains acides aminés non protéinogènes ne se trouvent pas dans les protéines. Les exemples incluent l'acide 2-aminoisobutyrique et le neurotransmetteur acide gamma-aminobutyrique . Les acides aminés non protéinogènes se produisent souvent comme intermédiaires dans les voies métaboliques des acides aminés standard - par exemple, l' ornithine et la citrulline se produisent dans le cycle de l' urée , une partie du catabolisme des acides aminés (voir ci-dessous). Une rare exception à la dominance des acides α-aminés en biologie est l'acide β-aminé bêta alanine (acide 3-aminopropanoïque), qui est utilisé dans les plantes et les micro-organismes dans la synthèse de l'acide pantothénique (vitamine B 5 ), un composant de coenzyme A.
En nutrition humaine

Lorsqu'ils sont absorbés par le corps humain à partir de l'alimentation, les 20 acides aminés standard sont soit utilisés pour synthétiser des protéines, d'autres biomolécules, soit sont oxydés en urée et en dioxyde de carbone comme source d'énergie. La voie d'oxydation commence par l'élimination du groupe amino par une transaminase ; le groupe amino est ensuite introduit dans le cycle de l' urée . L'autre produit de la transamidation est un acide céto qui entre dans le cycle de l'acide citrique . Les acides aminés glucogéniques peuvent également être convertis en glucose, par gluconéogenèse . Sur les 20 acides aminés standards, neuf ( His , Ile , Leu , Lys , Met , Phe , Thr , Trp et Val ) sont appelés acides aminés essentiels car le corps humain ne peut pas les synthétiser à partir d'autres composés au niveau nécessaire à une croissance normale, ils doivent donc être obtenus à partir de la nourriture. De plus, la cystéine, la tyrosine et l'arginine sont considérées comme des acides aminés semi-essentiels, et la taurine comme un acide aminosulfonique semi-essentiel chez les enfants. Les voies métaboliques qui synthétisent ces monomères ne sont pas complètement développées. Les quantités nécessaires dépendent également de l'âge et de la santé de l'individu, il est donc difficile de faire des déclarations générales sur les besoins alimentaires en certains acides aminés. L'exposition alimentaire à l'acide aminé non standard BMAA a été associée à des maladies neurodégénératives humaines, y compris la SLA .
• PA : acide phosphatidique
• mTOR : cible mécaniste de la rapamycine
• AMP : adénosine monophosphate
• ATP : adénosine triphosphate
• AMPK : protéine kinase activée par l'AMP
• PGC‐1α : coactivateur gamma-1α du récepteur activé par les proliférateurs de peroxysomes
• S6K1 : p70S6 kinase
• 4EBP1 : facteur d'initiation de la traduction eucaryote 4E-binding protein 1
• eIF4E : facteur d'initiation de la traduction eucaryote 4E
• RPS6 : protéine ribosomale S6
• eEF2 : facteur d'élongation eucaryote 2
• RE : exercice de résistance ; EE : exercice d'endurance
• Myo : myofibrillaire ; Mito : mitochondrial
• AA : acides aminés
• HMB : acide β-hydroxy β-méthylbutyrique
• ↑ représente l'activation
• Τ représente l'inhibition
Fonctions non protéiques
|
|
Chez l'homme, les acides aminés non protéiques jouent également un rôle important en tant qu'intermédiaires métaboliques , comme dans la biosynthèse du neurotransmetteur acide gamma-aminobutyrique (GABA). De nombreux acides aminés sont utilisés pour synthétiser d'autres molécules, par exemple :
- Le tryptophane est un précurseur du neurotransmetteur sérotonine .
- La tyrosine (et son précurseur la phénylalanine) sont des précurseurs des neurotransmetteurs catécholamines dopamine , épinéphrine et noradrénaline et de diverses traces d'amines .
- La phénylalanine est un précurseur de la phénéthylamine et de la tyrosine chez l'homme. Chez les plantes, c'est un précurseur de divers phénylpropanoïdes , qui sont importants dans le métabolisme des plantes.
- La glycine est un précurseur des porphyrines comme l' hème .
- L' arginine est un précurseur de l'oxyde nitrique .
- L'ornithine et la S - adénosylméthionine sont des précurseurs des polyamines .
- L'aspartate , la glycine et la glutamine sont des précurseurs des nucléotides . Cependant, toutes les fonctions d'autres acides aminés non standard abondants ne sont pas connues.
Certains acides aminés non standard sont utilisés comme défenses contre les herbivores chez les plantes. Par exemple, la canavanine est un analogue de l'arginine que l'on trouve dans de nombreuses légumineuses , et en quantités particulièrement importantes dans Canavalia gladiata (haricot sabre). Cet acide aminé protège les plantes des prédateurs tels que les insectes et peut provoquer des maladies chez les personnes si certains types de légumineuses sont consommés sans transformation. L'acide aminé non protéique mimosine se trouve dans d'autres espèces de légumineuses, en particulier Leucaena leucocephala . Ce composé est un analogue de la tyrosine et peut empoisonner les animaux qui broutent ces plantes.
Utilisations dans l'industrie
Les acides aminés sont utilisés pour une variété d'applications dans l'industrie, mais leur utilisation principale est en tant qu'additifs pour l'alimentation animale . Cela est nécessaire, car de nombreux composants en vrac de ces aliments, tels que le soja , ont soit de faibles niveaux, soit manquent de certains des acides aminés essentiels : la lysine, la méthionine, la thréonine et le tryptophane sont les plus importants dans la production de ces aliments. Dans cette industrie, les acides aminés sont également utilisés pour chélater les cations métalliques afin d'améliorer l'absorption des minéraux des suppléments, qui peuvent être nécessaires pour améliorer la santé ou la productivité de ces animaux.
L' industrie alimentaire est également une grande consommatrice d'acides aminés, en particulier d'acide glutamique , qui est utilisé comme exhausteur de goût , et d' aspartame (ester 1-méthylique d'aspartylphénylalanine) comme édulcorant artificiel hypocalorique . Une technologie similaire à celle utilisée pour la nutrition animale est utilisée dans l'industrie de la nutrition humaine pour atténuer les symptômes de carences minérales, telles que l'anémie, en améliorant l'absorption des minéraux et en réduisant les effets secondaires négatifs de la supplémentation en minéraux inorganiques.
La capacité de chélation des acides aminés a été utilisée dans les engrais pour l'agriculture pour faciliter l'apport de minéraux aux plantes afin de corriger les carences minérales, telles que la chlorose ferrique. Ces engrais sont également utilisés pour prévenir les carences et améliorer la santé globale des plantes. Le reste de la production d'acides aminés est utilisé dans la synthèse de médicaments et de cosmétiques .
De même, certains dérivés d'acides aminés sont utilisés dans l'industrie pharmaceutique. Ils comprennent le 5-HTP (5-hydroxytryptophane) utilisé pour le traitement expérimental de la dépression, la L - DOPA ( L -dihydroxyphénylalanine ) pour le traitement de la maladie de Parkinson et l' éflornithine , un médicament qui inhibe l' ornithine décarboxylase et utilisé dans le traitement de la maladie du sommeil .
Code génétique étendu
Depuis 2001, 40 acides aminés non naturels ont été ajoutés à la protéine en créant un codon unique (recodage) et une paire de transfert-ARN: aminoacyle - ARNt-synthétase correspondante pour la coder avec diverses propriétés physicochimiques et biologiques afin d'être utilisé comme un outil pour explorer la structure et la fonction des protéines ou pour créer des protéines nouvelles ou améliorées.
nullomères
Les nullomères sont des codons qui codent en théorie pour un acide aminé, cependant, dans la nature, il existe un biais sélectif contre l'utilisation de ce codon en faveur d'un autre, par exemple les bactéries préfèrent utiliser CGA au lieu d'AGA pour coder pour l'arginine. Cela crée des séquences qui n'apparaissent pas dans le génome. Cette caractéristique peut être mise à profit et utilisée pour créer de nouveaux médicaments sélectifs contre le cancer et pour prévenir la contamination croisée des échantillons d'ADN provenant d'enquêtes sur les lieux du crime.
Blocs de construction chimiques
Les acides aminés sont importants en tant que matières premières à faible coût . Ces composés sont utilisés dans la synthèse de pools chiraux en tant que blocs de construction énantiomériquement purs .
Les acides aminés ont été étudiés en tant que précurseurs de catalyseurs chiraux, comme pour les réactions d'hydrogénation asymétriques , bien qu'aucune application commerciale n'existe.
Plastiques biodégradables
Les acides aminés ont été considérés comme des composants de polymères biodégradables, qui ont des applications comme emballages respectueux de l'environnement et en médecine dans l'administration de médicaments et la construction d' implants prothétiques . Un exemple intéressant de tels matériaux est le polyaspartate , un polymère biodégradable soluble dans l'eau qui peut avoir des applications dans les couches jetables et l'agriculture. En raison de sa solubilité et de sa capacité à chélater les ions métalliques, le polyaspartate est également utilisé comme agent antitartre biodégradable et inhibiteur de corrosion . De plus, l'acide aminé aromatique tyrosine a été considéré comme un substitut possible des phénols tels que le bisphénol A dans la fabrication des polycarbonates .
La synthèse
Synthèse chimique
La production commerciale d'acides aminés repose généralement sur des bactéries mutantes qui surproduisent des acides aminés individuels en utilisant du glucose comme source de carbone. Certains acides aminés sont produits par des conversions enzymatiques d'intermédiaires synthétiques. L'acide 2-aminothiazoline-4-carboxylique est un intermédiaire dans une synthèse industrielle de la L -cystéine par exemple. L'acide aspartique est produit par l'addition d'ammoniac au fumarate à l' aide d'une lyase.
Biosynthèse
Chez les plantes, l'azote est d'abord assimilé en composés organiques sous forme de glutamate , formé à partir d'alpha-cétoglutarate et d'ammoniac dans la mitochondrie. Pour les autres acides aminés, les plantes utilisent des transaminases pour déplacer le groupe amino du glutamate vers un autre acide alpha-céto. Par exemple, l'aspartate aminotransférase convertit le glutamate et l'oxaloacétate en alpha-cétoglutarate et en aspartate. D'autres organismes utilisent également les transaminases pour la synthèse des acides aminés.
Les acides aminés non standard sont généralement formés par des modifications d'acides aminés standard. Par exemple, l'homocystéine est formée par la voie de transsulfuration ou par la déméthylation de la méthionine via le métabolite intermédiaire S - adénosylméthionine , tandis que l' hydroxyproline est fabriquée par une modification post-traductionnelle de la proline .
Les micro -organismes et les plantes synthétisent de nombreux acides aminés peu communs. Par exemple, certains microbes fabriquent de l'acide 2-aminoisobutyrique et de la lanthionine , qui est un dérivé de l'alanine à pont sulfure. Ces deux acides aminés se trouvent dans les lantibiotiques peptidiques tels que l'alaméthicine . Cependant, chez les plantes, l'acide 1-aminocyclopropane-1-carboxylique est un petit acide aminé cyclique disubstitué qui est un intermédiaire dans la production de l'hormone végétale éthylène .
Réactions
Les acides aminés subissent les réactions attendues des groupes fonctionnels constitutifs.
Formation de liaisons peptidiques

Comme les groupes amine et acide carboxylique des acides aminés peuvent réagir pour former des liaisons amide, une molécule d'acide aminé peut réagir avec une autre et se joindre par une liaison amide. Cette polymérisation des acides aminés est ce qui crée des protéines. Cette réaction de condensation donne la liaison peptidique nouvellement formée et une molécule d'eau. Dans les cellules, cette réaction ne se produit pas directement ; au lieu de cela, l'acide aminé est d'abord activé par fixation à une molécule d' ARN de transfert via une liaison ester . Cet aminoacyl-ARNt est produit dans une réaction dépendante de l' ATP réalisée par une aminoacyl ARNt synthétase . Cet aminoacyl-ARNt est alors un substrat pour le ribosome, qui catalyse l'attaque du groupe amino de la chaîne protéique en allongement sur la liaison ester. En raison de ce mécanisme, toutes les protéines fabriquées par les ribosomes sont synthétisées en commençant par leur extrémité N -terminale et en se déplaçant vers leur extrémité C -terminale.
Cependant, toutes les liaisons peptidiques ne sont pas formées de cette manière. Dans quelques cas, les peptides sont synthétisés par des enzymes spécifiques. Par exemple, le tripeptide glutathion est un élément essentiel des défenses des cellules contre le stress oxydatif. Ce peptide est synthétisé en deux étapes à partir d'acides aminés libres. Dans la première étape, la gamma-glutamylcystéine synthétase condense la cystéine et le glutamate par une liaison peptidique formée entre le carboxyle de la chaîne latérale du glutamate (le carbone gamma de cette chaîne latérale) et le groupe amino de la cystéine. Ce dipeptide est ensuite condensé avec la glycine par la glutathion synthétase pour former le glutathion.
En chimie, les peptides sont synthétisés par diverses réactions. L'un des plus utilisés dans la synthèse peptidique en phase solide utilise les dérivés d'oximes aromatiques d'acides aminés comme unités activées. Ceux-ci sont ajoutés en séquence sur la chaîne peptidique en croissance, qui est attachée à un support de résine solide. Les bibliothèques de peptides sont utilisées dans la découverte de médicaments grâce à un criblage à haut débit .
La combinaison de groupes fonctionnels permet aux acides aminés d'être des ligands polydentés efficaces pour les chélates métal-acide aminé. Les multiples chaînes latérales des acides aminés peuvent également subir des réactions chimiques.
Catabolisme

* Glucogéniques , avec les produits ayant la capacité de former du glucose par gluconéogenèse
* Cétogènes , avec les produits n'ayant pas la capacité de former du glucose. Ces produits peuvent encore être utilisés pour la cétogenèse ou la synthèse des lipides .
* Acides aminés catabolisés en produits glucogéniques et cétogènes.
La dégradation d'un acide aminé implique souvent une désamination en déplaçant son groupe amino en alpha-cétoglutarate, formant du glutamate . Ce processus fait intervenir des transaminases, souvent les mêmes que celles utilisées en amination lors de la synthèse. Chez de nombreux vertébrés, le groupe amino est ensuite éliminé par le cycle de l' urée et est excrété sous forme d' urée . Cependant, la dégradation des acides aminés peut produire de l'acide urique ou de l'ammoniac à la place. Par exemple, la sérine déshydratase convertit la sérine en pyruvate et en ammoniac. Après élimination d'un ou plusieurs groupes amino, le reste de la molécule peut parfois être utilisé pour synthétiser de nouveaux acides aminés, ou il peut être utilisé pour l'énergie en entrant dans la glycolyse ou le cycle de l'acide citrique , comme détaillé dans l'image à droite.
Complexation
Les acides aminés sont des ligands bidentés, formant des complexes d'acides aminés de métaux de transition .
Analyse chimique
La teneur totale en azote de la matière organique est principalement formée par les groupes amino des protéines. L'azote total Kjeldahl ( NTK ) est une mesure de l'azote largement utilisée dans l'analyse des eaux (usées), des sols, des denrées alimentaires, des aliments pour animaux et de la matière organique en général. Comme son nom l'indique, la méthode Kjeldahl est appliquée. Des méthodes plus sensibles sont disponibles.
Voir également
Remarques
Références
Lectures complémentaires
- Tymoczko JL (2012). « Composition et structure des protéines » . Biochimie . New York : WH Freeman et compagnie. p. 28–31. ISBN 9781429229364.
- Doolittle RF (1989). « Redondances dans les séquences de protéines ». Dans Fasman GD (éd.). Prédictions de la structure des protéines et principes de la conformation des protéines . New York : presse plénière . p. 599–623. ISBN 978-0-306-43131-9. RCAC 89008555 .
- Nelson DL, Cox MM (2000). Principes de biochimie de Lehninger (3e éd.). Worth Publishers . ISBN 978-1-57259-153-0. RCAC 99049137 .
-
Meierhenrich U (2008). Les acides aminés et l'asymétrie de la vie (PDF) . Berlin : Springer Verlag . ISBN 978-3-540-76885-2. RCAC 2008930865 . Archivé de l'original le 12 janvier 2012.
{{cite book}}: CS1 maint : bot : état de l'URL d'origine inconnu ( lien )
Liens externes
-
 Médias liés à l' acide aminé sur Wikimedia Commons
Médias liés à l' acide aminé sur Wikimedia Commons