Effet anomérique - Anomeric effect
En chimie organique , l' effet anomérique ou effet Edward-Lemieux est un effet stéréoélectronique qui décrit la tendance des substituants hétéroatomiques adjacents à un hétéroatome dans un cycle cyclohexane à préférer l' orientation axiale au lieu de l' orientation équatoriale moins entravée que l'on attendrait de considérations stériques . Cet effet a été initialement observé dans les anneaux de pyranose par JT Edward en 1955 lors de l'étude de la chimie des glucides .
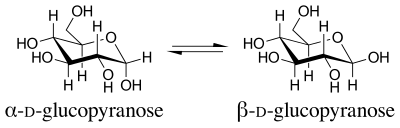
Le terme effet anomérique a été introduit en 1958. Le nom vient du terme utilisé pour désigner le carbone cyclique le plus petit d'un pyranose, le carbone anomérique . Les isomères qui ne diffèrent que par la configuration au niveau du carbone anomérique sont appelés anomères . Les anomères du D- glucopyranose sont des diastéréoisomères , l' anomère bêta ayant un groupe OH pointant vers le haut équatorialement, et l' anomère alpha ayant ce groupe OH pointant axialement vers le bas.
L'effet anomère peut également être généralisé à n'importe quel cyclohexyle ou système linéaire de formule générale CYCX, où Y est un hétéroatome avec une ou plusieurs paires isolées , et X est un atome ou groupe électronégatif . L'ampleur de l'effet anomérique est estimée à environ 1–2 kcal / mol dans le cas des sucres, mais est différente pour chaque molécule.
Dans le cas ci-dessus, le groupe méthoxy sur le cycle cyclohexane (en haut) préfère la position équatoriale. Cependant, dans l' anneau tétrahydropyrane (en bas), le groupe méthoxy préfère la position axiale. En effet, dans le cycle cyclohexane, Y = carbone, qui n'est pas un hétéroatome, de sorte que l'effet anomérique n'est pas observé et les stériques dominent la position de substituant observée . Dans le cycle tétrahydropyrane, Y = oxygène, qui est un hétéroatome, donc l'effet anomérique contribue et stabilise la position de substituant observée. Dans les deux cas, X = OMe.
L'effet anomérique est le plus souvent observé lorsque Y = oxygène, mais peut également être observé avec d'autres paires isolées portant des hétéroatomes dans le cycle, tels que l'azote, le soufre et le phosphore. La méthode exacte par laquelle l'effet anomérique provoque la stabilisation est un point de controverse, et plusieurs hypothèses ont été proposées pour l'expliquer.
Explication physique et controverse
La raison physique de l'effet anomérique n'est pas complètement comprise. Plusieurs explications, en partie contradictoires, ont été proposées et le sujet n'est toujours pas réglé.
Hyperconjugaison
Molécules cycliques
Une explication largement acceptée est qu'il existe une interaction stabilisatrice ( hyperconjugaison ) entre la paire d'électrons non partagés sur l'hétéroatome endocyclique (dans le cycle sucre) et l'orbitale σ * de la liaison axiale (exocyclique) C – X. Cela amène la molécule à aligner la paire d'électrons solitaire donatrice antiperiplanar (180 °) à la liaison exocyclique CX σ, abaissant l'énergie globale du système et augmentant la stabilité.
Certains auteurs remettent également en question la validité de ce modèle d'hyperconjugaison basé sur les résultats de la théorie quantique des atomes dans les molécules . Alors que la plupart des études sur les effets anomériques ont été de nature théorique, l'hypothèse n – σ * (hyperconjugaison) a également été largement critiquée au motif que la redistribution de la densité électronique dans les acétals proposée par cette hypothèse n'est pas conforme à la chimie expérimentale connue de les acétals et, en particulier, la chimie des monosaccharides.
Molécules acycliques
L'hyperconjugaison se retrouve également dans les molécules acycliques contenant des hétéroatomes, une autre forme d'effet anomérique. Si une molécule a un atome avec une seule paire d'électrons et que l'atome adjacent est capable d'accepter des électrons dans l'orbitale σ *, une hyperconjugaison se produit, stabilisant la molécule. Cela forme une forme de résonance «sans liaison». Pour que ce chevauchement orbitaire se produise, la conformation trans , trans est préférée pour la plupart des hétéroatomes, mais pour que la stabilisation se produise dans le diméthoxyméthane , la conformation gauche , gauche est d'environ 3 à 5 kcal / mol inférieure en énergie (plus stable) que la trans , trans conformation - c'est environ deux fois plus grand que l'effet sur les sucres car il y a deux liaisons rotatives (donc c'est trans autour des deux liaisons ou gauche autour des deux) qui sont affectées.
Minimisation des dipôles
Une autre explication acceptée de l'effet anomérique est que la configuration équatoriale a les dipôles impliquant les deux hétéroatomes partiellement alignés, et donc se repoussant. En revanche, la configuration axiale a ces dipôles sensiblement opposés, représentant ainsi un état d'énergie plus stable et plus faible.
L'hyperconjugaison et la minimisation du dipôle contribuent toutes deux à la conformation (Z) préférée des esters par rapport à la conformation (E). Dans la conformation (Z), la seule paire d'électrons dans l'oxygène alpha peut donner dans l'orbitale σ * CO voisine. De plus, le dipôle est minimisé dans la configuration (Z) et maximisé dans la configuration (E).
répulsions nn et liaison CH hydrogène
Si les paires d'électrons isolées sur les oxygènes au centre anomérique du 2-méthoxypyrane sont montrées, un bref examen des conformations des anomères révèle que le β-anomère a toujours au moins une paire d'éclipses (1,3- coplanaire interagissant) des paires isolées, cette répulsion nn est une situation à haute énergie. D'autre part, l'α-anomère a des conformations dans lesquelles il n'y a pas de nn répulsions, et cela est vrai dans la conformation exo-anomérique. La répulsion nn énergétiquement défavorable présente dans le β-anomère, couplée à la liaison hydrogène énergétiquement favorable entre le H-5 axial et une seule paire d'électrons sur le substituant α-anomérique axial (liaison hydrogène CH / n), a été suggérée [ références 7 et 8] pour rendre compte de l'essentiel de la différence énergétique entre les anomères, l'effet anomérique. Le programme de mécanique moléculaire StruMM3D, qui n'est pas spécialement paramétré pour l'effet anomérique, estime que les contributions dipolaires à l'effet anomérique (principalement la répulsion nn et la liaison CH hydrogène évoquées ci-dessus) sont d'environ 1,5 kcal / mol.
Les influences
Alors que l'effet anomérique est une explication générale de ce type de stabilisation pour une molécule, le type et la quantité de stabilisation peuvent être affectés par les substituants examinés ainsi que par le solvant étudié.
Effet de substitution
Dans un système fermé, il y a une différence observée dans l'effet anomère pour différents substituants sur un cycle cyclohexane ou tétrahydropyrane (Y = oxygène). Lorsque X = OH, l'effet anomérique générique peut être observé, comme expliqué précédemment. Lorsque X = CN, on observe les mêmes résultats, où la position équatoriale est préférée sur le cycle cyclohexane, mais la position axiale est préférée sur le cycle tétrahydropyrane. Ceci est cohérent avec la stabilisation de l'effet anomérique. Lorsque X = F, l'effet anomérique est en fait observé pour les deux anneaux. Cependant, lorsque X = NH 2 , aucune stabilisation par effet anomérique n'est observée et les deux systèmes préfèrent la position équatoriale. Ceci est attribué à la fois aux stériques et à un effet appelé effet anomérique inverse (voir ci-dessous).
Effet solvant
Une critique courante de la théorie de l' hyperconjugaison est qu'elle ne parvient pas à expliquer pourquoi l'effet anomérique n'est pas observé lorsque des molécules de tétrahydropyrane substituées sont placées dans des solvants polaires , et la position équatoriale est à nouveau préférée. Il a cependant été montré que l'hyperconjugaison dépend du solvant dans le système. Chacun des systèmes substitués décrits ci-dessus a été testé en phase gazeuse (c'est-à-dire sans solvant) et en solution aqueuse (c'est-à-dire solvant polaire). Lorsque X = F, l'effet anomérique a été observé dans les deux milieux, et la position axiale a toujours été préférée. Ceci est attribué à l'hyperconjugaison. Lorsque X = OH ou CN, l'effet anomère est observé en phase gazeuse, lorsque la position axiale est préférée. Cependant, dans les solutions aqueuses, les deux substituants préféraient la position équatoriale. Ceci est attribué au fait qu'il y a plus de répulsions électrostatiques avec le substituant positionné axialement et le solvant polaire, ce qui fait que la position équatoriale est préférée. Lorsque X = NH 2 , là encore, aucun effet anomérique n'a été observé et la position équatoriale a toujours été préférée.
Surmonter l'effet anomérique
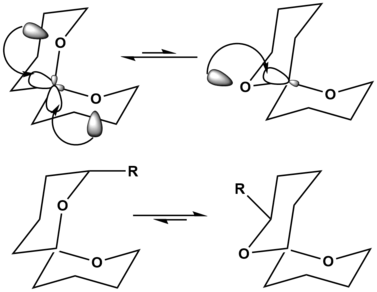
Bien que l'effet anomérique puisse provoquer la stabilisation des molécules, il a une ampleur à sa stabilisation, et cette valeur peut être surmontée par d'autres effets plus déstabilisants dans certains cas.
Dans l'exemple des spirocétals, l'orientation en haut à gauche montre une stabilisation par effet anomérique hyperconjugatif deux fois, stabilisant ainsi fortement l'orientation de la molécule. L'orientation en haut à droite ne montre qu'une seule fois cette stabilisation anomérique hyperconjugative, ce qui en fait la structure la moins préférée. Cependant, lorsque des substituants sont ajoutés sur le squelette spirocétal, la structure la plus préférée peut être modifiée. Lorsqu'un gros substituant est ajouté au squelette spirocétal, comme on le voit en bas à gauche, la souche d'avoir ce gros substituant, R, en position axiale est fortement déstabilisante pour la molécule. Dans la molécule en bas à droite, R est maintenant en position équatoriale, ce qui n'entraîne plus de déstabilisation de la molécule. Par conséquent, sans substituants, la réaction d'équilibre supérieur est favorisée du côté gauche, tandis que l'équilibre inférieur est favorisé du côté droit, simplement par l'addition d'un gros substituant déstabilisant.
Effet exo anomérique
Une extension de l'effet anomérique, l'effet exo anomère est la préférence des substituants sortant d'un cycle pour adopter la conformation gauche, tandis que les stériques suggéreraient qu'une conformation antiperiplanaire serait préférée.
Un exemple de ceci est le 2-méthoxytétrahydropyrane. Comme l'effet anomérique le prédit, le substituant méthoxy montre une préférence accrue pour la conformation axiale. Cependant, il existe en fait plus d'une conformation axiale possible en raison de la rotation autour de la liaison CO entre le substituant méthoxy et le cycle. Lorsqu'on applique les principes de l'effet anomérique inverse, on peut prédire que le conformère gauche est préféré, suggérant que la conformation en haut à gauche est la meilleure dans la figure ci-dessus. Cette prédiction est étayée par des preuves expérimentales. De plus, cette préférence pour la position gauche se voit encore dans la conformation équatoriale.
Effet anomérique inverse
Ce terme fait référence à la préférence apparente des substituants azotés chargés positivement pour la conformation équatoriale au-delà de ce que les interactions stériques normales prédiraient dans les anneaux contenant un atome électronégatif, tel que l'oxygène. On ne voit pas que les substituants contenant des carbones avec des charges positives partielles présentent le même effet. Explications théoriques pour l'effet inverse anomère comprennent une explication électrostatique et la délocalisation des sp 3 électrons de la paire isolée carbone anomère et de l' oxygène. Il y a un débat sur la question de savoir s'il s'agit ou non d'un phénomène réel. Les substituants contenant de l'azote avec lesquels il a été rapporté sont assez volumineux, ce qui rend difficile la séparation des effets normaux du volume stérique et de l'effet anomérique inverse, s'il existe. Par exemple, dans la molécule représentée ci-dessous, le substituant pyridinium préfère fortement la position équatoriale, comme le prédisent des facteurs stériques, mais montre en fait une préférence plus forte pour cette conformation que prévu, suggérant que l'effet anomérique inverse contribue.
Effet métallo-anomérique
Les métaux de transition tardifs des groupes 10, 11 et 12 lorsqu'ils sont placés au niveau du carbone anomérique présentent de fortes préférences axiales. Ce phénomène appelé effet métallo-anomérique provient de la stabilisation des interactions hyperconjugatives entre l'oxygène ou d'autres hétéroatomes avec des paires isolées et des orbitales anti-liaison CM qui agissent comme de bons accepteurs. L'effet métallo-anomérique généralisé se réfère à la stabilisation thermodynamique des conformères synclinaux de composés de formule générale M-CH 2 -OR. Les préférences axiales / équatoriales peuvent être influencées par les ligands attachés à la configuration métallique et électronique. D'une manière générale, en passant d'un élément plus léger à un élément plus lourd dans le groupe, l'ampleur de l'effet métallo-anomérique augmente. De plus, des états d'oxydation plus élevés favorisent les conformateurs axiaux / synclinaux.
Applications synthétiques
L'effet anomérique est pris en compte de manière synthétique. En raison de sa découverte dans les sucres, la chimie des sucres et des glucides est l'une des utilisations synthétiques les plus courantes de l'effet anomérique. Par exemple, la glycosidation de Koenigs-Knorr installe un groupe α-OR ou β-OR à haute diastéréosélectivité qui est effectuée par l'effet anomérique. Sophorolipid lactone , (+) - Lepicidin A, et (-) - Lithospermoside sont quelques-uns des produits synthétisés via la glycosidation de Koenigs-Knorr surmontant l'effet anomérique.
Voir également
- Stéréochimie alcane
- Anomer
- Conformation glucidique
- Isomérie conformationnelle
- Conformation cyclohexane
- Effet Gauche
- Forces intramoléculaires
- Monosaccharide
- Raymond Lemieux
- Effets stériques
Références
Liens externes
-
 Médias liés à l' effet anomérique sur Wikimedia Commons
Médias liés à l' effet anomérique sur Wikimedia Commons