Pentachlorure d'antimoine - Antimony pentachloride
|
|
|||

|
|||
| Des noms | |||
|---|---|---|---|
|
Noms IUPAC
Pentachlorure d'
antimoine Chlorure d'antimoine(V) |
|||
| Autres noms
Chlorure d'
antimoine Perchlorure d'antimoine |
|||
| Identifiants | |||
|
Modèle 3D ( JSmol )
|
|||
| ChemSpider | |||
| Carte d'information de l'ECHA |
100.028.729 |
||
| Numéro CE | |||
|
CID PubChem
|
|||
| Numéro RTECS | |||
| UNII | |||
|
Tableau de bord CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriétés | |||
| Cl 5 Sb | |||
| Masse molaire | 299,01 g·mol -1 | ||
| Apparence | liquide incolore ou jaune rougeâtre (fumant), huileux | ||
| Odeur | piquant, offensant | ||
| Densité | 2,336 g / cm 3 (20 ° C) 2,36 g / cm 3 (25 ° C) |
||
| Point de fusion | 2,8 °C (37,0 °F; 275,9 K) | ||
| Point d'ébullition | 140 °C (284 °F; 413 K) se décompose à partir de 106 °C 79 °C (174 °F; 352 K) à 22 mmHg 92 °C (198 °F; 365 K) à 30 mmHg |
||
| réagit | |||
| Solubilité | soluble dans l' alcool , HCl , acide tartrique , CHCl 3 , CS 2 , CCl 4 | ||
| Solubilité dans l' oxychlorure de sélénium(IV) | 62,97 g/100 g (25 °C) | ||
| La pression de vapeur | 0,16 kPa (25 °C) 4 kPa (40 °C) 7,7 kPa (100 °C) |
||
| -120,0·10 −6 cm 3 /mol | |||
|
Indice de réfraction ( n D )
|
1.59255 | ||
| Viscosité | 2,034 cP (29,4 °C) 1,91 cP (35 °C) |
||
| Structure | |||
| Bipyramidale trigonale | |||
| 0 D | |||
| Thermochimie | |||
|
Capacité calorifique ( C )
|
120,9 J/mol·K (gaz) | ||
|
Entropie molaire standard ( S |
295 J/mol·K | ||
|
Std enthalpie de
formation (Δ f H ⦵ 298 ) |
-437,2 kJ/mol | ||
|
Énergie libre de Gibbs (Δ f G ˚)
|
-345,35 kJ/mol | ||
| Dangers | |||
| Pictogrammes SGH |
 
|
||
| Mention d'avertissement SGH | Danger | ||
| H314 , H411 | |||
| P273 , P280 , P305+351+338 , P310 | |||
| Risque d' inhalation | Toxique | ||
| NFPA 704 (diamant de feu) | |||
| point de rupture | 77 °C (171 °F; 350 K) | ||
| Dose ou concentration létale (LD, LC) : | |||
|
DL 50 ( dose médiane )
|
1115 mg/kg, (rat, orale) | ||
| NIOSH (limites d'exposition pour la santé aux États-Unis) : | |||
|
PEL (Autorisé)
|
TWA 0,5 mg/m 3 (en Sb) | ||
|
REL (recommandé)
|
TWA 0,5 mg/m 3 (en Sb) | ||
| Composés apparentés | |||
|
Autres anions
|
Pentafluorure d'antimoine | ||
|
Autres cations
|
Pentachlorure de phosphore | ||
|
Composés apparentés
|
Trichlorure d'antimoine | ||
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa). |
|||
|
|
|||
| Références de l'infobox | |||
Le pentachlorure d'antimoine est un composé chimique de formule SbCl 5 . C'est une huile incolore, mais les échantillons typiques sont jaunâtres à cause des impuretés. En raison de sa tendance à s'hydrolyser en acide chlorhydrique , le SbCl 5 est une substance hautement corrosive et doit être stocké dans des récipients en verre ou en PTFE .
Préparation et structure
Le pentachlorure d'antimoine est préparé en faisant passer du chlore gazeux dans du trichlorure d'antimoine fondu :
- SbCl 3 + Cl 2 → SbCl 5
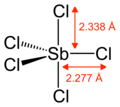
Le SbCl 5 gazeux a une structure bipyramidale trigonale.
Réactions
Le pentachlorure d'antimoine s'hydrolyse pour donner de l'acide chlorhydrique et des oxychlorures d' antimoine . Cette réaction est supprimée en présence d'un grand excès de chlorure, en raison de la formation de l' ion complexe hexachloroantimonate :
- SbCl 5 + Cl − → [SbCl 6 ] −
Les mono- et tétrahydrates sont connus, SbCl 5 ·H 2 O et SbCl 5 ·4H 2 O.
Ce composé forme des adduits avec de nombreuses bases de Lewis. SbCl 5 est un acide de Lewis doux et ses paramètres de modèle ECW sont E A = 3,64 et C A = 10,42. Il est utilisé comme acide de Lewis standard dans l' échelle de Gutmann de la basicité de Lewis .
C'est aussi un puissant agent oxydant . Par exemple les éthers aromatiques sont oxydés en leurs cations radicaux selon la stoechiométrie suivante :
- 3 SbCl 5 + 2 ArH → 2 (ArH+)(SbCl 6 - ) + SbCl 3
Applications
Le pentachlorure d'antimoine est utilisé comme catalyseur de polymérisation et pour la chloration de composés organiques.
Précautions
Le pentachlorure d'antimoine est une substance hautement corrosive qui doit être conservée à l'abri de la chaleur et de l'humidité. C'est un agent de chloration et, en présence d'humidité, il libère du chlorure d'hydrogène gazeux. Pour cette raison, il peut attaquer même les outils en acier inoxydable (tels que les aiguilles) s'ils sont manipulés dans une atmosphère humide. Il ne doit pas être manipulé avec des plastiques non fluorés (tels que des seringues en plastique, des septa en plastique ou des aiguilles avec des raccords en plastique), car il fond et carbonise les matières plastiques.