Réaction de Barton – Kellogg - Barton–Kellogg reaction
| Réaction de Barton – Kellogg | |
|---|---|
| Nommé après |
Sir Derek Barton Richard M. Kellogg |
| Type de réaction | Réaction de couplage |
| Identifiants | |
| ID d'ontologie RSC | RXNO: 0000495 |
La réaction de Barton-Kellogg est une réaction de couplage entre un composé diazo et une thiocétone , donnant un alcène au moyen d'un épisulfure intermédiaire. La réaction de Barton – Kellogg est également connue sous le nom d' oléfination de Barton – Kellogg et de synthèse d'oléfines de Barton .
Cette réaction a été mise au point par Hermann Staudinger et porte également le nom de couplage diazo-thiocétone de type Staudinger .
Mécanisme de réaction
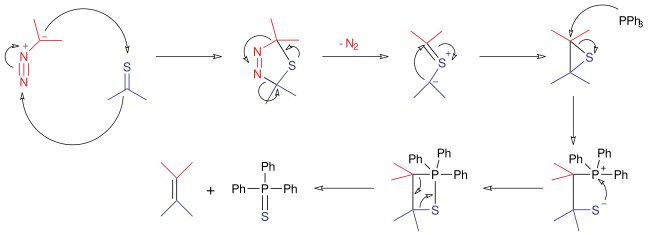
Dans le mécanisme de réaction pour cette réaction, le composé diazo réagit comme un 1,3-dipôle dans une cycloaddition 1,3-dipolaire avec la thiocétone pour donner un cycle thiadiazoline à 5 chaînons . Cet intermédiaire est instable; il extrude une molécule d'azote pour former un ylure de thiocarbonyle , qui se cyclise ensuite pour former un épisulfure stable . La triphénylphosphine réagit comme un nucléophile , ouvrant le cycle à trois membres pour former un sulfaphosphatane. D'une manière similaire à la réaction de Wittig , cette structure expulse alors le sulfure de triphénylphosphine pour produire un alcène.
Portée
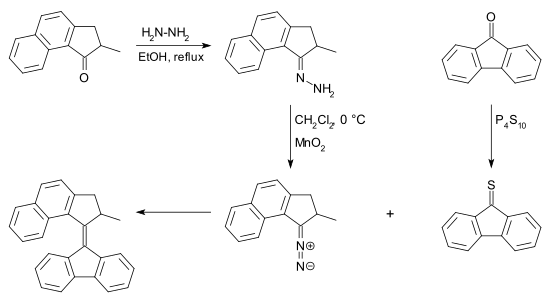
Le composé diazo peut être obtenu à partir d'une cétone par réaction avec l' hydrazine en une hydrazone suivie d'une oxydation . De nombreux réactifs existent pour cette conversion par exemple l' oxyde d'argent (I) et le (bis (trifluoroacétoxy) iodo) benzène . La thiocétone nécessaire à cette réaction peut être obtenue à partir d'une cétone et du pentasulfure de phosphore . La désulfuration de l'épisulfure peut être réalisée par de nombreuses phosphines et également par de la poudre de cuivre .
Le principal avantage de cette réaction par rapport à la réaction de McMurry est la notion que la réaction peut avoir lieu avec deux cétones différentes. A cet égard, le couplage diazo-thiocétone est un couplage croisé plutôt qu'un homocouplage.
Les références
- ^ DHR Barton et BJ Willis (1970). "Synthèse d'oléfine par deux processus d'extrusion". J. Chem. Soc. D (19): 1225. doi : 10,1039 / C29700001225 .
- ^ RM Kellogg et S. Wassenaar (1970). "Ylures de thiocarbonyle. Une approche des" composés de soufre tétravalent ". Tetrahedron Lett. 11 (23): 1987. doi : 10,1016 / S0040-4039 (01) 98134-1 .
- ^ RM Kellogg (1976). "Les molécules R2CXCR2 comprenant les ylures d'azométhine, de carbonyle et de thiocarbonyle. Leurs synthèses, propriétés et réactions". Tétraèdre . 32 (18): 2165-2184. doi : 10.1016 / 0040-4020 (76) 85131-9 .
- ^ "L'oléfination de Barton-Kellogg". Réactions et réactifs de nom organique complet . 2010. pp. 249–253. doi : 10.1002 / 9780470638859.conrr056 . ISBN 9780470638859.
- ^ "Synthèse d'oléfine de Barton" . Merck Index (15e éd.).
- ^ H. Staudinger et J. Siegwart (1920). "Einwirkungen von aliphatischen Diazoverbindungen auf Thioketone" . Helv. Chim. Acta . 3 : 833–840. doi : 10.1002 / hlca.19200030178 .
- ^ Matthijs KJ ter Wiel; Javier Vicario; Stephen G. Davey; Auke Meetsma et Ben L. Feringa (2005). "Nouvelle procédure pour la préparation d'alcènes fortement encombrés stériquement en utilisant un réactif d'iode hypervalent" (PDF) . Chimie organique et biomoléculaire . 3 (1): 28–30. doi : 10.1039 / b414959a . PMID 15602594 .