Réaction Belousov-Zhabotinsky - Belousov–Zhabotinsky reaction
Une réaction de Belousov-Zhabotinsky , ou réaction BZ , fait partie d'une classe de réactions qui servent d'exemple classique de thermodynamique hors équilibre , entraînant l'établissement d'un oscillateur chimique non linéaire . Le seul élément commun à ces oscillateurs est l'inclusion de brome et d'un acide. Les réactions sont importantes pour la chimie théorique en ce qu'elles montrent que les réactions chimiques ne doivent pas être dominées par le comportement thermodynamique d'équilibre . Ces réactions sont loin de l'équilibre et le restent pendant une durée significative et évoluent de manière chaotique . En ce sens, ils fournissent un modèle chimique intéressant des phénomènes biologiques hors d'équilibre ; en tant que tels, les modèles mathématiques et les simulations des réactions BZ elles-mêmes présentent un intérêt théorique, montrant le phénomène comme un ordre induit par le bruit .
Un aspect essentiel de la réaction BZ est sa soi-disant « excitabilité » ; sous l'influence de stimuli, des motifs se développent dans ce qui serait autrement un milieu parfaitement tranquille. Certaines réactions d'horloge telles que Briggs-Rauscher et BZ utilisant le chlorure de tris(bipyridine)ruthénium(II) comme catalyseur peuvent être excitées en une activité d' auto-organisation par l'influence de la lumière.
Histoire
La découverte du phénomène est attribuée à Boris Belousov . En 1951, alors qu'il tentait de trouver l'analogue non organique du cycle de Krebs , il nota que dans un mélange de bromate de potassium , de sulfate de cérium (IV) , d'acide malonique et d'acide citrique dans de l'acide sulfurique dilué , le rapport de concentration du les ions cérium(IV) et cérium(III) ont oscillé, faisant osciller la couleur de la solution entre une solution jaune et une solution incolore. Cela est dû au fait que les ions cérium(IV) sont réduits par l'acide malonique en ions cérium(III), qui sont ensuite réoxydés en ions cérium(IV) par les ions bromate(V).
Belousov a fait deux tentatives pour publier ses conclusions, mais a été rejetée au motif qu'il ne pouvait pas expliquer ses résultats à la satisfaction des rédacteurs des revues auxquelles il a soumis ses résultats. Le biochimiste soviétique Simon El'evich Shnoll a encouragé Belousov à poursuivre ses efforts pour publier ses résultats. En 1959, son travail a finalement été publié dans un journal moins respectable et non révisé.
Après la publication de Belousov, Shnoll a confié le projet en 1961 à un étudiant diplômé, Anatol Zhabotinsky , qui a étudié en détail la séquence de réaction ; cependant, les résultats du travail de ces hommes n'étaient toujours pas largement diffusés et n'étaient connus en Occident qu'à une conférence à Prague en 1968.
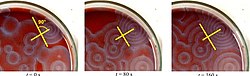
Un certain nombre de cocktails BZ sont disponibles dans la littérature chimique et sur le Web. La ferroïne , un complexe de phénanthroline et de fer , est un indicateur courant . Ces réactions, si elles sont réalisées dans des boîtes de Pétri , conduisent à la formation d'abord de taches colorées. Ces taches se transforment en une série d'anneaux concentriques en expansion ou peut-être en spirales en expansion similaires aux motifs générés par un automate cellulaire cyclique . Les couleurs disparaissent si la vaisselle est secouée, puis réapparaissent. Les vagues continuent jusqu'à ce que les réactifs soient consommés. La réaction peut également être effectuée dans un bécher à l' aide d'un agitateur magnétique .
Andrew Adamatzky , un informaticien de l' Université de l'Ouest de l'Angleterre , a fait un rapport sur les portes logiques liquides utilisant la réaction BZ. La réaction BZ a également été utilisée par Juan Pérez-Mercader et son groupe de l'université Harvard pour créer une machine de Turing entièrement chimique, capable de reconnaître un langage de type 1 de Chomsky .
Des motifs en spirale oscillatoire étonnamment similaires apparaissent ailleurs dans la nature, à des échelles spatiales et temporelles très différentes, par exemple le mode de croissance de Dictyostelium discoideum , une colonie d' amibes vivant dans le sol . Dans la réaction BZ, la taille des éléments en interaction est moléculaire et l'échelle de temps de la réaction est de quelques minutes. Dans le cas de l'amibe du sol, la taille des éléments est typique des organismes unicellulaires et les temps impliqués sont de l'ordre de quelques jours à plusieurs années.
Les chercheurs explorent également la création d'un "ordinateur humide", utilisant des "cellules" autocréées et d'autres techniques pour imiter certaines propriétés des neurones .
Mécanisme chimique
Le mécanisme de cette réaction est très complexe et impliquerait environ 18 étapes différentes qui ont fait l'objet de plusieurs articles de recherche.
D'une manière similaire à la réaction de Briggs-Rauscher , deux processus clés (tous deux auto-catalytiques ) se produisent ; le processus A génère du brome moléculaire, donnant la couleur rouge, et le processus B consomme le brome pour donner des ions bromure. Théoriquement, la réaction ressemble au modèle de Turing idéal , un système qui émerge qualitativement de la résolution des équations de diffusion de la réaction pour une réaction qui génère à la fois un inhibiteur de réaction et un promoteur de réaction, dont les deux diffusent à travers le milieu à des vitesses différentes.
L'une des variantes les plus courantes de cette réaction utilise l'acide malonique (CH 2 (CO 2 H) 2 ) comme acide et le bromate de potassium (KBrO 3 ) comme source de brome. L'équation globale est :
- 3 CH 2 (CO 2 H) 2 + 4 BrO−
3→ 4 Br − + 9 CO 2 + 6 H 2 O
Variantes
De nombreuses variantes de la réaction existent. Le seul produit chimique clé est l'oxydant bromate. L'ion catalyseur est le plus souvent le cérium, mais il peut aussi s'agir de manganèse, ou de complexes de fer, ruthénium, cobalt, cuivre, chrome, argent, nickel et osmium. De nombreux réducteurs différents peuvent être utilisés. (Zhabotinsky, 1964b; Field et Burger, 1985)
De nombreux modèles différents peuvent être observés lorsque la réaction est exécutée dans une microémulsion .
Voir également
- Ondulation automatique
- Réverbérateur à ondes automatiques
- Réaction de Briggs-Rauscher
- Dissipation
- Milieu excitable
- Ordre induit par le bruit
- Motifs dans la nature
- Réaction-diffusion
- Auto-oscillation
- Auto-organisation
- Alan Turing qui a prédit mathématiquement les réactions chimiques oscillantes au début des années 1950
- Bruxelles
- Oregonator
Les références
Lectures complémentaires
- Strogatz, S. (2003). SYNC, la science émergente de l'ordre spontané . Hypérion. p. 212-216, 219. ISBN 0-7868-6844-9.
- Pabian, RK; Zarins, A. Agates à bandes, origines et inclusions . Circulaire pédagogique. 12 . Université du Nebraska-Lincoln.
- Ichino, T.; Asahi, T.; Kitahata, H.; Magome, N.; Agladze, K. ; Yoshikawa, K. (2008). "Le microfret délivré par les ondes chimiques". Journal de chimie physique C . 112 (8) : 3032–5. doi : 10.1021/jp7097922 .
Liens externes
- Expérience scientifique interactive présentant la réaction BZ (niveau A)
- Un article d'enquête sur les mathématiques de la réaction BZ
- L'article de Scholarpedia sur la réaction Belousov-Zhabotinsky
- La réaction de Belousov-Zhabotinski
- La réaction de Belousov-Zhabotinsky
- La phénoménologie de la réaction Belousov-Zhabotinsky, avec des images
- Réaction BZ et explication au tableau périodique des vidéos
- La réaction de Belousov-Zhabotinski (fichier PDF)
- "Paper cargo surfs Chemical waves" — Des ondes chimiques oscillantes induites par des réactions BZ peuvent propulser de petits objets, New Scientist , 18 février 2008
- La page d'accueil d'Anatol M. Zhabotinsky
- Simulation des réactions de Belousov-Zhabotinsky dans Pixel Bender Une simulation de la réaction de Belousov-Zhabotinsky exécutée dans Flash Player