Explosion - Blastulation
| Blastula | |
|---|---|
 Blastulation : 1 - morula, 2 - blastula.
| |
| Des détails | |
| Journées | 4 |
| Précurseur | Morula |
| Donne lieu à | Gastrula |
| Identifiants | |
| Engrener | D036703 |
| Terminologie anatomique | |
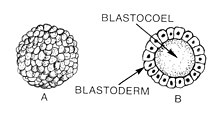
La blastulation est le stade du développement embryonnaire animal précoce qui produit la blastula . La blastula (du grec βλαστός ( blastos signifiant germe ) est une sphère creuse de cellules ( blastomères ) entourant une cavité interne remplie de liquide (le blastocèle ). Le développement embryonnaire commence par un spermatozoïde fécondant un ovule pour devenir un zygote , qui subit de nombreuses clivages pour se développer en une boule de cellules appelée morula . Ce n'est que lorsque le blastocèle est formé que l'embryon précoce devient une blastula. La blastula précède la formation de la gastrula dans laquelle se forment les couches germinales de l'embryon.
Une caractéristique commune d'une blastula de vertébré est qu'elle se compose d'une couche de blastomères, connue sous le nom de blastoderme , qui entoure le blastocèle. Chez les mammifères , la blastula est appelée blastocyste . Le blastocyste contient un embryoblaste (ou masse cellulaire interne) qui finira par donner naissance aux structures définitives du fœtus , et un trophoblaste qui formera les tissus extra-embryonnaires.
Au cours de la blastulation, une quantité importante d'activité se produit au sein de l'embryon précoce pour établir la polarité cellulaire , la spécification cellulaire , la formation de l'axe et pour réguler l'expression des gènes . Chez de nombreux animaux, tels que la drosophile et le xénope , la transition mi-blastula (MBT) est une étape cruciale du développement au cours de laquelle l' ARNm maternel est dégradé et le contrôle du développement est transmis à l'embryon. De nombreuses interactions entre les blastomères dépendent de l' expression de la cadhérine , en particulier la E-cadhérine chez les mammifères et la EP-cadhérine chez les amphibiens .
L'étude de la blastula et de la spécification cellulaire a de nombreuses implications dans la recherche sur les cellules souches et la technologie de reproduction assistée . Chez Xenopus , les blastomères se comportent comme des cellules souches pluripotentes qui peuvent migrer par plusieurs voies, en fonction de la signalisation cellulaire . En manipulant les signaux cellulaires au cours du stade de développement de la blastula, divers tissus peuvent être formés. Ce potentiel peut être déterminant dans la médecine régénérative pour les cas de maladies et de blessures. La fécondation in vitro implique l'implantation d'une blastula dans l'utérus de la mère. L'implantation de cellules de blastula pourrait servir à éliminer l' infertilité .
Développement
Le stade blastula du développement précoce de l'embryon commence avec l'apparition du blastocèle. Il a été démontré que l' origine du blastocèle chez Xenopus provenait du premier sillon de clivage , qui est élargi et scellé avec des jonctions serrées pour créer une cavité.
Dans de nombreux organismes, le développement de l'embryon jusqu'à ce stade et pour la première partie du stade blastula est contrôlé par l'ARNm maternel, ainsi appelé parce qu'il a été produit dans l'ovule avant la fécondation et provient donc exclusivement de la mère.
Transition midblastula
Dans de nombreux organismes, y compris Xenopus et Drosophila , la transition de la blastula moyenne se produit généralement après un nombre particulier de divisions cellulaires pour une espèce donnée, et est définie par la fin des cycles de division cellulaire synchrones du développement précoce de la blastula et l'allongement des cycles cellulaires. par l'addition des phases G1 et G2 . Avant cette transition, le clivage se produit uniquement avec les phases de synthèse et de mitose du cycle cellulaire. L'ajout des deux phases de croissance dans le cycle cellulaire permet aux cellules d'augmenter en taille, car jusqu'à ce point les blastomères subissent des divisions réductrices dans lesquelles la taille globale de l'embryon n'augmente pas, mais plus de cellules sont créées. Cette transition commence la croissance de la taille de l'organisme.
La transition mi-blastula est également caractérisée par une augmentation marquée de la transcription de nouveaux ARNm non maternels transcrits à partir du génome de l'organisme. De grandes quantités d'ARNm maternel sont détruites à ce stade, soit par des protéines telles que SMAUG chez la drosophile, soit par des microARN . Ces deux processus déplacent le contrôle de l'embryon de l'ARNm maternel vers les noyaux.
Structure
Une blastula est une sphère de cellules entourant un blastocèle. Le blastocèle est une cavité remplie de liquide qui contient des acides aminés , des protéines , des facteurs de croissance , des sucres, des ions et d'autres composants nécessaires à la différenciation cellulaire . Le blastocèle permet également aux blastomères de se déplacer pendant le processus de gastrulation .
Dans les embryons de Xenopus , la blastula est composée de trois régions différentes. La coiffe animale forme le toit du blastocèle et continue principalement à former des dérivés ectodermiques . La zone équatoriale ou marginale, qui compose les parois du blastocèle, se différencie principalement en tissu mésodermique . La masse végétale est composée du plancher blastocèle et se développe principalement en tissu endodermique .
Dans le blastocyste de mammifère (terme pour blastula de mammifère), il existe trois lignées qui donnent lieu à un développement tissulaire ultérieur. L' épiblaste donne naissance au fœtus lui-même tandis que le trophoblaste se développe en une partie du placenta et l'endoderme primitif devient le sac vitellin .
Dans l'embryon de souris, la formation du blastocèle commence au stade de 32 cellules. Au cours de ce processus, l'eau pénètre dans l'embryon, aidé par un gradient osmotique qui est le résultat des ATPases Na + /K + qui produisent un gradient Na + élevé sur la face basolatérale du trophectoderme. Ce mouvement de l'eau est facilité par les aquaporines . Un joint est créé par des jonctions serrées des cellules épithéliales qui tapissent le blastocèle.
Adhésion cellulaire
Les jonctions serrées sont très importantes dans le développement de l'embryon. Dans la blastula, ces interactions cellulaires médiées par la cadhérine sont essentielles au développement de l'épithélium, qui sont les plus importantes pour le transport paracellulaire , le maintien de la polarité cellulaire et la création d'un joint de perméabilité pour réguler la formation du blastocèle. Ces jonctions serrées surviennent après que la polarité des cellules épithéliales est établie, ce qui jette les bases d'un développement et d'une spécification ultérieurs. Au sein de la blastula, les blastomères internes sont généralement non polaires tandis que les cellules épithéliales présentent une polarité.
Les embryons de mammifères subissent une compaction autour du stade de 8 cellules où les E-cadhérines ainsi que les alpha et bêta caténines sont exprimées. Ce processus fait une boule de cellules embryonnaires capables d'interagir, plutôt qu'un groupe de cellules diffuses et indifférenciées. L'adhésion de l'E-cadhérine définit l' axe apico-basal dans l'embryon en développement et transforme l'embryon d'une boule indistincte en un phénotype plus polarisé qui ouvre la voie à un développement ultérieur en un blastocyste entièrement formé.
La polarité membranaire du Xénope est établie avec le premier clivage cellulaire. L'EP-cadhérine amphibie et la cadhérine XB/U jouent un rôle similaire à celui de l'E-cadhérine chez les mammifères en établissant la polarité des blastomères et en solidifiant les interactions cellule-cellule qui sont cruciales pour le développement ultérieur.
Implications cliniques
Technologies de fertilisation
Des expériences d'implantation chez la souris montrent que l' induction hormonale , la superovulation et l' insémination artificielle produisent avec succès des embryons de souris préimplantatoires. Chez les souris, quatre-vingt-dix pour cent des femelles ont été induites par stimulation mécanique à subir une grossesse et à implanter au moins un embryon. Ces résultats s'avèrent encourageants car ils fournissent une base pour une implantation potentielle dans d'autres espèces de mammifères, comme l'homme.
Cellules souches
Les cellules au stade blastula peuvent se comporter comme des cellules souches pluripotentes chez de nombreuses espèces. Les cellules souches pluripotentes sont le point de départ pour produire des cellules spécifiques d'organes qui peuvent potentiellement aider à la réparation et à la prévention des blessures et de la dégénérescence. La combinaison de l'expression de facteurs de transcription et du positionnement localisé des cellules de la blastula peut conduire au développement d'organes et de tissus fonctionnels induits. Les cellules pluripotentes de Xenopus , lorsqu'elles sont utilisées dans une stratégie in vivo, ont pu se former en rétines fonctionnelles . En les transplantant dans le champ oculaire de la plaque neurale et en induisant plusieurs erreurs d'expression de facteurs de transcription, les cellules se sont engagées dans la lignée rétinienne et pourraient guider le comportement basé sur la vision chez le Xénope .
Voir également
- Blastocyste
- Différenciation cellulaire
- Gastrulation
- Polarité dans l'embryogenèse
- Diploblastie
- Triploblastie
Les références
Bibliographie
- Forgács, G. & Newman, Stuart A. (2005). « Clivage et formation de blastula ». Physique biologique de l'embryon en développement . La presse de l'Universite de Cambridge. ISBN 978-0-521-78337-8.
- Cullen, KE (2009). « Embryologie et développement animal précoce ». Encyclopédie des sciences de la vie, tome 2 . Infobase. ISBN 978-0-8160-7008-4.
- McGeady, Thomas A., éd. (2006). "Gastrulation". Embryologie vétérinaire . Wiley-Blackwell. ISBN 978-1-4051-1147-8.