Borrelia burgdorferi -Borrelia burgdorferi
| Borrelia burgdorferi | |
|---|---|
|
|
| Borrelia burgdorferi | |
|
Classement scientifique |
|
| Domaine: | Bactéries |
| Phylum: | Spirochètes |
| Commander: | Spirochaetales |
| Famille: | Spirochaetaceae |
| Genre: | Borrelia |
| Espèce: |
B. burgdorferi
|
| Nom binomial | |
|
Borrelia burgdorferi Johnson et al. 1984 corrigé. Baranton et al. 1992
|
|
Borrelia burgdorferi sensu stricto est une espèce bactérienne de laclasse des spirochètes du genre Borrelia , et est l'un des agents responsables de la maladie de Lyme chez l' homme. Avec quelques génoespèces similaires, dont certaines provoquent également la maladie de Lyme, elle constitue le complexe d'espèces de Borrelia burgdorferi sensu lato . Le complexe comprend actuellement 20 génoespèces acceptées et 3 proposées. B. burgdorferi sensu stricto existe en Amérique du Nord et en Eurasie et était jusqu'en 2016 la seule cause connue de la maladie de Lyme en Amérique du Nord. Les espèces de Borrelia sont gram-négatives .
Microbiologie
Borrelia burgdorferi doit son nom au chercheur Willy Burgdorfer , qui a isolé la bactérie pour la première fois en 1982.
Morphologie
B. burgdorferi ressemble à d'autres spirochètes en ce qu'il possède une membrane externe et une membrane interne avec une fine couche de peptidoglycane entre les deux. Cependant, la membrane externe manque de lipopolysaccharide . Sa forme est une vague plate. Il mesure environ 0,3 m de large et 5 à 20 m de long.
B. burgdorferi est un spirochète microaérobie et mobile avec sept à 11 flagelles périsplasmiques groupés à chaque extrémité qui permettent à la bactérie de se déplacer dans les milieux de faible et de haute viscosité, ce qui est lié à son facteur de virulence élevé.
Métabolisme
B. burgdorferi est un spirochète microaérophile à croissance lente avec un temps de doublement de 24 à 48 heures.
Cycle de la vie
B. burgdorferi circule entre les tiques Ixodes et un hôte vertébré dans un cycle enzootique . B. burgdorferi vivant dans une tique est principalement acquis par les repas de sang d'un hôte vertébré infecté et compétent, mais il existe de rares cas de transmission transovarienne. Une fois qu'une tique est infectée, elle transmettra B. burgdorferi en se nourrissant d'un autre vertébré pour terminer le cycle. Les tiques peuvent transmettre B. burgdorferi aux humains, mais les humains sont des hôtes sans issue, peu susceptibles de poursuivre le cycle de vie du spirochète. Les nymphes se muent en tiques adultes, qui se nourrissent généralement de mammifères plus gros qui ne sont pas en mesure de soutenir la survie de B. burgdorferi .
Maladie
La maladie de Lyme est une zoonose , maladie transmise par un vecteur transmis par le Ixodes tique (également le vecteur de Babesia et Anaplasma ). La tique nymphale infectée transmet B. burgdorferi via sa salive à l'homme lors de son repas sanguin.
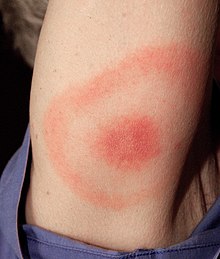
Le tableau clinique de la maladie de Lyme est surtout connu pour l'érythème œil-de-bœuf caractéristique (également connu sous le nom d' érythème chronique migrant ) mais peut également inclure une myocardite , une cardiomyopathie , une arythmie , une arthrite , une arthralgie , une méningite , des neuropathies et une paralysie du nerf facial selon le stade de infection.
Des infections à B. burgdorferi ont été trouvées en association possible avec des lymphomes cutanés primaires à cellules B (PCBCL), où une revue de la littérature primaire a, à partir de 2010, noté que la plupart des PCBCL examinés ont été « insensibles » aux antibiotiques ; Par conséquent, comme dans le cas de l' association de Chlamydophila psittaci avec le lymphome du tissu lymphoïde associé à la muqueuse oculaire (MALT), la conclusion de travail était que « si B. burgdorferi est vraiment associé au PCBCL, alors il existe une grande variabilité géographique et d'autres facteurs sont probablement impliqué".
La progression de la maladie suit 3 étapes.
Étape 1
Le stade 1 est connu sous le nom de stade précoce localisé et survient environ 3 jours à 1 mois après l'inoculation. Elle affecte la zone locale autour de la morsure et se caractérise par un gonflement local et/ou une éruption cutanée rouge en « œil de bœuf » (également connue sous le nom d' érythème chronique migrant ) considérée comme un cercle érythémateux encerclant un centre défini qui s'étend vers l'extérieur. Il peut atteindre jusqu'à 15 cm de diamètre. Une fois que l'éruption commence à s'atténuer, les premiers symptômes peuvent se manifester par des symptômes « pseudo-grippaux ». À ce stade, les antibiotiques sont les plus efficaces pour prévenir la croissance et les symptômes de la maladie avant que les principaux symptômes ne se manifestent.
Étape 2
Le stade 2 est connu sous le nom de stade de dissémination précoce et survient des semaines à des mois après l'infection s'il n'est pas traité. La bactérie se propage par le sang à travers le corps pour affecter les organes. Il présente souvent des symptômes généraux tels que fièvre, frissons, fatigue et lymphadénopathie, ainsi que des symptômes spécifiques à un organe. Il peut affecter le cœur et provoquer une myocardite et des arythmies telles que des blocs auriculo-ventriculaires (qui, s'ils sont suffisamment importants, peuvent nécessiter l'insertion d'un stimulateur cardiaque). Elle peut affecter le système musculo-squelettique provoquant une arthrite transitoire non inflammatoire et/ou des arthralgies . Elle peut affecter le système nerveux se manifestant par une paralysie faciale (paralysie de Bell , classiquement bilatérale), de la fatigue et une perte de mémoire.
Étape 3
Le stade 3 est connu sous le nom de stade de diffusion tardive et survient des mois à des années après l'infection initiale. Effets de la 3 ème étape comprennent l' encéphalite ou la méningite, ainsi que des arthropathies migratoires ( le plus souvent du genou).
L'anaplasmose et la babésiose sont également des agents pathogènes courants transmis par les tiques, portés par la tique Ixodes, qui infectent les humains de la même manière que Borrelia burgdorferi . Par conséquent, il est possible qu'une tique Ixodes co-infecte un hôte avec deux ou toutes les autres maladies. Lorsqu'un hôte est co-infecté, les effets combinés des maladies agissent en synergie, s'avérant souvent provoquer des symptômes plus graves qu'une seule infection seule Les humains co-infectés ont tendance à présenter une manifestation plus grave de la maladie de Lyme. De plus, ils ont tendance à acquérir un éventail plus large de symptômes secondaires, tels que des symptômes pseudo-grippaux. Davantage d'études et de recherches doivent être menées pour déterminer l'effet synergique de la co-infection et son effet sur le corps humain.
Variation de gravité
Jusqu'à présent, trois facteurs peuvent contribuer à la gravité de la manifestation clinique de la maladie de Lyme. La présence d'espaceurs ribosomiques, de plasmides et de la protéine de surface externe C (OspC) sont des indicateurs de la gravité de l'infection. De plus, les humains eux-mêmes varient dans leur réponse à l'infection. La variation de la réponse conduit à différentes manifestations cliniques et différentes infections à différents organes.
Informations complémentaires sur la maladie de Lyme et sa cause
L'antibiothérapie résout les symptômes cliniques, dans la plupart des cas, au cours des premiers stades de l'infection. Des symptômes persistants ou récurrents peuvent se développer plus tard dans un sous-ensemble de patients. Les mécanismes sous-jacents, la pathogenèse et le traitement du PTLDS restent inconnus. Par conséquent, il est d'une grande importance de développer un vaccin qui empêchera l'incidence d'infections graves transmises par les tiques telles que la borréliose de Lyme. La plupart des efforts de recherche se concentrent sur l'identification des antigènes de B. burgdorferi ou des protéines de tiques nécessaires à la survie des spirochètes dans les tiques, dans le but d'interférer avec la transmission des agents pathogènes des tiques ou l'infectiosité chez les hôtes, empêchant ainsi la maladie de Lyme.
Pathogénie moléculaire
Une fois l'agent pathogène transmis, il s'acclimatera aux conditions des mammifères. Borrelia burgdorferi va modifier ses glycoprotéines et protéases sur sa membrane plasmique pour faciliter sa dissémination dans le sang. Pendant l'infection, B. burgdorferi exprimera des protéines qui interagiront avec les cellules endothéliales , les plaquettes , les chondrocytes et la matrice extracellulaire . Cette interaction inhibe le bon fonctionnement des zones infectées, conduisant aux manifestations pathologiques de la maladie de Lyme. En réponse, l'hôte initiera une réponse inflammatoire pour tenter d'éliminer l'infection.
Borrelia burgdorferi exprime également au moins sept protéines de liaison au plasminogène pour l'interférence du facteur H au niveau de l'activation. Cela fait partie d'une stratégie d'évasion du système du complément qui conduit à un blocage en aval de la réponse immunitaire.
De plus, Borrelia burgdorferi a une stratégie pour inhiber directement la voie classique du système du complément. Une lipoprotéine borréliale BBK32, exprimée à la surface de Borrelia burgdorferi , se lie au complexe de protéase initiateur C1 de la voie classique. Plus précisément, BBK32 interagit avec la sous-unité C1r de C1. Le domaine C-terminal de la protéine BBK32 médie la liaison. En conséquence, C1 est piégé sous une forme inactive.
La génétique
B. burgdorferi (souche B31) était le troisième génome microbien jamais séquencé , après le séquençage de Haemophilus influenzae et de Mycoplasma genitalium en 1995. Son chromosome linéaire contient 910 725 paires de bases et 853 gènes . La méthode de séquençage utilisée était le shotgun du génome entier . Le projet de séquençage, publié dans Nature en 1997 et Molecular Microbiology en 2000, a été mené à l'Institute for Genomic Research . Dans l'ensemble, le génome de B. burgdorferi se compose étrangement d'un chromosome mégabase et d'une variété de plasmides circulaires et linéaires dont la taille varie de 9 à 62 kilobases. Le chromosome de la mégabase, contrairement à de nombreuses autres eubactéries, n'a aucun rapport avec la virulence de la bactérie ou avec l'interaction hôte-parasite. Certains des plasmides sont nécessaires au cycle de vie de B. burgdorferi mais pas à la propagation des bactéries en culture.
Les variations génomiques de B. burgdorferi contribuent à divers degrés d'infection et de dissémination. Chaque groupe génomique a des antigènes variables sur son récepteur membranaire, qui sont spécifiques à l'infection de l'hôte. L'un de ces récepteurs membranaires est la protéine de surface OspC. La protéine de surface OspC s'avère être un indicateur fort de l'identification de la classification génomique et du degré de dissémination. Un nombre variable de loci OspC sont des indications et des déterminants des variations de B. burgdorferi . La protéine de surface est également à l'avant-garde de la recherche actuelle de vaccins contre la maladie de Lyme via Borrelia .
Évolution
Des souches génétiquement diverses de B. burgdorferi , telles que définies par la séquence de ospC , sont maintenues dans le nord-est des États-Unis. La sélection d'équilibrage peut agir sur ospC ou une séquence voisine pour maintenir la variété génétique de B. burgdorferi . L'équilibrage de la sélection est le processus par lequel plusieurs versions d'un gène sont conservées dans le pool génétique à des fréquences étonnamment élevées. Deux modèles majeurs qui contrôlent l'équilibre de sélection de B.burgdorferi sont la sélection négative dépendante de la fréquence et le polymorphisme à niches multiples . Ces modèles peuvent expliquer comment B. burgdorferi s'est diversifié et comment la sélection peut avoir affecté la distribution des variantes de B. burgdorferi , ou la variation de traits spécifiques de l'espèce, dans certains environnements.
Sélection dépendante de la fréquence négative
Dans la sélection négative dépendante de la fréquence, les variantes rares et peu courantes auront un avantage sélectif sur les variantes très courantes dans un environnement. Pour B. burgdorferi , les variants à basse fréquence seront avantageux car les hôtes potentiels seront moins susceptibles de monter une réponse immunologique à la protéine externe OspC spécifique au variant.
Polymorphisme à niches multiples
Les niches écologiques sont toutes les variables d'un environnement, telles que les ressources, les concurrents et les réponses, qui contribuent à la forme physique de l'organisme. Le polymorphisme à niches multiples indique que la diversité est maintenue au sein d'une population en raison du nombre variable de niches et d'environnements possibles. Par conséquent, plus les niches sont diverses, plus il y a de probabilité de polymorphisme et de diversité. Pour B. burgdorferi , différentes niches de vertèbres, telles que les cerfs et les souris, peuvent affecter la sélection globale d'équilibrage pour les variantes.
Voir également
Les références
Lectures complémentaires
- Velázquez, Encarna; Peix, lvaro; Gómez-Alonso, Alberto (mars 2011). "Microorganismos y cáncer: evidencias científicas y nuevas hipótesis" [Microorganismes et cancer : preuves scientifiques et nouvelles hypothèses]. Cirugía Española (en espagnol). 89 (3) : 136-144. doi : 10.1016/j.ciresp.2010.08.006 . PMID 21292247 .
- Koči, Juraj ; Bista, Sandhya; Chirania, Payal ; Yang, Xiuli ; Kitsou, Chrysoula ; Rana, Vipin Singh ; Yas, Ozlem Buyuktanir ; Sonenshine, Daniel E.; Pal, Utpal (17 mars 2021). "Les anticorps contre les domaines de type EGF dans les orthologues Ixodes scapularis BM86 ont un impact sur l'alimentation des tiques et la survie de Borrelia burgdorferi" . Rapports scientifiques . 11 (1): 6095. bibcode : 2021NatSR..11.6095K . doi : 10.1038/s41598-021-85624-5 . PMC 7971074 . PMID 33731754 .
Liens externes
| Scholia a un profil thématique pour Borrelia burgdorferi . |
- Interview vidéo d' Eva Sapi , PhD sur Borrelia Biofilms
- Navigateur de taxonomie NCBI Borrelia
- Page du génome de Borrelia burgdoferi B31