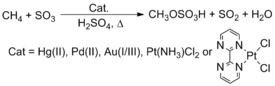Activation de la liaison carbone-hydrogène - Carbon–hydrogen bond activation
La fonctionnalisation de la liaison carbone-hydrogène ( fonctionnalisation C – H ) est un type de réaction dans lequel une liaison carbone-hydrogène est clivée et remplacée par une liaison carbone-X (où X est généralement le carbone, l'oxygène ou l'azote). Le terme implique généralement qu'un métal de transition est impliqué dans le processus de clivage CH. Les réactions classées par le terme impliquent généralement que l' hydrocarbure réagisse d'abord avec un catalyseur métallique pour créer un complexe organométallique dans lequel l'hydrocarbure est coordonné à la sphère interne d'un métal, soit via un « complexe alcane ou arène » intermédiaire ou en tant que transition état conduisant à un intermédiaire "M − C". L'intermédiaire de cette première étape (appelée activation C – H et parfois utilisée de manière interchangeable avec la fonctionnalisation CH) peut alors subir des réactions ultérieures pour produire le produit fonctionnalisé. Il est important pour cette définition que pendant l'événement de clivage C – H, l'espèce hydrocarbyle reste associée dans la sphère interne et sous l'influence de "M".
Comme définition alternative, d'autres auteurs utilisent le terme de fonctionnalisation C – H pour désigner toute transformation organique dans laquelle le résultat net est la transformation d'une liaison C – H relativement inerte en une liaison C – X (c'est-à-dire, un groupe fonctionnel ), indépendamment du mécanisme (ou avec une attitude agnostique à son égard). En particulier, cette définition ne nécessite pas de coordination entre le métal de transition et l'hydrocarbure dans le mécanisme de réaction. Cette définition plus large inclut la définition plus étroite donnée ci-dessus en tant que sous-ensemble. Cependant, cette définition inclurait également la réaction de fonctionnalisation d'alcane catalysée par le fer qui passe par le mécanisme de rebond de l' oxygène (par exemple les enzymes du cytochrome P450 et leurs analogues synthétiques), dans laquelle une liaison métal-carbone n'est pas supposée être impliquée. De même, la réactivité à base de ligand de nombreuses espèces de carbène métalliques avec des hydrocarbures tomberait également dans cette catégorie, bien que certains cas soient mécanistiquement ambigus. Certains auteurs définissent de la même manière l' activation C – H au sens large comme l'étape de clivage C – H de tout mécanisme qui aboutit à la fonctionnalisation d'un groupe hydrocarboné (ou toute conséquence observable du clivage de la liaison C – H, comme l'échange H / D). D'autres encore maintiennent la définition étroite d'origine du terme activation C – H, tout en utilisant la fonctionnalisation C – H dans son sens plus large.
Classification
Les mécanismes d'activation CH peuvent être classés en trois catégories générales:
- (i) une addition oxydante , dans laquelle un centre métallique de faible valeur s'insère dans une liaison carbone-hydrogène, qui clive la liaison et oxyde le métal.
- L n M + RH → L n MR (H)
- (ii) Activation électrophile dans laquelle un métal électrophile attaque l'hydrocarbure en déplaçant un proton:
- L n M + + RH → L n MR + H +
le substrat subit un mécanisme de type S E Ar .
- (iii) Métathèse de liaison Sigma , qui passe par un état de transition «à quatre centres» dans lequel les liaisons se rompent et se forment en une seule étape:
- L n MR + R'H → L n MR '+ RH
Aperçu historique
La première réaction d'activation C – H est souvent attribuée à Otto Dimroth , qui, en 1902, a rapporté que le benzène réagissait avec l'acétate de mercure (II) (voir: organomercure ). De nombreux centres métalliques électrophiles subissent cette réaction de type Friedel-Crafts. Joseph Chatt a observé l'ajout de liaisons CH du naphtalène par des complexes Ru (0).
Les activations CH assistées par chélation sont courantes. Shunsuke Murahashi a rapporté une fonctionnalisation CH assistée par chélation catalysée par le cobalt de la 2-phénylisoindolin-1-one à partir de ( E ) -N, 1-diphénylméthanimine.
En 1969, AE Shilov a rapporté que le tétrachloroplatinate de potassium induisait un brouillage isotopique entre le méthane et l'eau lourde . La voie a été proposée pour impliquer la liaison du méthane au Pt (II). En 1972, le groupe Shilov a pu produire du méthanol et du chlorure de méthyle dans une réaction similaire impliquant une quantité stoechiométrique de tétrachloroplatinate de potassium , d'hexachloroplatinate de potassium catalytique , de méthane et d'eau. En raison du fait que Shilov a travaillé et publié en Union soviétique pendant la guerre froide , son travail a été largement ignoré par les scientifiques occidentaux. Ce système dit Shilov est aujourd'hui l'un des rares véritables systèmes catalytiques pour les fonctionnalisations alcanes .
Dans certains cas, des découvertes dans l'activation de CH ont été faites en conjonction avec celles du couplage croisé . En 1969, Yuzo Fujiwara a rapporté la synthèse de ( E ) -1,2-diphényléthène à partir de benzène et de styrène avec Pd (OAc) 2 et Cu (OAc) 2 , une procédure très similaire à celle du couplage croisé. Concernant la catégorie de l'addition oxydante, MLH Green a rapporté en 1970 l' insertion photochimique de tungstène (sous forme de complexe Cp 2 WH 2 ) dans une liaison benzène C – H et George M. Whitesides en 1979 a été le premier à réaliser un aliphatique intramoléculaire. Activation C – H
La prochaine percée a été rapportée indépendamment par deux groupes de recherche en 1982. RG Bergman a rapporté la première activation C – H intermoléculaire médiée par un métal de transition d'hydrocarbures non activés et complètement saturés par addition oxydante. En utilisant une approche photochimique , la photolyse de Cp * Ir (PMe 3 ) H 2 , où Cp * est un ligand pentaméthylcyclopentadiényle , a conduit à l'espèce à insaturation coordonnée Cp * Ir (PMe 3 ) qui a réagi par addition oxydative avec le cyclohexane et le néopentane pour former le complexes d'hydridoalkyle correspondants, Cp * Ir (PMe 3 ) HR, où R = cyclohexyle et néopentyle, respectivement. WAG Graham a découvert que les mêmes hydrocarbures réagissent avec Cp * Ir (CO) 2 lors de l'irradiation pour donner les complexes alkylhydrido apparentés Cp * Ir (CO) HR, où R = cyclohexyle et néopentyle, respectivement. Dans ce dernier exemple, la réaction est supposée se dérouler via l'addition oxydante d'alcane à un intermédiaire d'iridium (I) à 16 électrons, Cp * Ir (CO), formé par irradiation de Cp * Ir (CO) 2 .
L'activation sélective et la fonctionnalisation des liaisons alcane C – H ont été rapportées en utilisant un complexe de tungstène équipé de ligands pentaméthylcyclopentadiényle , nitrosyle , allyle et néopentyle, Cp * W (NO) (η 3 -allyl) (CH 2 CMe 3 ).
Dans un exemple impliquant ce système, l'alcane pentane est sélectivement converti en halocarbure 1-iodopentane . Cette transformation a été réalisée via la thermolyse de Cp * W (NO) (η 3 -allyl) (CH 2 CMe 3 ) dans le pentane à température ambiante , entraînant l'élimination du néopentane par un processus de pseudo-premier ordre, générant un indétectable électroniquement et un intermédiaire à 16 électrons à insaturation stérique qui est coordonné par un ligand η 2 - butadiène . L'activation intermoléculaire ultérieure d'une molécule de solvant pentane donne alors un complexe de 18 électrons possédant un ligand n- pentyle. Dans une étape séparée, la réaction avec l' iode à -60 ° C libère du 1-iodopentane du complexe.
Activation dirigée CH
L'activation CH dirigée, assistée par chélation ou «guidée» implique la direction de groupes qui influencent la régio- et la stéréochimie. C'est le style d'activation CH le plus utile en synthèse organique. La N, N-diméthylbenzylamine subit facilement une cyclométallisation par de nombreux métaux de transition. Une implémentation semi-pratique implique des groupes de direction faiblement coordonnés, comme l'illustre la réaction de Murai .

Le mécanisme des réactions d'activation CH catalysées par Pd de la 2-phénylpyridine implique un intermédiaire métallacycle. L'intermédiaire est oxydé pour former une espèce Pd IV , suivi d'une élimination réductrice pour former la liaison CO et libérer le produit.
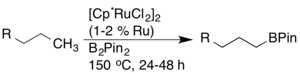
Borylation
La transformation des liaisons CH en liaisons CB par borylation a été minutieusement étudiée en raison de leur utilité en synthèse (c'est-à-dire pour les réactions de couplage croisé). John F. Hartwig a signalé une borylation arène et alcane hautement régiosélective catalysée par un complexe de rhodium. Dans le cas des alcanes, une fonctionnalisation terminale exclusive a été observée.
Plus tard, on a découvert que les catalyseurs au ruthénium avaient une activité et une compatibilité de groupe fonctionnel plus élevées.
D'autres catalyseurs de borylation ont également été développés, y compris des catalyseurs à base d'iridium, qui activent avec succès les liaisons CH avec une compatibilité élevée.
Pour plus d'informations, consultez la borylation .
Gaz naturel
Le méthane d'origine naturelle n'est pas utilisé comme matière première chimique, malgré son abondance et son faible coût. La technologie actuelle fait un usage prodigieux du méthane par reformage à la vapeur pour produire du gaz de synthèse , un mélange de monoxyde de carbone et d'hydrogène. Ce gaz de synthèse est ensuite utilisé dans les réactions Fischer-Tropsch pour fabriquer des produits à chaîne carbonée plus longue ou du méthanol, l'une des matières premières chimiques industrielles les plus importantes. Une méthode intéressante pour convertir ces hydrocarbures implique l'activation du CH. Roy A. Periana , par exemple, a rapporté que des complexes contenant des métaux de transition tardifs, tels que Pt , Pd , Au et Hg , réagissent avec le méthane (CH 4 ) dans H 2 SO 4 pour donner du bisulfate de méthyle . Le processus n'a cependant pas été mis en œuvre commercialement.
Activations asymétriques CH

La synthèse totale de l'acide lithospermique utilise une fonctionnalisation CH guidée au stade tardif en un système hautement fonctionnalisé. Le groupe directeur, une imine chirale non racémique, est capable d'effectuer une alkylation intramoléculaire, qui permet la conversion catalysée par le rhodium de l'imine en dihydrobenzofurane.
La synthèse totale de la calothrixine A et B comporte une réaction de couplage croisé intramoléculaire catalysée par Pd via l'activation CH, un exemple d'une activation CH guidée. Un couplage croisé se produit entre les liaisons aryle CI et CH pour former une liaison CC. La synthèse d'un analogue de la mescaline utilise l' annulation énantiosélective catalysée par le rhodium d'une arylimine via une activation CH.
Voir également
- Couplage oxydatif du méthane
- Couplage déshydrogénatif croisé [réaction CDC]
- Système Shilov
- Fonctionnalisation méta-sélective CH
Avis plus anciens
- Avant 2004
- Arndtsen, BA; Bergman, RG; Mobley, TA; Peterson, TH (1995). "Activation intermoléculaire sélective de liaison carbone – hydrogène par des complexes métalliques synthétiques en solution homogène". Comptes de la recherche chimique . 28 (3): 154–162. doi : 10.1021 / ar00051a009 .
- Crabtree, RH (2001). "Activation et fonctionnalisation de l'alcane C – H avec des catalyseurs de métaux de transition homogènes: un siècle de progrès - un nouveau millénaire en perspective". J. Chem. Soc., Dalton Trans . 17 (17): 2437–2450. doi : 10.1039 / B103147N .
- 2004-7
- Crabtree, RH (2004). "Activation de CH alcane organométallique". J. Organomet. Chem . 689 (24): 4083–4091. doi : 10.1016 / j.jorganchem.2004.07.034 .
- Activation des liaisons organométalliques C – H: une introduction Alan S. Goldman et Karen I. Goldberg ACS Symposium Series 885, Activation and Functionalization of C – H Bonds, 2004 , 1–43
- Periana, RA; Bhalla, G .; Tenn, WJ; III; Young, KJH; Liu, XY; Mironov, O .; Jones, C .; Ziatdinov, VR (2004). "Perspectives sur certains défis et approches pour développer la prochaine génération de catalyseurs d'oxydation sélectifs à basse température pour l'hydroxylation d'alcane basée sur la réaction d'activation C – H". Journal of Molecular Catalysis A: Chimique . 220 (1): 7–25. doi : 10.1016 / j.molcata.2004.05.036 .
- Lersch, M. Tilset (2005). "Aspects mécanistiques de l'activation C-H par les complexes Pt". Chem. Rév . 105 (6): 2471–2526. doi : 10.1021 / cr030710y . PMID 15941220 . , Vedernikov, AN (2007). "Progrès récents dans la fonctionnalisation de liaison CH médiée par platine". Curr. Org. Chem . 11 (16): 1401–1416. doi : 10.2174 / 138527207782418708 .
- 2008-2011
- Davies, HML; Manning, JR (2008). "Fonctionnalisation catalytique C – H par insertion de métalcarbénoïde et nitrenoïde" . La nature . 451 (7177): 417–424. Bibcode : 2008Natur.451..417D . doi : 10.1038 / nature06485 . PMC 3033428 . PMID 18216847 .
- Boutadla, Y .; Davies, DL; Macgregor, SA; Poblador-Bahamonde, AI (2009). "Mécanismes d'activation des liaisons C – H: riche synergie entre le calcul et l'expérience" . Dalton Trans . 2009 (30): 5820-5831. doi : 10.1039 / B904967C . PMID 19623381 .
- Wencel-Delord, J .; Dröge, T .; Liu, F .; Glorius, F. (2011). "Vers l'activation de liaison C – H catalysée par un métal doux". Chem. Soc. Rev. 40 (9): 4740–4761. doi : 10.1039 / C1CS15083A . PMID 21666903 .
- Shulpin, GB (2010). "Amélioration de la sélectivité dans la fonctionnalisation des liaisons C – H: Une revue". Org. Biomol. Chem . 8 (19): 4217–4228. doi : 10.1039 / c004223d . PMID 20593075 .
- Lyon, TW; Sanford, MS (2010). "Réactions de fonctionnalisation C – H dirigées par ligand catalysées par le palladium" . Chem. Rév . 110 (2): 1147-1169. doi : 10.1021 / cr900184e . PMC 2836499 . PMID 20078038 . * Balcells, D .; Clot, E .; Eisenstein, O. (2010). "Activation de liaison C – H dans les espèces métalliques de transition d'un point de vue informatique". Chem. Rév . 110 (2): 749–823. doi : 10.1021 / cr900315k . PMID 20067255 .
- 2012-2015
- Hashiguchi, BG; Bischof, SM; Konnick, MM; Periana, RA (2012). "Concevoir des catalyseurs pour la fonctionnalisation des liaisons C – H non activées sur la base de la réaction d'activation CH". Acc. Chem. Res . 45 (6): 885–898. doi : 10.1021 / ar200250r . PMID 22482496 .
- Kuhl, N.; Hopkinson, MN; Wencel-Delord, J .; Glorius, F. (2012). "Au-delà des groupes de direction: l'activation de CH catalysée par le métal de transition des arènes simples". Angew. Chem. Int. Ed . 51 (41): 10236-10254. doi : 10.1002 / anie.201203269 . PMID 22996679 .
- Wencel-Delord, J .; Glorius, F. (2013). "L'activation des liaisons C – H permet la construction rapide et la diversification à un stade avancé de molécules fonctionnelles". Chimie de la nature . 5 (5): 369–375. Bibcode : 2013NatCh ... 5..369W . doi : 10.1038 / nchem.1607 . PMID 23609086 .
Sources supplémentaires
- FAQ Bergman dans Nature sur l'activation CH (2007)
- Présentation de la littérature par Ramtohul dans le groupe Stoltz sur les applications de l'activation CH
- Powerpoint sur le travail de John Bercaw
- Centre de fonctionnalisation sélective CH