Formule chimique - Chemical formula
| Le sulfate d'aluminium a la formule chimique Al 2 (SO 4 ) 3 . La forme du sulfate d'aluminium hexadécahydraté est Al 2 (SO 4 ) 3 ·16 H 2 O . |
| Formule développée du butane . Des exemples d'autres formules chimiques pour le butane sont la formule empirique C 2 H 5 , la formule moléculaire C 4 H 10 et la formule condensée (ou semi-structurale) CH 3 CH 2 CH 2 CH 3 . |
Une formule chimique (pluriel : formules ) est un moyen de présenter des informations sur les proportions chimiques des atomes qui constituent un composé chimique ou une molécule particulière, en utilisant des symboles d' éléments chimiques , des nombres et parfois aussi d'autres symboles, tels que des parenthèses, des tirets, des crochets, virgules et signes plus (+) et moins (−). Ceux-ci sont limités à une seule ligne typographique de symboles, qui peut inclure des indices et des exposants . Une formule chimique n'est pas un nom chimique et ne contient aucun mot. Bien qu'une formule chimique puisse impliquer certaines structures chimiques simples, ce n'est pas la même chose qu'une formule structurelle chimique complète . Les formules chimiques ne peuvent spécifier pleinement la structure que de la plus simple des molécules et des substances chimiques , et sont généralement plus limitées en puissance que les noms chimiques et les formules structurelles.
Les types les plus simples de formules chimiques sont appelés formules empiriques , qui utilisent des lettres et des chiffres indiquant les proportions numériques des atomes de chaque type. Les formules moléculaires indiquent les nombres simples de chaque type d'atome dans une molécule, sans aucune information sur la structure. Par exemple, la formule empirique du glucose est CH 2 O (deux fois plus d' atomes d' hydrogène que de carbone et d' oxygène ), tandis que sa formule moléculaire est C 6 H 12 O 6 (12 atomes d'hydrogène, six atomes de carbone et d'oxygène).
Parfois, une formule chimique est compliquée en étant écrite sous la forme d'une formule condensée (ou formule moléculaire condensée, parfois appelée "formule semi-structurelle"), qui fournit des informations supplémentaires sur les manières particulières dont les atomes sont chimiquement liés ensemble, soit de manière covalente liaisons , liaisons ioniques ou diverses combinaisons de ces types. Ceci est possible si la liaison pertinente est facile à montrer dans une dimension. Un exemple est la formule moléculaire/chimique condensée de l' éthanol , qui est CH 3 -CH 2 -OH ou CH 3 CH 2 OH. Cependant, même une formule chimique condensée est nécessairement limitée dans sa capacité à montrer des relations de liaison complexes entre les atomes, en particulier les atomes qui ont des liaisons avec quatre substituants différents ou plus .
Étant donné qu'une formule chimique doit être exprimée sous la forme d'une seule ligne de symboles d'éléments chimiques, elle ne peut souvent pas être aussi informative qu'une véritable formule structurelle, qui est une représentation graphique de la relation spatiale entre les atomes dans les composés chimiques (voir par exemple la figure pour le butane formules structurales et chimiques, à droite). Pour des raisons de complexité structurale, une même formule chimique condensée (ou formule semi-structurelle) peut correspondre à différentes molécules, appelées isomères . Par exemple, le glucose partage sa formule moléculaire C 6 H 12 O 6 avec un certain nombre d' autres sucres , dont le fructose , le galactose et le mannose . Il existe des noms chimiques linéaires équivalents qui peuvent spécifier et qui spécifient de manière unique toute formule structurelle complexe (voir nomenclature chimique ), mais ces noms doivent utiliser de nombreux termes (mots), plutôt que les symboles d'éléments simples, les nombres et les symboles typographiques simples qui définissent une formule chimique .
Les formules chimiques peuvent être utilisées dans les équations chimiques pour décrire des réactions chimiques et d'autres transformations chimiques, telles que la dissolution de composés ioniques en solution. Alors que, comme indiqué, les formules chimiques n'ont pas toute la puissance des formules structurelles pour montrer les relations chimiques entre les atomes, elles sont suffisantes pour garder une trace du nombre d'atomes et du nombre de charges électriques dans les réactions chimiques, équilibrant ainsi les équations chimiques de sorte que ces équations peut être utilisé dans des problèmes chimiques impliquant la conservation des atomes et la conservation de la charge électrique.
Aperçu
Une formule chimique identifie chaque élément constitutif par son symbole chimique et indique le nombre proportionnel d'atomes de chaque élément. Dans les formules empiriques, ces proportions commencent par un élément clé, puis attribuent des nombres d'atomes des autres éléments du composé, par rapport à l'élément clé. Pour les composés moléculaires, ces nombres de rapport peuvent tous être exprimés en nombres entiers. Par exemple, la formule empirique de l' éthanol peut s'écrire C 2 H 6 O car les molécules d'éthanol contiennent toutes deux atomes de carbone, six atomes d'hydrogène et un atome d'oxygène. Certains types de composés ioniques, cependant, ne peuvent pas être écrits avec des formules empiriques entièrement en nombres entiers. Un exemple est le carbure de bore , dont la formule de CB n est un rapport de nombres non entiers variable avec n allant de plus de 4 à plus de 6,5.
Lorsque le composé chimique de la formule se compose de molécules simples , les formules chimiques emploient souvent des moyens pour suggérer la structure de la molécule. Ces types de formules sont diversement connus sous le nom de formules moléculaires et de formules condensées . Une formule moléculaire énumère le nombre d'atomes pour refléter ceux de la molécule, de sorte que la formule moléculaire du glucose est C 6 H 12 O 6 plutôt que la formule empirique du glucose, qui est CH 2 O. Cependant, à l'exception des substances très simples, les formules chimiques moléculaires manquent d'informations structurelles nécessaires et sont ambiguës.
Pour les molécules simples, une formule condensée (ou semi-structurelle) est un type de formule chimique qui peut pleinement impliquer une formule structurelle correcte. Par exemple, l' éthanol peut être représenté par la formule chimique CH condensé 3 CH 2 OH, et diméthyl éther par la formule condensée CH 3 OCH 3 . Ces deux molécules ont les mêmes formules empiriques et moléculaires (C 2 H 6 O), mais peuvent être différenciées par les formules condensées présentées, qui sont suffisantes pour représenter la structure complète de ces composés organiques simples .
Les formules chimiques condensées peuvent également être utilisées pour représenter des composés ioniques qui n'existent pas sous forme de molécules discrètes, mais contiennent néanmoins des amas liés de manière covalente. Ces ions polyatomiques sont des groupes d'atomes liés entre eux de manière covalente et ayant une charge ionique globale, comme le sulfate [SO
4]2−
ion. Chaque ion polyatomique dans un composé est écrit individuellement afin d'illustrer les groupements séparés. Par exemple, le composé dichlore hexoxyde a une formule empirique ClO
3, et formule moléculaire Cl
2O
6, mais sous forme liquide ou solide, ce composé est plus correctement représenté par une formule condensée ionique [ClO
2]+
[ClO
4]−
, ce qui illustre que ce composé est constitué de [ClO
2]+
ions et [ClO
4]−
ions. Dans de tels cas, la formule condensée doit seulement être suffisamment complexe pour montrer au moins une de chaque espèce ionique.
Les formules chimiques telles que décrites ici sont distinctes des noms systématiques chimiques beaucoup plus complexes qui sont utilisés dans divers systèmes de nomenclature chimique . Par exemple, un nom systématique pour le glucose est (2 R ,3 S ,4 R ,5 R )-2,3,4,5,6-pentahydroxyhexanal. Ce nom, interprété par les règles qui le sous-tendent, spécifie pleinement la formule structurelle du glucose, mais le nom n'est pas une formule chimique telle qu'elle est généralement comprise, et utilise des termes et des mots non utilisés dans les formules chimiques. De tels noms, contrairement aux formules de base, peuvent représenter des formules structurelles complètes sans graphiques.
Formule empirique
En chimie , la formule empirique d'un produit chimique est une simple expression du nombre relatif de chaque type d'atome ou du rapport des éléments du composé. Les formules empiriques sont la norme pour les composés ioniques , tels que CaCl
2, et pour les macromolécules, telles que SiO
2. Une formule empirique ne fait aucune référence à l' isomérie , à la structure ou au nombre absolu d'atomes. Le terme empirique fait référence au processus d' analyse élémentaire , une technique de chimie analytique utilisée pour déterminer la composition relative en pourcentage d'une substance chimique pure par élément.
Par exemple, l' hexane a une formule moléculaire de C
6H
14, ou structurellement CH
3CH
2CH
2CH
2CH
2CH
3, ce qui implique qu'il a une structure en chaîne de 6 atomes de carbone et 14 atomes d' hydrogène . Cependant, la formule empirique de l'hexane est C
3H
7. De même la formule empirique pour le peroxyde d'hydrogène , H
2O
2, est simplement HO exprimant le rapport 1:1 des éléments constitutifs. Le formaldéhyde et l'acide acétique ont la même formule empirique, CH
2O . C'est la formule chimique réelle du formaldéhyde, mais l'acide acétique a le double du nombre d'atomes.
Formule moléculaire
Les formules moléculaires indiquent les nombres simples de chaque type d'atome dans une molécule d'une substance moléculaire. Ce sont les mêmes que les formules empiriques pour les molécules qui n'ont qu'un seul atome d'un type particulier, mais peuvent autrement avoir des nombres plus importants. Un exemple de la différence est la formule empirique du glucose, qui est CH 2 O ( rapport 1:2:1), tandis que sa formule moléculaire est C 6 H 12 O 6 ( nombre d'atomes 6:12:6). Pour l'eau, les deux formules sont H 2 O. Une formule moléculaire fournit plus d'informations sur une molécule que sa formule empirique, mais est plus difficile à établir.
Une formule moléculaire indique le nombre d'éléments dans une molécule et détermine s'il s'agit d'un composé binaire , d' un composé ternaire , d'un composé quaternaire ou s'il contient encore plus d'éléments.
Formule condensée
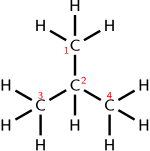
de l' isobutane Formule moléculaire : C 4 H 10
Formule chimique condensée ou semi-structurelle : (CH 3 ) 3 CH
moléculaire : C 4 H 10 Formule
condensée ou semi-structurelle : CH 3 CH 2 CH 2 CH 3
La connectivité d'une molécule a souvent une forte influence sur ses propriétés physiques et chimiques et son comportement. Deux molécules composées du même nombre des mêmes types d'atomes (c'est-à-dire une paire d' isomères ) peuvent avoir des propriétés chimiques et/ou physiques complètement différentes si les atomes sont connectés différemment ou dans des positions différentes. Dans de tels cas, une formule structurelle est utile, car elle illustre quels atomes sont liés à quels autres. De la connectivité, il est souvent possible de déduire la forme approximative de la molécule .
Une formule chimique condensée peut représenter les types et la disposition spatiale des liaisons dans une substance chimique simple, bien qu'elle ne spécifie pas nécessairement les isomères ou les structures complexes. Par exemple, l' éthane se compose de deux atomes de carbone liés l'un à l'autre, chaque atome de carbone ayant trois atomes d'hydrogène liés. Sa formule chimique peut être rendue par CH 3 CH 3 . Dans l' éthylène, il y a une double liaison entre les atomes de carbone (et donc chaque carbone n'a que deux hydrogènes), donc la formule chimique peut s'écrire : CH 2 CH 2 , et le fait qu'il y ait une double liaison entre les carbones est implicite car le carbone a une valence de quatre. Cependant, une méthode plus explicite consiste à écrire H 2 C=CH 2 ou moins communément H 2 C :: CH 2 . Les deux lignes (ou deux paires de points) indiquent qu'une double liaison relie les atomes de part et d'autre d'eux.
Une triple liaison peut être exprimée avec trois lignes (HC=CH) ou trois paires de points (HC:::CH), et s'il peut y avoir une ambiguïté, une seule ligne ou paire de points peut être utilisée pour indiquer une simple liaison.
Les molécules avec plusieurs groupes fonctionnels qui sont les mêmes peuvent être exprimées en entourant le groupe répété entre parenthèses . Par exemple, l' isobutane peut s'écrire (CH 3 ) 3 CH. Cette formule structurelle condensée implique une connectivité différente des autres molécules qui peuvent être formées en utilisant les mêmes atomes dans les mêmes proportions ( isomères ). La formule (CH 3 ) 3 CH implique un atome de carbone central relié à un atome d'hydrogène et trois groupes CH 3 . Le même nombre d'atomes de chaque élément (10 hydrogènes et 4 carbones, ou C 4 H 10 ) peut être utilisé pour fabriquer une molécule à chaîne droite, le n - butane : CH 3 CH 2 CH 2 CH 3 .
Loi de composition
Dans un composé chimique donné, les éléments se combinent toujours dans la même proportion les uns avec les autres. C'est la loi de la composition constante .
La loi de composition constante dit que, dans tout composé chimique particulier, tous les échantillons de ce composé seront constitués des mêmes éléments dans la même proportion ou le même rapport. Par exemple, toute molécule d'eau est toujours composée de deux atomes d'hydrogène et d'un atome d'oxygène dans un rapport de 2:1. Si nous regardons les masses relatives d'oxygène et d'hydrogène dans une molécule d'eau, nous voyons que 94% de la masse d'une molécule d'eau est représentée par l'oxygène et les 6% restants sont la masse d'hydrogène. Cette proportion massique sera la même pour n'importe quelle molécule d'eau.
Noms chimiques en réponse aux limitations des formules chimiques
L'alcène appelé but-2-ène a deux isomères, que la formule chimique CH 3 CH=CHCH 3 n'identifie pas. La position relative des deux groupes méthyle doit être indiquée par une notation supplémentaire indiquant si les groupes méthyle sont du même côté de la double liaison ( cis ou Z ) ou des côtés opposés l'un de l'autre ( trans ou E ).
Comme indiqué ci-dessus, afin de représenter les formules structurelles complètes de nombreux composés organiques et inorganiques complexes, une nomenclature chimique peut être nécessaire qui va bien au-delà des ressources disponibles utilisées ci-dessus dans les formules condensées simples. Voir la nomenclature IUPAC de la chimie organique et la nomenclature IUPAC de la chimie inorganique 2005 pour des exemples. De plus, les systèmes de nommage linéaire tels que l'identifiant chimique international (InChI) permettent à un ordinateur de construire une formule structurelle, et le système d'entrée de ligne d'entrée moléculaire simplifié (SMILES) permet une entrée ASCII plus lisible par l'homme. Cependant, tous ces systèmes de nomenclature vont au-delà des normes des formules chimiques et sont techniquement des systèmes de dénomination chimique, pas des systèmes de formules.
Polymères dans des formules condensées
Pour les polymères dans les formules chimiques condensées, des parenthèses sont placées autour de l'unité de répétition. Par exemple, une molécule d' hydrocarbure qui est décrite comme CH 3 (CH 2 ) 50 CH 3 , est une molécule avec cinquante unités répétitives. Si le nombre d'unités répétitives est inconnu ou variable, la lettre n peut être utilisée pour indiquer cette formule : CH 3 (CH 2 ) n CH 3 .
Ions dans les formules condensées
Pour les ions , la charge d'un atome particulier peut être indiquée par un exposant à droite. Par exemple, Na + ou Cu 2+ . La charge totale d'une molécule chargée ou d'un ion polyatomique peut également être représentée de cette manière. Par exemple : H 3 O + ou SO 4 2− . Notez que + et - sont utilisés à la place de +1 et -1, respectivement.
Pour les ions plus complexes, les crochets [ ] sont souvent utilisés pour entourer la formule ionique, comme dans [B 12 H 12 ] 2− , qui se trouve dans des composés tels que Cs 2 [B 12 H 12 ] . Les parenthèses ( ) peuvent être imbriquées entre crochets pour indiquer une unité répétitive, comme dans [Co(NH 3 ) 6 ] 3+ Cl 3 − . Ici, (NH 3 ) 6 indique que l'ion contient six groupes NH 3 liés au cobalt , et [ ] englobe la formule entière de l'ion de charge +3.
Ceci est strictement facultatif ; une formule chimique est valide avec ou sans information sur l'ionisation, et le chlorure d'hexamminecobalt(III) peut être écrit sous la forme [Co(NH 3 ) 6 ] 3+ Cl 3 − ou [Co(NH 3 ) 6 ]Cl 3 . Les parenthèses, comme les parenthèses, se comportent en chimie comme elles le font en mathématiques, regroupant des termes - elles ne sont pas spécifiquement utilisées uniquement pour les états d'ionisation. Dans ce dernier cas ici, les parenthèses indiquent 6 groupes tous de même forme, liés à un autre groupe de taille 1 (l'atome de cobalt), puis l'ensemble du faisceau, en tant que groupe, est lié à 3 atomes de chlore. Dans le premier cas, il est plus clair que la liaison reliant les chlores est ionique plutôt que covalente .
Isotopes
Bien que les isotopes soient plus pertinents pour la chimie nucléaire ou la chimie des isotopes stables qu'en chimie conventionnelle, différents isotopes peuvent être indiqués avec un exposant préfixé dans une formule chimique. Par exemple, l'ion phosphate contenant du phosphore radioactif-32 est [ 32 PO 4 ] 3− . Une étude impliquant des rapports d'isotopes stables pourrait également inclure la molécule 18 O 16 O.
Un indice de gauche est parfois utilisé de manière redondante pour indiquer le numéro atomique . Par exemple, 8 O 2 pour le dioxygène, et16
8O
2 pour les espèces isotopiques les plus abondantes du dioxygène. Ceci est pratique lors de l'écriture d'équations pour les réactions nucléaires , afin de montrer plus clairement l'équilibre de charge.
Atomes piégés
Le symbole @ ( au signe ) indique un atome ou une molécule piégé à l'intérieur d'une cage mais non lié chimiquement à celle-ci. Par exemple, un buckminsterfullerène (C 60 ) avec un atome (M) serait simplement représenté par MC 60, que M soit à l'intérieur du fullerène sans liaison chimique ou à l'extérieur, lié à l'un des atomes de carbone. En utilisant le symbole @, cela serait noté M@C 60 si M était à l'intérieur du réseau de carbone. Un exemple non fullerène est [As@Ni 12 As 20 ] 3− , un ion dans lequel un atome d'As est piégé dans une cage formée par les 32 autres atomes.
Cette notation a été proposée en 1991 avec la découverte des cages de fullerènes ( fullerènes endoédriques ), qui peuvent piéger des atomes tels que La pour former, par exemple, La@C 60 ou La@C 82 . Le choix du symbole a été expliqué par les auteurs comme étant concis, facilement imprimé et transmis électroniquement (le signe at est inclus en ASCII , sur lequel la plupart des schémas de codage de caractères modernes sont basés), et les aspects visuels suggérant la structure d'un fullerène.
Formules chimiques non stoechiométriques
Les formules chimiques utilisent le plus souvent des nombres entiers pour chaque élément. Cependant, il existe une classe de composés, appelés composés non stoechiométriques , qui ne peuvent pas être représentés par de petits nombres entiers. Une telle formule peut être écrite en utilisant des fractions décimales , comme dans Fe 0,95 O, ou elle peut inclure une partie variable représentée par une lettre, comme dans Fe 1–x O, où x est normalement bien inférieur à 1.
Formes générales des composés organiques
Une formule chimique utilisée pour une série de composés qui diffèrent les uns des autres par une unité constante est appelée formule générale . Il génère une série homologue de formules chimiques. Par exemple, les alcools peuvent être représentés par la formule C n H (2n + 1) OH ( n 1), donnant les homologues méthanol , éthanol , propanol pour n =1–3.
Système de colline
Le système de Hill (ou notation de Hill) est un système d'écriture de formules chimiques empiriques, de formules chimiques moléculaires et de composants d'une formule condensée telle que le nombre d' atomes de carbone dans une molécule est indiqué en premier, le nombre d' atomes d' hydrogène ensuite, puis le nombre de tous les autres éléments chimiques par la suite, dans l' ordre alphabétique des symboles chimiques . Lorsque la formule ne contient pas de carbone, tous les éléments, y compris l'hydrogène, sont classés par ordre alphabétique.
En triant les formules en fonction du nombre d'atomes de chaque élément présent dans la formule selon ces règles, les différences entre les éléments ou les nombres antérieurs étant traitées comme plus importantes que les différences dans tout élément ou nombre ultérieur, comme le tri des chaînes de texte dans l' ordre lexicographique . il est possible de rassembler des formules chimiques dans ce que l'on appelle l'ordre du système de Hill.
Le système Hill a été publié pour la première fois par Edwin A. Hill de l' Office des brevets et des marques des États-Unis en 1900. C'est le système le plus couramment utilisé dans les bases de données chimiques et les index imprimés pour trier les listes de composés.
Une liste de formules dans l'ordre du système Hill est classée par ordre alphabétique, comme ci-dessus, avec des éléments à une lettre avant les symboles à deux lettres lorsque les symboles commencent par la même lettre (donc "B" vient avant "Be", qui vient avant "Br ").
Les exemples de formules suivants sont écrits à l'aide du système Hill et répertoriés dans l'ordre Hill :
- BrI
- CCl 4
- CH 3 I
- C 2 H 5 Br
- H 2 O 4 S
Voir également
- Dictionnaire des formules chimiques
- Symbole d'élément
- Notation nucléaire
- Tableau périodique
- Nomenclature IUPAC de chimie inorganique
- Unité de formule
Les références
- Petrucci, Ralph H.; Harwood, William S.; Hareng, F. Geoffrey (2002). "3" . Chimie générale : principes et applications modernes (8e éd.). Upper Saddle River, NJ : Prentice Hall. ISBN 978-0-13-014329-7. LCCN 2001032331 . OCLC 46872308 .
Liens externes
- Exemple de notation Hill , des bibliothèques Lowell de l'Université du Massachusetts, y compris comment trier dans l'ordre du système Hill
- Calcul de formule moléculaire en utilisant la notation de Hill . La bibliothèque calculant la notation Hill est disponible sur npm .


