Chemostat - Chemostat
| Chemostat | |
|---|---|
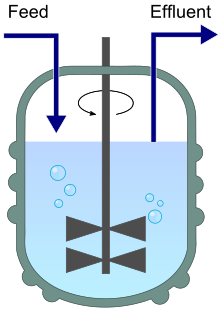 Un diagramme de chimiostat avec entrée (alimentation) et sortie (effluent).
| |
| Industrie | Génie biologique |
| Application | Recherche et industrie |

A chemostat (de chem environnement ical est stat ique) est un bioréacteur à laquelle du milieu frais est ajouté en continu, tandis que le liquide de culture contenant de gauche sur les éléments nutritifs, les produits finaux métaboliques et les micro - organismes sont éliminés en continu à la même vitesse afin de maintenir constant le volume de la culture. En modifiant la vitesse à laquelle le milieu est ajouté au bioréacteur, la vitesse de croissance spécifique du micro - organisme peut être facilement contrôlée dans certaines limites.
Opération
Régime permanent
L'une des caractéristiques les plus importantes des chimiostats est que les micro-organismes peuvent être cultivés dans un état physiologique stable dans des conditions environnementales constantes. Dans cet état stationnaire, la croissance se produit à un taux de croissance spécifique constant et tous les paramètres de culture restent constants (volume de culture, concentration en oxygène dissous, concentrations en nutriments et en produits, pH, densité cellulaire, etc.). De plus, les conditions environnementales peuvent être contrôlées par l'expérimentateur. Les micro-organismes qui poussent dans les chémostats atteignent généralement un état d'équilibre en raison d'une rétroaction négative entre le taux de croissance et la consommation de nutriments: si un faible nombre de cellules sont présentes dans le bioréacteur, les cellules peuvent croître à des taux de croissance supérieurs au taux de dilution car elles consomment peu de nutriments. ainsi la croissance est moins limitée par l'ajout de nutriments limitants avec le milieu frais entrant. Le nutriment limitant est un nutriment essentiel à la croissance, présent dans le milieu à une concentration limitante (tous les autres nutriments sont généralement fournis en surplus). Cependant, plus le nombre de cellules augmente, plus le nutriment est consommé, ce qui réduit la concentration du nutriment limitant. À son tour, cela réduira le taux de croissance spécifique des cellules, ce qui entraînera une diminution du nombre de cellules à mesure qu'elles continuent à être retirées du système avec l'écoulement. Cela se traduit par un état stable. En raison de l'autorégulation, l'état d'équilibre est stable. Cela permet à l'expérimentateur de contrôler le taux de croissance spécifique des micro-organismes en modifiant la vitesse de la pompe alimentant le milieu frais dans le récipient.
Bien mélangé
Une autre caractéristique importante des chimiostats et autres systèmes de culture continue est qu'ils sont bien mélangés de sorte que les conditions environnementales sont homogènes ou uniformes et que les micro-organismes sont dispersés au hasard et se rencontrent au hasard. Par conséquent, la concurrence et les autres interactions dans le chémostat sont globales, contrairement aux biofilms .
Taux de dilution
Le taux de change des éléments nutritifs est exprimé par le taux de dilution D . À l' état stationnaire, le taux de croissance spécifique μ du micro-organisme est égal au taux de dilution D . Le taux de dilution est défini comme le débit de milieu par unité de temps, F , sur le volume V de culture dans le bioréacteur
Taux de croissance maximal et taux de dilution critique
Le taux de croissance spécifique μ est inversement proportionnel au temps nécessaire à la biomasse pour doubler, appelé temps de doublement t d , par:
Par conséquent, le temps de doublement t d devient une fonction du taux de dilution D en régime permanent:
Chaque microorganisme poussant sur un substrat particulier a un taux de croissance spécifique maximal μ max (le taux de croissance observé si la croissance est limitée par des contraintes internes plutôt que par des nutriments externes). Si un taux de dilution est choisie pour être supérieure à μ max , les cellules ne peuvent croître à un rythme aussi rapide que le taux auquel ils sont enlevés de sorte que la culture ne sera pas en mesure de se maintenir dans le bioréacteur, et se laver.
Cependant, étant donné que la concentration du nutriment limitant dans le chémostat ne peut pas dépasser la concentration dans l'aliment, le taux de croissance spécifique que les cellules peuvent atteindre dans le chémostat est généralement légèrement inférieur au taux de croissance spécifique maximal car le taux de croissance spécifique augmente généralement avec le nutriment. concentration telle que décrite par la cinétique de l' équation de Monod . Les « taux (plus de croissance spécifique μ max cellules) peut atteindre est égal au taux critique de dilution ( D » c ):
où S est le substrat ou la concentration de nutriments dans le chémostat et K S est la constante de demi-saturation (cette équation suppose la cinétique Monod).
Applications
Recherche
Les chimiostats dans la recherche sont utilisés pour des recherches en biologie cellulaire, comme source de grands volumes de cellules ou de protéines uniformes. Le chémostat est souvent utilisé pour recueillir des données à l'état d'équilibre sur un organisme afin de générer un modèle mathématique relatif à ses processus métaboliques. Les chimiostats sont également utilisés comme microcosmes en écologie et en biologie évolutive. Dans un cas, la mutation / sélection est une nuisance, dans l'autre cas, c'est le processus souhaité à l'étude. Les chimiostats peuvent également être utilisés pour enrichir des types spécifiques de mutants bactériens en culture tels que les auxotrophes ou ceux qui sont résistants aux antibiotiques ou aux bactériophages pour une étude scientifique plus approfondie. Les variations du taux de dilution permettent d'étudier les stratégies métaboliques poursuivies par les organismes à différents taux de croissance.
La compétition pour des ressources uniques et multiples, l'évolution des voies d'acquisition et d'utilisation des ressources, l'alimentation croisée / symbiose, l'antagonisme, la prédation et la compétition entre les prédateurs ont tous été étudiés en écologie et en biologie évolutive à l' aide de chimiostats.
Industrie
Les chimiostats sont fréquemment utilisés dans la fabrication industrielle de l' éthanol . Dans ce cas, plusieurs chimiostats sont utilisés en série, chacun étant maintenu à des concentrations de sucre décroissantes. Le chimiostat sert également de modèle expérimental de cultures cellulaires continues dans l'industrie biotechnologique.
Problèmes techniques
- Le moussage entraîne un débordement avec le volume de liquide pas exactement constant.
- Certaines cellules très fragiles sont rompues lors de l' agitation et de l' aération .
- Les cellules peuvent se développer sur les parois ou adhérer à d'autres surfaces, qui peuvent être surmontées en traitant les parois en verre du récipient avec un silane pour les rendre hydrophobes. Cependant, les cellules seront sélectionnées pour être attachées aux murs, car celles qui ne le seront pas ne seront pas supprimées du système. Les bactéries qui adhèrent fermement aux parois formant un biofilm sont difficiles à étudier dans des conditions de chimiostat.
- Le mélange peut ne pas être vraiment uniforme, ce qui perturbe la propriété «statique» du chémostat.
- L'égouttement du milieu dans la chambre entraîne en fait de petites impulsions de nutriments et donc des oscillations de concentrations, bouleversant à nouveau la propriété «statique» du chémostat.
- Les bactéries se déplacent assez facilement en amont. Ils atteindront rapidement le réservoir de milieu stérile à moins que le trajet du liquide ne soit interrompu par une coupure d'air dans laquelle le milieu tombe en gouttes dans l'air.
Des efforts continus pour remédier à chaque défaut conduisent à des variations assez régulières du chémostat de base. Les exemples dans la littérature sont nombreux.
- Des agents anti-mousse sont utilisés pour supprimer la formation de mousse.
- L'agitation et l'aération peuvent être effectuées en douceur.
- De nombreuses approches ont été adoptées pour réduire la croissance des murs
- Diverses applications utilisent des palettes, des bulles ou d'autres mécanismes pour mélanger
- L'égouttement peut être rendu moins drastique avec des gouttelettes plus petites et des volumes de vaisseaux plus grands
- De nombreuses améliorations ciblent la menace de contamination
Considérations de conception expérimentale
Choix et configuration des paramètres
- La concentration à l'état d'équilibre du substrat limitant dans le chémostat est indépendante de la concentration d'influx. La concentration d'afflux affectera la concentration cellulaire et donc la DO à l'état d'équilibre.
- Même si la concentration limite de substrat dans le chémostat est généralement très faible et est maintenue par des impulsions d'afflux discrètes hautement concentrées, en pratique la variation temporelle de la concentration dans le chémostat est faible (quelques pour cent ou moins) et peut donc être considérée comme état quasi-stationnaire.
- Le temps nécessaire à la densité cellulaire (DO) pour converger vers une valeur à l'état d'équilibre (dépassement / sous-dépassement) sera souvent long (renouvellements multiples de chimiostat), en particulier lorsque l'inoculum initial est important. Mais, le temps peut être minimisé avec un choix de paramètre approprié.
Croissance à l'état d'équilibre
- Un chimiostat peut sembler être à l'état d'équilibre, mais des reprises de souches mutantes peuvent se produire en continu, même si elles ne sont pas détectables en surveillant des paramètres à l'échelle macro comme la DO ou les concentrations de produit.
- Le substrat limitant est généralement à des concentrations si faibles qu'il est indétectable. En conséquence, la concentration du substrat limitant peut varier considérablement dans le temps (en pourcentage) à mesure que différentes souches prennent le contrôle de la population, même si les changements résultants de la DO sont trop petits pour être détectés.
- Un chémostat «pulsé» (avec de très grandes impulsions d'influx) a une capacité sélective sensiblement inférieure à un chémostat quasi-continu standard, pour une souche mutante avec une aptitude accrue dans des conditions limites.
- En abaissant brusquement la concentration de substrat limitant l'afflux, il est possible de soumettre temporairement les cellules à des conditions relativement plus dures, jusqu'à ce que le chémostat se stabilise à nouveau à l'état d'équilibre (dans l'ordre temporel du taux de dilution D).
Mutation
- Certains types de souches mutantes apparaîtront rapidement:
- S'il existe un SNP qui peut augmenter la forme physique, il devrait apparaître dans la population après seulement quelques doublements de chimiostat, pour les chimiostats de taille caractéristique (par exemple 10 ^ 11 cellules d' E. Coli ).
- Une souche qui nécessite deux SNP spécifiques où seule leur combinaison donne un avantage de fitness (alors que chacun séparément est neutre), est susceptible d'apparaître uniquement si la taille cible (le nombre d'emplacements SNP différents qui donnent lieu à une mutation avantageuse) pour chaque SNP est très volumineux.
- D'autres types de souches mutantes (par exemple deux SNP avec une petite taille de cible, plus de SNP ou dans des chimiostats plus petits) sont très peu susceptibles d'apparaître.
- Ces autres mutations ne sont attendues que par des balayages successifs de mutants avec un avantage de fitness. On ne peut s'attendre à ce que plusieurs mutants apparaissent si chaque mutation est indépendamment bénéfique, et non dans les cas où les mutations sont individuellement neutres mais ensemble avantageuses. Les prises de contrôle successives sont le seul moyen fiable pour que l'évolution se déroule dans un chémostat.
- Le scénario apparemment extrême où nous exigeons que chaque SNP unique possible coexiste au moins une fois dans le chémostat est en fait très probable. Un grand chimiostat atteindra très probablement cet état.
- Pour un grand chémostat, le temps attendu jusqu'à ce qu'une mutation avantageuse se produise est de l'ordre du temps de renouvellement du chémostat. Notez que cela est généralement beaucoup plus court que le temps nécessaire à une souche avantageuse pour prendre le dessus sur la population de chimiostat. Ce n'est pas nécessairement le cas dans un petit chimiostat.
- On s'attend à ce que les points ci-dessus soient les mêmes pour différentes espèces reproductrices asexuées ( E. coli , S. cerevisiae , etc.).
- En outre, le temps jusqu'à l'apparition de la mutation est indépendant de la taille du génome, mais dépend du taux de mutation par BP.
- Pour les chimiostats typiquement grands, une souche hyper-mutante ne donne pas suffisamment d'avantage pour justifier son utilisation. En outre, il n'a pas suffisamment d'avantage sélectif pour s'attendre à toujours apparaître par mutation aléatoire et à prendre le relais du chémostat.
Prise de contrôle unique
- Le temps de reprise est prévisible compte tenu des paramètres de déformation pertinents.
- Différents taux de dilution favorisent sélectivement différentes souches mutantes pour prendre en charge la population de chimiostat, si une telle souche existe. Par example:
- Un taux de dilution rapide crée une pression de sélection pour une souche mutante avec un taux de croissance maximal élevé;
- Un taux de dilution moyen crée une pression de sélection pour une souche mutante avec une affinité plus élevée pour le substrat limitant;
- Une vitesse de dilution lente crée une pression de sélection pour une souche mutante qui peut croître dans un milieu sans substrat limitant (vraisemblablement en consommant un substrat différent présent dans le milieu);
- Le temps de prise de contrôle d'un mutant supérieur sera assez constant sur une gamme de paramètres de fonctionnement. Pour les valeurs d'opération caractéristiques, le temps de prise en charge est de l'ordre de quelques jours à plusieurs semaines.
Rachats successifs
- Lorsque les conditions sont réunies (une population suffisamment grande et plusieurs cibles dans le génome pour de simples mutations avantageuses), on s'attend à ce que plusieurs souches prennent successivement le contrôle de la population, et ce de manière relativement chronométrée et rythmée. Le moment dépend du type de mutations.
- Dans une succession de reprise, même si l'amélioration sélective de chacune des souches reste constante (par exemple, chaque nouvelle souche est meilleure que la souche précédente par un facteur constant) - le taux de reprise ne reste pas constant, mais diminue plutôt d'une souche à l'autre.
- Il existe des cas où des reprises successives se produisent si rapidement qu'il est très difficile de différencier les souches, même en examinant la fréquence des allèles. Ainsi, une lignée de prises de contrôle multiples de souches consécutives pourrait apparaître comme la prise de contrôle d'une seule souche avec une cohorte de mutations.
Variations
Les installations de fermentation étroitement liées aux chimiostats sont le turbidostat , l' auxostat et le rétentostat . Dans les rétentostats, le liquide de culture est également éliminé du bioréacteur, mais un filtre retient la biomasse. Dans ce cas, la concentration de la biomasse augmente jusqu'à ce que les besoins en éléments nutritifs pour le maintien de la biomasse deviennent égaux à la quantité de nutriments limitants qui peut être consommée.
Voir également
- Croissance bactérienne
- Génie biochimique
- Réacteur à cuve agitée en continu (CSTR)
- Expérience d'évolution à long terme d'E. Coli
- Fed-batch
Les références
Liens externes
- http://www.pererikstrandberg.se/examensarbete/chemostat.pdf
- https://web.archive.org/web/20060504172359/http://www.rpi.edu/dept/chem-eng/Biotech-Environ/Contin/chemosta.htm
- Une thèse finale comprenant des modèles mathématiques du chémostat et d'autres bioréacteurs
- Une page sur la conception d'un chimiostat de laboratoire
- Manuel complet de chimiostat (laboratoire de Dunham). Les procédures et principes sont généraux.




