Chytridiomycose - Chytridiomycosis
Chytridiomycosis (chy · tridéo · i · o · ma · co · sis | \ kī-tří-de-o--mí-kō səs) est une maladie infectieuse dans les amphibiens , causée par la chytrides champignons Batrachochytrium dendrobatidis et salamandrivorans Batrachochytrium , un non hyphes zoospores champignon . Chytridiomycosis a été liée à la population dramatique déclin ou extinctions d'espèces d' amphibiens dans l' ouest de l' Amérique du Nord , Amérique Centrale , Amérique du Sud , de l' Est en Australie , est l' Afrique ( Tanzanie ), et Dominique et Montserrat dans les Caraïbes . Une grande partie du Nouveau Monde est également à risque d'apparition de la maladie dans les années à venir. Le champignon est capable de provoquer des décès sporadiques chez certaines populations d'amphibiens et une mortalité de 100 % chez d'autres. Aucune mesure efficace n'est connue pour contrôler la maladie dans les populations sauvages. Divers signes cliniques sont observés chez les individus touchés par la maladie. Un certain nombre d'options sont possibles pour contrôler ce champignon pathogène, bien qu'aucune ne se soit avérée réalisable à grande échelle. La maladie a été proposée comme un facteur contribuant à un déclin mondial des populations d'amphibiens qui a apparemment affecté environ 30% des espèces d'amphibiens du monde. Certaines recherches ont trouvé des preuves insuffisantes pour lier les champignons chytridés et la chytridiomycose aux déclins mondiaux des amphibiens, mais des recherches plus récentes établissent un lien et attribuent la propagation de la maladie à sa transmission par les routes commerciales internationales dans les écosystèmes indigènes.
Histoire
On ne sait pas si la chytridiomycose est un nouveau pathogène émergent ou un pathogène existant avec une virulence récemment accrue .
La maladie sous sa forme épizootique a été découverte pour la première fois en 1993 chez des grenouilles mortes ou mourantes dans le Queensland , en Australie . Il était présent dans le pays depuis au moins 1978 et est répandu dans toute l'Australie. On le trouve également en Afrique , dans les Amériques , en Europe , en Nouvelle-Zélande et en Océanie . En Australie, au Panama et en Nouvelle-Zélande, le champignon semble avoir soudainement « apparu » et étendu son aire de répartition en même temps que le nombre de grenouilles diminuait. Dans les Amériques, il est originaire du Venezuela en 1987, où il a balayé le continent jusqu'en Amérique centrale. Il a également été trouvé dans la partie inférieure de l'Amérique centrale en 1987, où il s'est propagé vers le bas pour rencontrer le mouvement ascendant de l'Amérique du Sud. Cependant, il se peut simplement que le champignon soit présent naturellement et n'a été identifié que récemment parce qu'il est devenu plus virulent ou plus répandu dans l'environnement, ou parce que les populations hôtes sont devenues moins résistantes à la maladie. Le champignon a été détecté dans quatre régions d'Australie—la côte est, Adélaïde , le sud-ouest de l'Australie-Occidentale et le Kimberley—et est probablement présent ailleurs. Dernièrement, les génomes de 234 isolats de Batrachochytrium dendrobatidis ont été comparés phylogénétiquement et les résultats suggèrent fortement qu'une lignée trouvée dans la péninsule coréenne a probablement ensemencé le panzootique.
Parmi les grenouilles, la plus ancienne occurrence documentée de Batrachochytrium provient d'un spécimen de grenouille aquatique Titicaca collecté en 1863, et parmi les salamandres, la plus ancienne était une salamandre géante japonaise collectée en 1902. Cependant, ces deux espèces impliquaient des souches du champignon qui n'ont pas été impliquées. dans les événements de mortalité de masse. Un exemple ultérieur d'amphibien infecté par Bd était un spécimen de grenouille africaine à griffes ( Xenopus laevis ) collecté en 1938, et cette espèce semble également être essentiellement non affectée par la maladie, ce qui en fait un vecteur approprié . La première méthode bien documentée de test de grossesse humaine impliquait cette espèce et, par conséquent, le commerce international à grande échelle de grenouilles à griffes africaines vivantes a commencé il y a plus de 60 ans. Si Batrachochytrium est originaire d'Afrique, la grenouille à griffes africaine aurait été le vecteur de la dissémination initiale hors du continent. Le premier cas documenté de la maladie chytridiomycose était une grenouille-taureau américaine ( Rana catesbeiana ) collectée en 1978.
Varier
L'aire de répartition géographique de la chytridiomycose est difficile à déterminer. Si elle survient, la maladie n'est présente que là où le champignon B. dendrobatidis est présent. Cependant, la maladie n'est pas toujours présente là où se trouve le champignon. Les raisons du déclin des amphibiens sont souvent qualifiées d'« énigmatiques » car la cause est inconnue. Pourquoi certaines zones sont affectées par le champignon alors que d'autres ne le sont pas n'est pas entièrement comprise. Des facteurs oscillants tels que le climat, la qualité de l'habitat et la densité de population peuvent être des facteurs qui amènent le champignon à infecter les amphibiens d'une zone donnée. Par conséquent, lors de l'examen de l'aire de répartition géographique de la chytridiomycose, l'aire d' occurrence de B. dendrobatidis doit être prise en compte. L'aire de répartition géographique de B. dendrobatidis a été récemment cartographiée et s'étend sur une grande partie du monde. B. dendrobatidis a été détecté dans 56 des 82 pays et dans 516 des 1240 (42 %) espèces en utilisant un ensemble de données de plus de 36 000 individus. Il est largement répandu dans les Amériques et détecté sporadiquement en Afrique, en Asie et en Europe. L'Asie, par exemple, n'a que 2,35% de prévalence.
L'aire de répartition appropriée pour B. dendrobatidis dans le Nouveau Monde est vaste. Les régions les plus adaptées comprennent les habitats qui contiennent la faune d'amphibiens la plus diversifiée au monde. Les zones à risque sont la forêt occidentale de pin de Sierra Madre, la forêt sèche de Sonora et de Sinaloan, la forêt humide de Veracruz, l'Amérique centrale à l'est de l'isthme de Tehuantepec, les îles des Caraïbes, la forêt tempérée du Chili et l'ouest de l'Argentine au sud de 30°S , les Andes au-dessus de 1000 m au-dessus du niveau de la mer au Venezuela, en Colombie et en Équateur, les pentes orientales des Andes au Pérou et en Bolivie, la forêt atlantique brésilienne, l'Uruguay, le Paraguay et le nord-est de l'Argentine, ainsi que le sud-ouest et l'Amazonie Madère-Tapajós forêts tropicales.
Actuellement, les effets de la chytridiomycose sont plus facilement observés en Amérique centrale, en Australie orientale, en Amérique du Sud et en Amérique du Nord occidentale.
Changement climatique
Une étude suggère que l'évolution des températures mondiales peut être responsable d'une prolifération accrue de la chytridiomycose. L'augmentation de la température a augmenté l'évaporation dans certains milieux forestiers, ce qui a favorisé la formation de nuages. Les experts proposent qu'une couverture nuageuse accrue pourrait en fait diminuer la température diurne en bloquant le soleil, tandis que la nuit, la couverture nuageuse sert d'isolant pour élever la température nocturne de sa plage normale. La combinaison d'une diminution de la température diurne et d'une augmentation des températures nocturnes peut fournir une croissance et une reproduction optimales pour le champignon Chytrid qui a une plage de température préférée entre 63 ° et 77 ° F (17 ° et 25 ° C). Le champignon meurt à des températures égales ou supérieures à 30 °C, ce qui, sans la couverture nuageuse due à une évaporation accrue, est plus facilement atteint par l'environnement et peut donc plus facilement contrôler la population de champignons.
Agents responsables
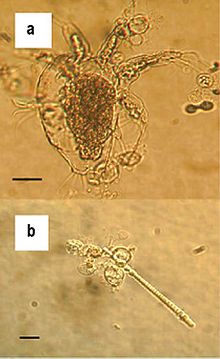
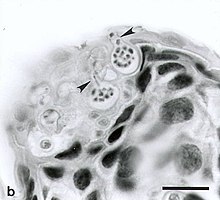
La chytridiomycose causée par le champignon B. dendrobatidis affecte principalement les couches les plus externes de la peau contenant de la kératine. Lorsque la plupart des espèces atteignent un seuil de B. dendrobatidis de 10 000 zoospores, elles ne sont pas capables de respirer, de s'hydrater, de s'osmoréguler ou de se thermoréguler correctement. Ceci est prouvé par des échantillons de sang qui montrent un manque de certains électrolytes, tels que le sodium, le magnésium et le potassium. B. dendrobatidis est actuellement connu pour avoir deux stades de vie. Le premier est le stade zoosporangial asexué. Lorsqu'un hôte contracte la maladie pour la première fois, les spores pénètrent dans la peau et se fixent à l'aide de racines de microtubules. La deuxième étape a lieu lorsque les zoosporanges asexués initiaux produisent des zoospores mobiles. Pour disperser et infecter les cellules épidermiques, une surface humide est nécessaire. Une deuxième espèce de Batrachochytrium , B. salamandrivorans , a été découverte en 2013 et est connue pour provoquer la chytridiomycose chez les salamandres.
Transmission et progression de la maladie
B. dendrobatidis , un agent pathogène d'origine hydrique, disperse les zoospores dans l'environnement. Les zoospores utilisent des flagelles pour se déplacer dans les systèmes d'eau jusqu'à ce qu'elles atteignent un nouvel hôte et pénètrent par voie cutanée. Le cycle de vie de B. dendrobatidis se poursuit jusqu'à ce que de nouvelles zoospores soient produites à partir du zoosporange et sortent dans l'environnement ou réinfectent le même hôte. Une fois que l'hôte est infecté par B. dendrobatidis , il peut potentiellement développer une chytridiomycose, mais tous les hôtes infectés ne la développent pas. D'autres formes de transmission sont actuellement inconnues; cependant, la chytridiomycose est postulée pour être transmise par contact direct d'hôtes ou par l'intermédiaire d'un hôte intermédiaire.
Une grande partie de la façon dont B. dendrobatidis est transmis avec succès d'un hôte à l'autre est en grande partie inconnue. Une fois libérées dans le milieu aquatique, les zoospores parcourent moins de 2 cm dans les 24 heures avant de s'enkyster. L'aire de répartition limitée des zoospores de B. dendrobatidis suggère qu'il existe un mécanisme inconnu par lequel elles se transmettent d'un hôte à l'autre, ce qui peut impliquer le commerce des animaux de compagnie, et en particulier le ouaouaron américain. Des facteurs abiotiques tels que la température, le pH et les niveaux de nutriments affectent le succès des zoospores de B. dendrobatidis . Les zoospores du champignon peuvent survivre dans une plage de température de 4 à 25 °C et une plage de pH de 6 à 7.
On pense que la chytridiomycose suit ce cours : les zoospores rencontrent d'abord la peau des amphibiens et donnent rapidement naissance à des sporanges , qui produisent de nouvelles zoospores. La maladie progresse ensuite au fur et à mesure que ces nouvelles zoospores réinfectent l'hôte. Les changements morphologiques chez les amphibiens infectés par le champignon comprennent un rougissement de la peau ventrale, des convulsions avec extension des membres postérieurs, des accumulations de desquamation sur le corps, une desquamation de l' épiderme superficiel des pieds et d'autres zones, une légère rugosité de la surface avec de minuscules acrochordons et petits ulcères ou hémorragies occasionnels . Les changements de comportement peuvent inclure une léthargie, une incapacité à chercher un abri, une incapacité à fuir, une perte du réflexe de redressement et une posture anormale (par exemple, s'asseoir avec les pattes arrière éloignées du corps).
Outre les amphibiens, la chytridiomycose infecte également les écrevisses ( Procambarus alleni , P. clarkii , Orconectes virilis et O. immunis ) mais pas les moustiques ( Gambusia holbrooki ).
Signes cliniques
On sait que les amphibiens infectés par B. dendrobatidis présentent de nombreux signes cliniques différents. Peut-être que le premier signe d'infection est l'anorexie, qui survient aussi rapidement que huit jours après l'exposition. Les individus infectés se trouvent également généralement dans un état léthargique, caractérisé par des mouvements lents, et refusent de bouger lorsqu'ils sont stimulés. Une perte excessive de peau est observée chez la plupart des espèces de grenouilles affectées par B. dendrobatidis . Ces morceaux de peau perdue sont décrits comme opaques, gris-blanc et bronzés. Certaines de ces plaques de peau adhèrent également à la peau des amphibiens. Ces signes d'infection sont souvent observés 12 à 15 jours après l'exposition. Le symptôme le plus typique de la chytridiomycose est l'épaississement de la peau, qui entraîne rapidement la mort des personnes infectées, car ces personnes ne peuvent pas absorber les nutriments appropriés, libérer des toxines ou, dans certains cas, respirer. D'autres signes courants sont une rougeur de la peau, des convulsions et une perte du réflexe de redressement. Chez les têtards, B. dendrobatidis affecte les pièces buccales, où la kératine est présente, entraînant des comportements alimentaires anormaux ou une décoloration de la bouche.
Recherche et impact
Le champignon chytride des amphibiens semble mieux se développer entre 17 et 25 °C, et l'exposition des grenouilles infectées à des températures élevées peut guérir les grenouilles. Dans la nature, plus des grenouilles individuelles étaient trouvées à des températures supérieures à 25 °C, moins elles étaient susceptibles d'être infectées par le chytride des amphibiens. Cela peut expliquer pourquoi les déclins d'amphibiens induits par la chytridiomycose se sont produits principalement à des altitudes plus élevées et pendant les mois les plus froids. Les peptides cutanés produits naturellement peuvent inhiber la croissance de B. dendrobatidis lorsque les amphibiens infectés se trouvent à des températures proches de 10 °C (50 °F), permettant à des espèces comme la grenouille léopard ( Rana pipiens ) d'éliminer l'infection dans environ 15 % des cas. .
Bien que de nombreux déclins aient été attribués au champignon B. dendrobatidis - bien que probablement prématurément dans de nombreux cas - certaines espèces résistent à l'infection et certaines populations peuvent survivre avec un faible niveau de persistance de la maladie. De plus, certaines espèces qui semblent résister à l'infection peuvent en fait héberger une forme non pathogène de B. dendrobatidis .
Certains chercheurs soutiennent que l'accent mis sur la chytridiomycose a rendu les efforts de conservation des amphibiens dangereusement myopes. Un examen des données de la Liste rouge de l'UICN a révélé que la menace de la maladie était supposée dans la plupart des cas, mais aucune preuve ne montre qu'il s'agit en fait d'une menace. Les efforts de conservation en Nouvelle-Zélande continuent de se concentrer sur la guérison de la grenouille indigène en danger critique d'extinction , Leiopelma archeyi , de la chytridiomycose, bien que la recherche ait clairement montré qu'ils sont immunisés contre l'infection par B. dendrobatidis et meurent dans la nature d'autres encore à -être des maladies identifiées. Au Guatemala, plusieurs milliers de têtards ont péri à cause d'un pathogène non identifié distinct de B. dendrobatidis .
Une revue scientifique de 2019 a évalué que la chytridiomycose était un facteur dans le déclin d'au moins 501 espèces d'amphibiens au cours des 50 dernières années, dont 90 espèces ont été confirmées ou présumées éteintes à l'état sauvage et 124 autres ont diminué en nombre de plus de 90%. L'examen a caractérisé le bilan global comme la « plus grande perte de biodiversité enregistrée attribuable à une maladie ». Cependant, une étude de suivi dans Science a révélé que l'étude 2019 de Scheele et al. manquait des preuves nécessaires pour faire ces allégations et a trouvé que les conclusions ne pouvaient pas être reproduites avec les données et les méthodes de l'étude originale. On ne sait pas encore combien et quelles espèces ont été touchées par la chytridiomycose, mais il existe de bonnes données pour un nombre limité d'espèces telles que la grenouille à pattes jaunes des montagnes de la Sierra Nevada.
Immunité
En raison de l'immense impact du champignon sur les populations d'amphibiens, des recherches considérables ont été entreprises pour concevoir des méthodes pour lutter contre sa prolifération dans la nature. L'une des plus prometteuses est la révélation que les amphibiens des colonies qui survivent au passage de l'épidémie de chytrides ont tendance à porter des niveaux plus élevés de la bactérie Janthinobacterium lividum . Cette bactérie produit des composés antifongiques , tels que l' indole-3-carboxaldéhyde et la violacéine , qui inhibent la croissance de B. dendrobatidis même à de faibles concentrations. De même, la bactérie Lysobacter gummosus trouvée sur la salamandre à dos rouge ( Plethodon cinereus ), produit le composé 2,4-diacétylphloroglucinol qui inhibe la croissance de B. dendrobatidis . Une recherche de 2021 trouve une gamme encore plus large de bactéries antifongiques vivant sur les amphibiens.
Comprendre les interactions des communautés microbiennes présentes sur la peau des amphibiens avec les espèces fongiques de l'environnement peut révéler pourquoi certains amphibiens, comme la grenouille Rana muscosa , sont sensibles aux effets mortels de B. dendrobatidis et pourquoi d'autres, comme la salamandre Hemidactylium scutatum , sont capables de coexister avec le champignon. Comme mentionné précédemment, il a été démontré que l' espèce bactérienne antifongique Janthinobacterium lividum , trouvée sur plusieurs espèces d'amphibiens, prévient les effets de l'agent pathogène même lorsqu'elle est ajoutée à un autre amphibien dépourvu de la bactérie ( B. dendrobatidis - espèce d'amphibien sensible). Les interactions entre le microbiote cutané et B. dendrobatidis peuvent être modifiées pour favoriser la résistance de la maladie, comme l'ont montré des études antérieures concernant l'ajout de la bactérie productrice de violacéine J. lividum à des amphibiens dépourvus de suffisamment de violacéine, leur permettant d'inhiber l'infection. Bien que la concentration exacte de violacéine (métabolite antifongique produit par J. lividum ) nécessaire pour inhiber les effets de B. dendrobatidis ne soit pas entièrement confirmée, la concentration de violacéine peut déterminer si un amphibien subira ou non une morbidité (ou une mortalité) causée par B. dendrobatidis . La grenouille Rana muscosa , par exemple, s'est avérée avoir de très faibles concentrations de violacéine sur sa peau, mais la concentration est si faible qu'elle est incapable de faciliter la survie accrue de la grenouille ; de plus, J. lividum n'a pas été trouvé présent sur la peau de R. muscosa . Cela implique que la bactérie antifongique J. lividum (originaire de la peau d'autres amphibiens, comme Hemidactylium scutatum ) est capable de produire une quantité suffisante de violacéine pour empêcher l'infection par B. dendrobatidis et permettre la coexistence avec le champignon potentiellement mortel.
Une étude a postulé que la puce d'eau Daphnia magna mange les spores du champignon.
Interactions avec les pesticides
L'hypothèse selon laquelle l' utilisation de pesticides a contribué au déclin des populations d'amphibiens a été suggérée à plusieurs reprises dans la littérature. Les interactions entre les pesticides et la chytridiomycose ont été examinées en 2007, et il a été démontré qu'une exposition sublétale au pesticide carbaryl (un inhibiteur de la cholinestérase ) augmente la sensibilité des grenouilles à pattes jaunes ( Rana boylii ) à la chytridiomycose. En particulier, les défenses peptidiques de la peau ont été considérablement réduites après une exposition au carbaryl, ce qui suggère que les pesticides peuvent inhiber cette défense immunitaire innée et augmenter la sensibilité aux maladies.
Évolution
Des indices d'une résistance évolutive émergente dans une population en rebond d'une espèce de grenouille affligée ont été rapportés à partir d'une étude écologique d'une grenouille de ruisseaux en voie de disparition, Mixophyes fleayi, signalée dans l'Australie subtropicale. Le rebond des espèces de grenouilles au Panama après le déclin n'est pas associé à l'atténuation des agents pathogènes, mais plutôt à un facteur d'hôte - qu'il s'agisse d'une résistance génétique évoluée à l'infection fongique ou d'un autre trait acquis (comme une colonisation microbienne hypothétiquement protectrice) n'a pas encore été identifié. .
Options de traitement
L'utilisation d'antifongiques et de thérapies induites par la chaleur a été suggérée comme traitement de B. dendrobatidis. Cependant, certains de ces antifongiques peuvent provoquer des effets néfastes sur la peau de certaines espèces de grenouilles, et bien qu'ils soient utilisés pour traiter des espèces infectées par la chytridiomycose, l'infection n'est jamais complètement éradiquée. Une étude réalisée par Rollins-Smith et ses collègues suggère que l' itraconazole est l'antifongique de choix lorsqu'il s'agit de traiter le Bd. Ceci est favorisé par rapport à l' amphotéricine B et au chloramphénicol en raison de leur toxicité, en particulier le chloramphénicol, car il est corrélé à la leucémie chez les crapauds. Cela devient une situation difficile car sans traitement, les grenouilles souffriront de déformations des membres et même de la mort, mais peuvent également souffrir d'anomalies cutanées avec un traitement. « Le traitement n'est pas toujours efficace à 100 % et tous les amphibiens ne tolèrent pas très bien le traitement. Par conséquent, la chytridiomycose doit toujours être traitée avec l'avis d'un vétérinaire. »
Les individus infectés par B. dendrobatidis sont baignés dans des solutions d'itraconazole, et en quelques semaines, les individus précédemment infectés sont négatifs pour B. dendrobatidis à l' aide de tests PCR. La thermothérapie est également utilisée pour neutraliser B. dendrobatidis chez les individus infectés. Des expériences de laboratoire à température contrôlée sont utilisées pour augmenter la température d'un individu au-delà de la plage de température optimale de B. dendrobatidis . Des expériences, où la température est augmentée au-delà de la limite supérieure de la plage optimale de B. dendrobatidis de 25 à 30 °C, montrent que sa présence se dissipera en quelques semaines et que les individus infectés reviennent à la normale. Le formol / vert malachite a également été utilisé pour traiter avec succès les personnes infectées par la chytridiomycose. Une grenouille d'Archey a été guérie avec succès de la chytridiomycose en appliquant localement du chloramphénicol. Cependant, les risques potentiels de l'utilisation de médicaments antifongiques sur les individus sont élevés.
La bioaugmentation est également considérée comme un traitement possible contre B. dendrobatidis . L'hôte amphibien et même l'environnement peuvent être augmentés de bactéries probiotiques qui expriment des métabolites antifongiques capables de combattre B. dendrobatidis . Un exemple d'application de probiotiques est celui de l'espèce Rana muscosa dans la Sierra Nevada ; les individus traités avec le probiotique J. lividum présentaient une plus grande survie et des charges de B. dendrobatidis inférieures par rapport aux témoins non traités.</ref> et aux espèces de grenouilles endémiques, la grenouille de Beysehir en Turquie ( Pelophylax caralitanus ).
Voir également
- Maladies infectieuses émergentes
- Syndrome du nez blanc
- Grenouille à couvaison gastrique
- Crapaud doré
- Crapaud Guajira
- Rainette frangée de Rabb
- Extinction holocène
Les références
Liens externes
- Article dans National Geographic Magazine, avril 2009
- Commerce des espèces sauvages et émergence mondiale des maladies
- Principales stratégies de gestion préventive du champignon Chytrid
- Chytridiomycose amphibie à la page d'accueil des maladies amphibies
- 'Amphibian Ark' vise à sauver les grenouilles des champignons