Cytosquelette - Cytoskeleton
| Biologie cellulaire | |
|---|---|
| Diagramme de cellules animales | |
 Composants d'une cellule animale typique :
|

Le cytosquelette est un réseau complexe et dynamique de filaments protéiques interconnectés présents dans le cytoplasme de toutes les cellules , y compris les bactéries et les archées . Il s'étend du noyau cellulaire à la membrane cellulaire et est composé de protéines similaires dans les divers organismes. Chez les eucaryotes , il est composé de trois composants principaux, les microfilaments , les filaments intermédiaires et les microtubules , et ceux-ci sont tous capables de croître ou de se désassembler rapidement en fonction des besoins de la cellule.
Une multitude de fonctions peuvent être remplies par le cytosquelette. Sa fonction principale est de donner à la cellule sa forme et sa résistance mécanique à la déformation, et par association avec le tissu conjonctif extracellulaire et d'autres cellules, elle stabilise des tissus entiers. Le cytosquelette peut également se contracter, déformant ainsi la cellule et son environnement et permettant aux cellules de migrer . De plus, il est impliqué dans de nombreuses voies de signalisation cellulaire et dans l'absorption de matériel extracellulaire ( endocytose ), la ségrégation des chromosomes lors de la division cellulaire , l' étape de cytokinèse de la division cellulaire, comme échafaudage pour organiser le contenu de la cellule dans l'espace et en intracellulaire. transport (par exemple, le mouvement des vésicules et des organites à l'intérieur de la cellule) et peut être un modèle pour la construction d'une paroi cellulaire . De plus, il peut former des structures spécialisées, telles que des flagelles , des cils , des lamellipodes et des podosomes . La structure, la fonction et le comportement dynamique du cytosquelette peuvent être très différents selon l'organisme et le type de cellule. Même au sein d'une cellule, le cytosquelette peut changer par association avec d'autres protéines et l'histoire précédente du réseau.
Un exemple à grande échelle d'une action effectuée par le cytosquelette est la contraction musculaire . Ceci est réalisé par des groupes de cellules hautement spécialisées travaillant ensemble. Un composant principal du cytosquelette qui aide à montrer la véritable fonction de cette contraction musculaire est le microfilament . Les microfilaments sont composés de la protéine cellulaire la plus abondante connue sous le nom d'actine. Lors de la contraction d'un muscle , au sein de chaque cellule musculaire, les moteurs moléculaires de la myosine exercent collectivement des forces sur des filaments d' actine parallèles . La contraction musculaire commence à partir de l'influx nerveux qui provoque ensuite la libération de quantités accrues de calcium par le réticulum sarcoplasmique . L'augmentation du calcium dans le cytosol permet à la contraction musculaire de commencer à l'aide de deux protéines, la tropomyosine et la troponine . La tropomyosine inhibe l'interaction entre l'actine et la myosine, tandis que la troponine détecte l'augmentation du calcium et libère l'inhibition. Cette action contracte la cellule musculaire et, par le processus synchrone dans de nombreuses cellules musculaires, l'ensemble du muscle.
Histoire
En 1903, Nikolai K. Koltsov a proposé que la forme des cellules soit déterminée par un réseau de tubules qu'il a appelé le cytosquelette. Le concept d'une mosaïque de protéines qui coordonnait dynamiquement la biochimie cytoplasmique a été proposé par Rudolph Peters en 1929 tandis que le terme ( cytosquelette , en français) a été introduit pour la première fois par l'embryologiste français Paul Wintrebert en 1931.
Lorsque le cytosquelette a été introduit pour la première fois, on pensait qu'il s'agissait d'une substance gélatineuse sans intérêt qui aidait les organites à rester en place. De nombreuses recherches ont eu lieu pour essayer de comprendre le but du cytosquelette et de ses composants. Avec l'aide de Stuart Hameroff et Roger Penrose, il a été découvert que les microtubules vibraient dans les neurones du cerveau, ce qui suggère que les ondes cérébrales proviennent de vibrations plus profondes des microtubules. Cette découverte a démontré que le cytosquelette n'est pas seulement une substance semblable à un gel et qu'il a en fait un but.
Initialement, on pensait que le cytosquelette était exclusif aux eucaryotes, mais en 1992, il a été découvert qu'il était également présent chez les procaryotes. Cette découverte est intervenue après la prise de conscience que les bactéries possèdent des protéines homologues à la tubuline et à l'actine ; les principaux composants du cytosquelette eucaryote.
Cytosquelette eucaryote
Les cellules eucaryotes contiennent trois principaux types de filaments du cytosquelette : les microfilaments , les microtubules et les filaments intermédiaires . Dans les neurones, les filaments intermédiaires sont appelés neurofilaments . Chaque type est formé par la polymérisation d'un type distinct de sous - unité protéique et a sa propre forme caractéristique et sa propre distribution intracellulaire . Les microfilaments sont des polymères de la protéine actine et ont un diamètre de 7 nm. Les microtubules sont composés de tubuline et ont un diamètre de 25 nm. Les filaments intermédiaires sont composés de diverses protéines, selon le type de cellule dans lequel ils se trouvent ; ils ont normalement un diamètre de 8 à 12 nm. Le cytosquelette fournit à la cellule une structure et une forme, et en excluant les macromolécules d'une partie du cytosol , il augmente le niveau d' encombrement macromoléculaire dans ce compartiment. Les éléments du cytosquelette interagissent de manière extensive et intime avec les membranes cellulaires.
Les recherches sur les maladies neurodégénératives telles que la maladie de Parkinson , la maladie d'Alzheimer , la maladie de Huntington et la sclérose latérale amyotrophique (SLA) indiquent que le cytosquelette est affecté dans ces maladies. La maladie de Parkinson est marquée par la dégradation des neurones, entraînant des tremblements, une rigidité et d'autres symptômes non moteurs. La recherche a montré que l'assemblage et la stabilité des microtubules dans le cytosquelette sont compromis, ce qui entraîne une dégradation des neurones au fil du temps. Dans la maladie d'Alzheimer, les protéines tau qui stabilisent les microtubules fonctionnent mal dans la progression de la maladie provoquant une pathologie du cytosquelette. L'excès de glutamine dans la protéine de Huntington impliquée dans la liaison des vésicules au cytosquelette est également proposé comme étant un facteur dans le développement de la maladie de Huntington. La sclérose latérale amyotrophique entraîne une perte de mouvement causée par la dégradation des motoneurones et implique également des défauts du cytosquelette.
Les protéines accessoires, y compris les protéines motrices, régulent et relient les filaments à d'autres composés cellulaires et entre eux et sont essentielles pour l'assemblage contrôlé des filaments du cytosquelette dans des emplacements particuliers.
Un certain nombre de médicaments cytosquelettiques à petites molécules ont été découverts qui interagissent avec l'actine et les microtubules. Ces composés se sont avérés utiles dans l'étude du cytosquelette, et plusieurs ont des applications cliniques.
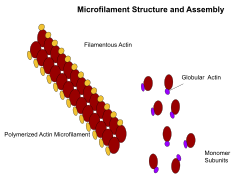
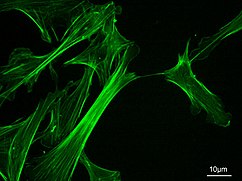
Microfilaments
Les microfilaments, également connus sous le nom de filaments d'actine, sont composés de polymères linéaires de protéines G-actine et génèrent de la force lorsque l'extrémité en croissance (plus) du filament pousse contre une barrière, telle que la membrane cellulaire. Ils agissent également comme des pistes pour le mouvement des molécules de myosine qui se fixent au microfilament et « marchent » le long d'eux. En général, le principal composant ou protéine des microfilaments est l'actine. Le monomère G-actine se combine pour former un polymère qui continue à former le microfilament (filament d'actine). Ces sous-unités s'assemblent ensuite en deux chaînes qui s'entrelacent dans ce qu'on appelle les chaînes F-actine . Le déplacement de la myosine le long des filaments d'actine F génère des forces contractiles dans les fibres dites d'actomyosine, à la fois dans les muscles et dans la plupart des types de cellules non musculaires. Les structures de l'actine sont contrôlées par la famille Rho de petites protéines de liaison au GTP telles que Rho elle-même pour les filaments contractiles d'acto-myosine (« fibres de stress »), Rac pour les lamellipodes et Cdc42 pour les filopodes.
Les fonctions incluent :
- Contraction musculaire
- Mouvement cellulaire
- Transport/trafic intracellulaire
- Maintien de la forme des cellules eucaryotes
- Cytokinèse
- Diffusion cytoplasmique
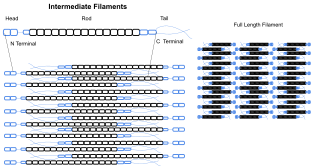
Filaments intermédiaires
Les filaments intermédiaires font partie du cytosquelette de nombreuses cellules eucaryotes . Ces filaments, d'un diamètre moyen de 10 nanomètres, sont plus stables (fortement liés) que les microfilaments, et constituent des constituants hétérogènes du cytosquelette. Comme les filaments d' actine , ils fonctionnent dans le maintien de la forme cellulaire en supportant la tension (les microtubules , en revanche, résistent à la compression mais peuvent également supporter la tension lors de la mitose et lors du positionnement du centrosome). Les filaments intermédiaires organisent la structure tridimensionnelle interne de la cellule, ancrant les organites et servent de composants structurels de la lame nucléaire . Ils participent également à certaines jonctions cellule-cellule et cellule-matrice. La lame nucléaire existe chez tous les animaux et tous les tissus. Certains animaux comme la mouche des fruits n'ont pas de filaments intermédiaires cytoplasmiques. Chez les animaux qui expriment des filaments intermédiaires cytoplasmiques, ceux-ci sont spécifiques d'un tissu. Les filaments intermédiaires de kératine dans les cellules épithéliales offrent une protection contre les différents stress mécaniques que la peau peut subir. Ils protègent également les organes contre les stress métaboliques, oxydatifs et chimiques. Le renforcement des cellules épithéliales avec ces filaments intermédiaires peut empêcher l'apparition de l' apoptose , ou la mort cellulaire, en réduisant la probabilité de stress.
Les filaments intermédiaires sont le plus souvent connus sous le nom de système de support ou « échafaudage » pour la cellule et le noyau, tout en jouant également un rôle dans certaines fonctions cellulaires. En combinaison avec des protéines et des desmosomes , les filaments intermédiaires forment des connexions cellule-cellule et ancrent les jonctions cellule-matrice qui sont utilisées dans la messagerie entre les cellules ainsi que dans les fonctions vitales de la cellule. Ces connexions permettent à la cellule de communiquer à travers le desmosome de plusieurs cellules pour ajuster les structures du tissu en fonction des signaux de l'environnement cellulaire. Il a été démontré que les mutations des protéines IF causaient de graves problèmes médicaux tels que le vieillissement prématuré, les mutations de la desmine compromettant les organes, la maladie d'Alexander et la dystrophie musculaire .
Les différents filaments intermédiaires sont :
- à base de vimentines . Les filaments intermédiaires de la vimentine sont en général présents dans les cellules mésenchymateuses.
- fait de kératine . La kératine est présente en général dans les cellules épithéliales.
- neurofilaments des cellules neurales.
- fait de lamin , donnant un support structurel à l'enveloppe nucléaire.
- composé de desmine , joue un rôle important dans le soutien structurel et mécanique des cellules musculaires.
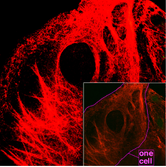
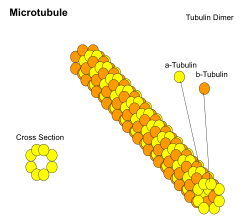
Microtubules
Les microtubules sont des cylindres creux d'environ 23 nm de diamètre (diamètre de la lumière d'environ 15 nm), comprenant le plus souvent 13 protofilaments qui, à leur tour, sont des polymères d'alpha et de bêta tubuline . Ils ont un comportement très dynamique, liant le GTP pour la polymérisation. Ils sont généralement organisés par le centrosome .
En neuf ensembles de triplets (en forme d'étoile), ils forment les centrioles , et en neuf doublets orientés autour de deux microtubules supplémentaires (en forme de roue), ils forment des cils et des flagelles. Cette dernière formation est communément appelée un arrangement "9+2", dans lequel chaque doublet est connecté à un autre par la protéine dynéine . Comme les flagelles et les cils sont des composants structurels de la cellule et sont maintenus par des microtubules, ils peuvent être considérés comme faisant partie du cytosquelette. Il existe deux types de cils : les cils mobiles et les cils non mobiles. Les cils sont courts et plus nombreux que les flagelles. Les cils mobiles ont un mouvement d'ondulation ou de battement rythmique par rapport aux cils non mobiles qui reçoivent des informations sensorielles pour la cellule ; traiter les signaux des autres cellules ou des fluides qui l'entourent. De plus, les microtubules contrôlent le battement (mouvement) des cils et des flagelles. De plus, les bras de dynéine attachés aux microtubules fonctionnent comme des moteurs moléculaires. Le mouvement des cils et des flagelles est créé par le glissement des microtubules les uns sur les autres, ce qui nécessite de l'ATP. Ils jouent un rôle clé dans :
- le transport intracellulaire (associés aux dynéines et aux kinésines , ils transportent des organites comme des mitochondries ou des vésicules ).
-
l' axonème des cils et des flagelles .
- le fuseau mitotique .
- synthèse de la paroi cellulaire des plantes.
En plus des rôles décrits ci-dessus, Stuart Hameroff et Roger Penrose ont proposé que les microtubules fonctionnent dans la conscience.
Comparaison
Type de cytosquelette |
Diamètre ( nm ) |
Structure | Exemples de sous-unités |
|---|---|---|---|
| Microfilaments | 6 | Double hélice | Actine |
|
Filaments intermédiaires |
dix | Deux hélices /dimères antiparallèles, formant des tétramères |
|
| Microtubules | 23 | Les protofilaments , à leur tour constitués de sous - unités de tubuline en complexe avec la stathmine | α- et -tubuline |
Septins
Les septines sont un groupe de protéines de liaison au GTP hautement conservées que l' on trouve chez les eucaryotes . Différentes septines forment des complexes protéiques les unes avec les autres. Ceux-ci peuvent s'assembler en filaments et en anneaux. Par conséquent, les septines peuvent être considérées comme faisant partie du cytosquelette. La fonction des septines dans les cellules consiste notamment à servir de site de fixation localisé pour d'autres protéines et à empêcher la diffusion de certaines molécules d'un compartiment cellulaire à un autre. Dans les cellules de levure, ils construisent un échafaudage pour fournir un support structurel pendant la division cellulaire et compartimenter des parties de la cellule. Des recherches récentes sur des cellules humaines suggèrent que les septines construisent des cages autour des agents pathogènes bactériens, immobilisant les microbes nocifs et les empêchant d'envahir d'autres cellules.
Spectrine
La spectrine est une protéine du cytosquelette qui tapisse le côté intracellulaire de la membrane plasmique des cellules eucaryotes. Spectrine forme des arrangements pentagonaux ou hexagonaux, formant un échafaudage et jouant un rôle important dans le maintien de l' intégrité de la membrane plasmique et de la structure du cytosquelette.
Cytosquelette de levure
Dans la levure bourgeonnante (un organisme modèle important ), l' actine forme des plaques corticales, des câbles d'actine, un anneau cytocinétique et le capuchon. Les patchs corticaux sont des corps d'actine discrets sur la membrane et sont essentiels pour l' endocytose , en particulier le recyclage de la glucane synthase qui est importante pour la synthèse de la paroi cellulaire . Les câbles d'actine sont des faisceaux de filaments d' actine et sont impliqués dans le transport des vésicules vers la coiffe (qui contient un certain nombre de protéines différentes pour polariser la croissance cellulaire) et dans le positionnement des mitochondries. L' anneau cytocinétique se forme et se resserre autour du site de division cellulaire .
Cytosquelette procaryote
Avant les travaux de Jones et al., 2001, la paroi cellulaire était considérée comme le facteur décisif pour de nombreuses formes de cellules bactériennes, y compris les bâtonnets et les spirales. Lors de l'étude, de nombreuses bactéries difformes se sont avérées avoir des mutations liées au développement d'une enveloppe cellulaire . Le cytosquelette était autrefois considéré comme une caractéristique uniquement des cellules eucaryotes , mais des homologues de toutes les principales protéines du cytosquelette eucaryote ont été trouvés chez les procaryotes . Harold Erickson note qu'avant 1992, seuls les eucaryotes étaient censés avoir des composants du cytosquelette. Cependant, des recherches au début des années 90 ont suggéré que les bactéries et les archées avaient des homologues de l'actine et de la tubuline, et que ceux-ci étaient à la base des microtubules et des microfilaments eucaryotes. Bien que les relations évolutives soient si éloignées qu'elles ne soient pas évidentes à partir des seules comparaisons de séquences de protéines, la similitude de leurs structures tridimensionnelles et de leurs fonctions similaires dans le maintien de la forme et de la polarité des cellules fournit des preuves solides que les cytosquelettes eucaryotes et procaryotes sont vraiment homologues. Trois laboratoires ont indépendamment découvert que FtsZ, une protéine déjà connue comme un acteur clé de la cytokinèse bactérienne, avait la « séquence de signature de la tubuline » présente dans toutes les -, β- et -tubulines. Cependant, certaines structures du cytosquelette bactérien n'ont peut-être pas encore été identifiées.
FtsZ
FtsZ a été la première protéine du cytosquelette procaryote à être identifiée. Comme la tubuline, FtsZ forme des filaments en présence de guanosine triphosphate (GTP), mais ces filaments ne se regroupent pas en tubules. Au cours de la division cellulaire , FtsZ est la première protéine à se déplacer vers le site de division et est essentielle pour recruter d'autres protéines qui synthétisent la nouvelle paroi cellulaire entre les cellules en division.
MreB et ParM
Les protéines de type actine procaryote, telles que MreB , sont impliquées dans le maintien de la forme des cellules. Toutes les bactéries non sphériques ont des gènes codant pour des protéines de type actine, et ces protéines forment un réseau hélicoïdal sous la membrane cellulaire qui guide les protéines impliquées dans la biosynthèse de la paroi cellulaire .
Certains plasmides codent pour un système séparé qui implique une protéine de type actine ParM . Les filaments de ParM présentent une instabilité dynamique et peuvent diviser l'ADN plasmidique dans les cellules filles en division par un mécanisme analogue à celui utilisé par les microtubules pendant la mitose eucaryote .
croissant
La bactérie Caulobacter crescentus contient une troisième protéine, la crescentine , qui est liée aux filaments intermédiaires des cellules eucaryotes. La crescentine est également impliquée dans le maintien de la forme des cellules, telles que les formes hélicoïdales et vibrioïdes des bactéries, mais le mécanisme par lequel elle le fait n'est actuellement pas clair. De plus, la courbure pourrait être décrite par le déplacement de filaments en croissant, après la perturbation de la synthèse du peptidoglycane.
Caractéristiques communes et différences entre les procaryotes et les eucaryotes
Par définition, le cytosquelette est composé de protéines qui peuvent former des réseaux longitudinaux (fibres) dans tous les organismes. Ces protéines filamenteuses ont été classées en 4 classes. Tubuline- like, actine- like, Walker A cytosqueletal ATPases (WACA-protéines) et filaments intermédiaires .
Les protéines de type tubuline sont la tubuline chez les eucaryotes et FtsZ , TubZ, RepX chez les procaryotes. Les protéines de type actine sont l' actine chez les eucaryotes et MreB , FtsA chez les procaryotes. Un exemple de protéines WACA, que l'on trouve principalement chez les procaryotes, est MinD . Des exemples de filaments intermédiaires, qui ont été trouvés presque exclusivement chez les animaux (c'est-à-dire les eucaryotes) sont les lamines , les kératines , la vimentine , les neurofilaments et la desmine .
Bien que les protéines de type tubuline partagent une certaine similitude de séquence d'acides aminés , leur équivalence dans le pli protéique et la similitude dans le site de liaison du GTP est plus frappante. Il en va de même pour les protéines de type actine et leur structure et domaine de liaison à l' ATP .
Les protéines du cytosquelette sont généralement corrélées à la forme cellulaire, à la ségrégation de l'ADN et à la division cellulaire chez les procaryotes et les eucaryotes. Quelles protéines remplissent quelle tâche est très différente. Par exemple, la ségrégation de l'ADN chez tous les eucaryotes se produit grâce à l'utilisation de tubuline, mais chez les procaryotes, des protéines WACA, des protéines de type actine ou de type tubuline peuvent être utilisées. La division cellulaire est médiée chez les eucaryotes par l'actine, mais chez les procaryotes, généralement par des protéines de type tubuline (souvent à anneau FtsZ) et parfois ( Crenarchaeota ) ESCRT-III , qui chez les eucaryotes a toujours un rôle dans la dernière étape de la division.
Diffusion cytoplasmique
Le flux cytoplasmique , également connu sous le nom de cyclose, est le mouvement actif du contenu d'une cellule le long des composants du cytosquelette. Bien que principalement observés dans les plantes, tous les types de cellules utilisent ce processus pour le transport des déchets, des nutriments et des organites vers d'autres parties de la cellule. Les cellules des plantes et des algues sont généralement plus grosses que de nombreuses autres cellules; le flux cytoplasmique est donc important dans ces types de cellules. En effet, le volume supplémentaire de la cellule nécessite un flux cytoplasmique afin de déplacer les organites dans toute la cellule. Les organites se déplacent le long des microfilaments du cytosquelette entraînés par des moteurs de myosine se liant et poussant le long des faisceaux de filaments d' actine .
Voir également
Les références
Liens externes
- Actualités et blogs mensuels sur le cytosquelette
- MBInfo - Dynamique du cytosquelette
- Cytosquelette, motilité cellulaire et moteurs - La bibliothèque virtuelle de biochimie, biologie moléculaire et biologie cellulaire
- Base de données du cytosquelette, essais cliniques, littérature récente, registre de laboratoire...
- Animation de l'adhésion des leucocytes (Animation avec quelques images de l'assemblage et de la dynamique de l'actine et des microtubules.)
- http://cellix.imba.oeaw.ac.at/ Cytosquelette et motilité cellulaire, y compris des vidéos
- Article de synthèse en libre accès sur la complexité émergente du cytosquelette (paru dans Advances in Physics , 2013)