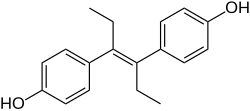
Diéthylstilbestrol - Diethylstilbestrol
Le diéthylstilbestrol ( DES ), également connu sous le nom de stilbestrol ou stilboestrol , est un médicament à base d'œstrogènes non stéroïdiens , qui est actuellement rarement utilisé. Dans le passé, il était largement utilisé pour une variété d'indications, y compris le soutien à la grossesse pour les femmes ayant des antécédents de fausses couches à répétition , l' hormonothérapie pour les symptômes de la ménopause et la carence en œstrogènes chez les femmes, le traitement du cancer de la prostate chez l'homme et du cancer du sein chez la femme, et autres utilisations. En 2007, il n'était utilisé que dans le traitement du cancer de la prostate et du cancer du sein. En 2011, Hoover et ses collègues ont signalé des effets indésirables sur la santé liés au DES, notamment l' infertilité , les fausses couches , les grossesses extra-utérines , la prééclampsie , les naissances prématurées , les mortinaissances , la mort infantile , la ménopause avant 45 ans, le cancer du sein, le cancer du col de l'utérus et le cancer vaginal . En 2020 les sites GoodRx et Walgreens ne répertorient pas le diéthylstilbestrol. Bien qu'il soit le plus souvent pris par voie orale , le DES était disponible pour une utilisation par d'autres voies également, par exemple, par voie vaginale , topique et par injection .
Le DES est un œstrogène , ou un agoniste des récepteurs des œstrogènes , la cible biologique des œstrogènes comme l' œstradiol . C'est un œstrogène synthétique et non stéroïdien du groupe stilbestrol , et diffère de l' œstrogène naturel estradiol de diverses manières. Par rapport à l'estradiol, le DES a considérablement amélioré la biodisponibilité lorsqu'il est pris par voie orale, est plus résistant au métabolisme et présente des effets relativement accrus dans certaines parties du corps comme le foie et l' utérus . Ces différences font que le DES présente un risque accru de caillots sanguins , de problèmes cardiovasculaires et de certains autres effets indésirables.
Le DES a été découvert en 1938 et introduit à des fins médicales en 1939. De 1940 à 1971 environ, le médicament a été administré aux femmes enceintes en croyant à tort qu'il réduirait le risque de complications et de pertes de grossesse. En 1971, il a été démontré que le DES causait un carcinome à cellules claires , une tumeur vaginale rare , chez les filles et les femmes qui avaient été exposées à ce médicament in utero . La Food and Drug Administration des États-Unis a par la suite retiré l'approbation du DES comme traitement pour les femmes enceintes. Des études de suivi ont indiqué que le DES a également le potentiel de causer une variété de complications médicales indésirables importantes au cours de la vie des personnes exposées.
Le National Cancer Institute des États-Unis recommande aux femmes nées de mères ayant pris du DES de subir régulièrement des examens médicaux spéciaux afin de dépister les complications dues au médicament. Les personnes qui ont été exposées au DES pendant la grossesse de leurs mères sont communément appelées « filles du DES » et « fils du DES ». Depuis la découverte des effets toxiques du DES, il a été en grande partie abandonné et n'est maintenant pour la plupart plus commercialisé.
Utilisations médicales
DES a été utilisé dans le passé pour les indications suivantes :
- Fausse couche à répétition pendant la grossesse
- Hormonothérapie ménopausique pour le traitement des symptômes de la ménopause tels que les bouffées de chaleur et l'atrophie vaginale
- Hormonothérapie pour l' hypoestrogénie (p. ex., dysgénésie gonadique , insuffisance ovarienne prématurée et après ovariectomie )
- Suppression de la lactation post-partum pour prévenir ou inverser l'engorgement mammaire
- Vaginite gonorrhéique (arrêtée après l'introduction de l' antibiotique pénicilline )
- Cancer de la prostate et cancer du sein
- Prévention de la grande taille chez les adolescentes de grande taille
- Traitement de l' acné chez les filles et les femmes
- Comme contraceptif post-coïtal d'urgence
- Comme moyen de castration chimique pour l' hypersexualité et les paraphilies chez les hommes et les délinquants sexuels
- Prévention de la poussée de testostérone au début du traitement par agoniste de la gonadolibérine (agoniste de la GnRH)
- L'hormonothérapie féminisante pour les femmes transgenres
Le DES a été utilisé à une dose de 0,2 à 0,5 mg/jour dans l' hormonothérapie de la ménopause .
L'intérêt pour l'utilisation du DES pour traiter le cancer de la prostate chez les hommes se poursuit aujourd'hui. Cependant, l'utilisation d' œstrogènes parentéraux bio - identiques comme le phosphate de polyestradiol a été préconisée en faveur des œstrogènes synthétiques oraux comme le DES en raison de leur risque beaucoup plus faible de toxicité cardiovasculaire. En plus du cancer de la prostate, un certain intérêt pour l'utilisation du DES pour traiter le cancer du sein chez les femmes se poursuit aujourd'hui également. Cependant, comme dans le cas du cancer de la prostate, des arguments ont été avancés pour l'utilisation d'œstrogènes bio-identiques comme l' œstradiol au lieu du DES pour le cancer du sein.
Le DES par voie orale à raison de 0,25 à 0,5 mg/jour est efficace dans le traitement des bouffées de chaleur chez les hommes recevant un traitement de privation androgénique pour un cancer de la prostate.
Effets secondaires
À plus de 1 mg/jour, le DES est associé à des taux élevés d' effets secondaires, notamment des nausées , des vomissements , une gêne abdominale , des maux de tête et des ballonnements (incidence de 15 à 50 %).
Changements mammaires et féminisation
La pigmentation des aréoles mammaires est souvent très foncée et presque noire avec la thérapie DES. La pigmentation qui se produit avec les œstrogènes synthétiques tels que le DES est beaucoup plus importante qu'avec les œstrogènes naturels tels que l' œstradiol . Le mécanisme de la différence est inconnu. Il a été rapporté que des progestatifs comme le caproate d'hydroxyprogestérone réduisent l'hyperpigmentation des mamelons induite par un traitement œstrogénique à haute dose.
Chez les hommes traités pour un cancer de la prostate, le DES s'est avéré produire des taux élevés de gynécomastie (développement du sein) de 41 à 77%.
Caillots sanguins et problèmes cardiovasculaires
Dans les études sur le DES en tant que forme d' œstrogène à dose élevée pour les hommes atteints d' un cancer de la prostate , il a été associé à une morbidité et une mortalité cardiovasculaires considérables . Le risque est dose-dépendant. Une dose de 5 mg/jour de DES a été associée à une augmentation de 36 % des décès non liés au cancer (principalement cardiovasculaires). De plus, il existe une incidence allant jusqu'à 15 % de thromboembolie veineuse . Une dose de 3 mg/jour de DES a été associée à une incidence de thromboembolie de 9,6 à 17 %, avec une incidence de complications cardiovasculaires de 33,3 %. Une posologie plus faible de 1 mg/jour de DES a été associée à un taux de décès dus à des événements cardiovasculaires de 14,8 % (contre 8,3 % pour l' orchidectomie seule).
Autres effets à long terme
Le DES a été associé à une variété d'effets indésirables à long terme, tels qu'un risque accru de
- adénocarcinome vaginal à cellules claires
- adénose vaginale
- Utérus en forme de T
- fibromes utérins
- faiblesse cervicale
- cancer du sein
- infertilité
- hypogonadisme
- anomalies gestationnelles intersexuelles
- dépression ,
- et d'autres,
chez les femmes qui en ont été traitées pendant la grossesse et/ou chez leur progéniture.
Une étude animale complète en 1993 a révélé une pléthore d' effets indésirables du DES tels que (mais sans s'y limiter)
- génotoxicité (due au métabolite de la quinone )
- tératogénicité
- hypoplasie pénienne et testiculaire
- cryptorchidie (chez le rat et le singe rhésus ),
- cancer du foie et du rein (chez le hamster ), carcinome papillaire de l' ovaire (chez le chien ) et
- malin utérin mésothéliome (en singes écureuil ). Des preuves ont également été trouvées liant le TDAH aux générations F2, démontrant qu'il existe au moins des effets neurologiques et transgénérationnels en plus des effets cancérigènes.
Des études sur des rongeurs révèlent des cancers de l'appareil reproducteur féminin et des anomalies atteignant la génération F2 , et il existe des preuves d'effets indésirables tels que des cycles menstruels irréguliers intersexuels chez les petits-enfants de mères DES. De plus, des preuves indiquent également des effets transgénérationnels chez les fils F2, tels que l' hypospadias . À l'heure actuelle, cependant, l'étendue des effets transgénérationnels du DES chez l'homme n'est pas entièrement comprise.
Surdosage
Le DES a été évalué dans le passé dans des études cliniques à des doses extrêmement élevées allant jusqu'à 1 500 à 5 000 mg/jour.
Pharmacologie
Pharmacodynamique
Activité oestrogénique
Le DES est un œstrogène ; en particulier, il s'agit d'un agoniste complet très puissant des deux récepteurs des œstrogènes (ER). Il possède environ 468 % et 295 % de l' affinité de l' œstradiol au niveau du REα et du REβ , respectivement. Cependant, des valeurs EC 50 de 0,18 nM et 0,06 nM de DES pour le REα et le REβ, respectivement, ont été rapportées, suggérant, malgré son affinité de liaison pour les deux récepteurs, une préférence multiple pour l'activation du REβ par rapport au REα . En plus des RE nucléaires, le DES est un agoniste du récepteur des œstrogènes couplé aux protéines G (GPER), bien qu'avec une affinité relativement faible (~ 1 000 nM). Le DES produit tous les mêmes effets biologiques attribués aux œstrogènes naturels comme l'œstradiol. Cela comprend les effets sur l' utérus , le vagin , les glandes mammaires , l' hypophyse et d'autres tissus .
Une dose de 1 mg/jour de DES est approximativement équivalente à une dose de 50 µg/jour d'éthinylestradiol en termes de puissance œstrogénique systémique. À l' instar de l' éthinylestradiol , le DES montre un effet marqué et disproportionné sur la synthèse des protéines hépatiques . Alors que sa puissance œstrogénique systémique était environ 3,8 fois celle de l' estropipate (sulfate de pipérazine estrone), qui a une puissance similaire à l' estradiol micronisé , la puissance œstrogénique hépatique du DES était 28 fois celle de l'estropipate (ou environ 7,5 fois plus forte pour une dose ayant un effet œstrogénique systémique équivalent).
Le DES possède au moins trois mécanismes d'action dans le traitement du cancer de la prostate chez l'homme. Il supprime la production d'androgènes gonadiques et donc les niveaux d'androgènes circulants en raison de ses effets antigonadotropes ; il stimule la production de globuline liant les hormones sexuelles hépatiques (SHBG), augmentant ainsi les taux circulants de SHBG et diminuant la fraction libre de testostérone et de dihydrotestostérone (DHT) dans la circulation ; et il peut avoir des effets cytotoxiques directs dans les testicules et la prostate . Le DES a également été trouvé pour diminuer la synthèse d'ADN à des doses élevées.
Le DES est un œstrogène à action prolongée, avec une rétention nucléaire d'environ 24 heures.
| Oestrogène | HF | VE | UCa | FSH | LH | HDL - C | SHBG | CBG | AGT | Le foie |
|---|---|---|---|---|---|---|---|---|---|---|
| Estradiol | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 |
| Estrone | ? | ? | ? | 0,3 | 0,3 | ? | ? | ? | ? | ? |
| Estriol | 0,3 | 0,3 | 0,1 | 0,3 | 0,3 | 0,2 | ? | ? | ? | 0,67 |
| Sulfate d'estrone | ? | 0,9 | 0,9 | 0,8–0,9 | 0,9 | 0,5 | 0,9 | 0,5-0,7 | 1,4–1,5 | 0,56–1,7 |
| eststrogènes conjugués | 1.2 | 1.5 | 2.0 | 1.1–1.3 | 1,0 | 1.5 | 3.0–3.2 | 1,3–1,5 | 5.0 | 1,3–4,5 |
| Sulfate d'équiline | ? | ? | 1,0 | ? | ? | 6.0 | 7.5 | 6.0 | 7.5 | ? |
| Ethinylestradiol | 120 | 150 | 400 | 60-150 | 100 | 400 | 500–600 | 500–600 | 350 | 2,9–5,0 |
| Diéthylstilbestrol | ? | ? | ? | 2,9–3,4 | ? | ? | 26–28 | 25-37 | 20 | 5.7–7.5 |
|
Sources et notes de bas de page
Remarques : Les valeurs sont des rapports, avec l'œstradiol comme standard (c'est-à-dire 1,0). Abréviations : HF = Soulagement clinique des bouffées de chaleur . VE = Augmentation de la prolifération de l'épithélium vaginal . UCa = Diminution de UCa . FSH = Suppression des niveaux de FSH . LH = Suppression des niveaux de LH . HDL - C , SHBG , CBG et AGT = Augmentation des taux sériques de ces protéines hépatiques . Foie = Rapport des effets œstrogéniques sur le foie aux effets œstrogéniques généraux/systémiques (bouffées de chaleur/ gonadotrophines ). Sources : voir modèle.
|
||||||||||
| Composé | Dosage pour des utilisations spécifiques (mg généralement) | ||||||
|---|---|---|---|---|---|---|---|
| ETD | DEP | MSD | MSD | OID | TSD | ||
| Estradiol (non micron.) | 30 | 120–300 | 120 | 6 | - | - | |
| Estradiol (micronisé) | 6–12 | 60–80 | 14–42 | 1–2 | >5 | >8 | |
| valérate d'estradiol | 6–12 | 60–80 | 14–42 | 1–2 | - | >8 | |
| benzoate d'estradiol | - | 60-140 | - | - | - | - | |
| Estriol | 20 | 120-150 | 28–126 | 1–6 | >5 | - | |
| Succinate d'estriol | - | 140-150 | 28–126 | 2–6 | - | - | |
| Sulfate d'estrone | 12 | 60 | 42 | 2 | - | - | |
| eststrogènes conjugués | 5–12 | 60–80 | 8.4–25 | 0,625-1,25 | > 3.75 | 7.5 | |
| Ethinylestradiol | 200 g | 1–2 | 280 g | 20-40 g | 100 g | 100 g | |
| Mestranol | 300 g | 1,5–3,0 | 300–600 g | 25-30 g | >80 g | - | |
| Quinestrol | 300 g | 2-4 | 500 g | 25–50 g | - | - | |
| Méthylestradiol | - | 2 | - | - | - | - | |
| Diéthylstilbestrol | 2.5 | 20-30 | 11 | 0,5–2,0 | >5 | 3 | |
| DES dipropionate | - | 15-30 | - | - | - | - | |
| Diénestrol | 5 | 30-40 | 42 | 0,5–4,0 | - | - | |
| Diacétate de diènestrol | 3–5 | 30–60 | - | - | - | - | |
| Hexestrol | - | 70-110 | - | - | - | - | |
| Chlorotrianisène | - | >100 | - | - | >48 | - | |
| méthalènestril | - | 400 | - | - | - | - | |
|
Sources et notes de bas de page :
|
|||||||
| Oestrogène | Former | Marque(s) principale(s) | DEP (14 jours) | Durée | |
|---|---|---|---|---|---|
| Diéthylstilbestrol (DES) | Solution d'huile | Metestrol | 20 mg | 1 mg ≈ 2-3 jours ; 3 mg ≈ 3 jours | |
| Dipropionate de diéthylstilbestrol | Solution d'huile | Cyrène B | 12,5-15 mg | 2,5 mg ≈ 5 jours | |
| Suspension aqueuse | ? | 5 mg | ? mg = 21 à 28 jours | ||
| Dimestrol ( DES diméthyl éther) | Solution d'huile | Dépôt-Cyren, Dépôt-Oestromon, Retalon Retard | 20-40 mg | ? | |
| Fosfestrol ( DES diphosphate) a | Solution aqueuse | Honvan | ? | <1 jour | |
| Diacétate de diènestrol | Suspension aqueuse | Farmacyrol-Kristallsuspension | 50 mg | ? | |
| Dipropionate d'hexestrol | Solution d'huile | Hormoestrol, Retalon Oleosum | 25 mg | ? | |
| Hexestrol diphosphate a | Solution aqueuse | Cytostéine, Pharmestrine, Retalon Aquosum | ? | Très court | |
| Remarque : Tous par injection intramusculaire, sauf indication contraire. Notes : a = Par injection intraveineuse . Sources : voir modèle. | |||||
Effets antigonadotropes


En raison de son activité oestrogénique, le DES a des effets antigonadotropes . C'est-à-dire qu'il exerce une rétroaction négative sur l' axe hypothalamo-hypophyso-gonadique ( axe HPG), supprime la sécrétion des gonadotrophines , de l'hormone lutéinisante (LH) et de l'hormone folliculo-stimulante (FSH), et supprime la production d' hormones sexuelles ainsi que les gamètes. production ou maturation dans les gonades . Une étude sur l' inhibition de l' ovulation chez les femmes a révélé que 5 mg/jour de DES par voie orale étaient efficaces à 92 %, l'ovulation se produisant au cours d'un seul cycle. Le DES supprime systématiquement les niveaux de testostérone chez les hommes dans la plage de castration (<50 ng/dL) en 1 à 2 semaines à des doses de 3 mg/jour et plus. Inversement, une dose de 1 mg/jour de DES est incapable de supprimer complètement les niveaux de testostérone dans la plage de castration chez les hommes, qui se stabilisent souvent juste au-dessus des niveaux de castration (> 50 ng/dL). Cependant, il a également été rapporté que 1 mg/jour de DES entraîne une suppression d'environ 50 % des niveaux de testostérone, bien qu'avec une grande variabilité interindividuelle . Il a été dit que des doses de DES inférieures à 1 mg/jour n'avaient aucun effet sur les niveaux de testostérone. Cependant, l'ajout d'une dose « extrêmement faible » de 0,1 mg/jour de DES à l'acétate de cyprotérone s'est avérée entraîner un effet antigonadotrope synergique et supprimer les niveaux de testostérone dans la plage de castration chez les hommes. Le DES à 3 mg/jour a une suppression de testostérone similaire à une dose de 300 mg/jour, ce qui suggère que la suppression des niveaux de testostérone est maximale de 3 mg/jour.
D'autres activités
En plus des RE, une étude in vitro a révélé que le DES possède également une activité, quoique relativement faible, sur une variété d'autres récepteurs d'hormones stéroïdes . Alors que l'étude a trouvé des valeurs EC 50 de 0,18 nM et 0,06 nM de DES pour l'ERα et l'ERβ, respectivement, le médicament a montré une activité glucocorticoïde significative à une concentration de 1 M qui dépassait celle de 0,1 nM de dexaméthasone , ainsi qu'un antagonisme significatif de la les récepteurs des androgènes , de la progestérone et des minéralocorticoïdes (75 %, 85 % et 50 % d'inhibition de la stimulation de contrôle positif, respectivement, le tout à une concentration de 1 M). Il a également montré une inhibition d'environ 25 % de l'activation de PPARγ et LXRα à une concentration de 10 µM. Les chercheurs ont déclaré qu'à leur connaissance ils ont été les premiers à rapporter de telles actions du DES et ont émis l'hypothèse que ces actions pourraient être impliquées dans les effets cliniques du DES, par exemple dans le cancer de la prostate (notamment dans lequel des taux particulièrement élevés de doses de DES sont employées). Cependant, ils ont également noté que l'importance des activités nécessite une étude plus approfondie dans des modèles animaux à des doses pharmacologiquement pertinentes.
Le DES a été identifié comme un antagoniste des trois isotypes des récepteurs liés aux œstrogènes (ERR), les ERRα , ERRβ et ERRγ . L'inhibition semi-maximale se produit à une concentration d'environ 1 M.
Pharmacocinétique
Le DES est bien absorbé par administration orale . Avec une dose orale de 1 mg/jour de DES, les taux plasmatiques de DES 20 heures après la dernière dose variaient entre 0,9 et 1,9 ng/mL (3,4 à 7,1 nmol/L). L'administration sublinguale de DES semble avoir à peu près la même puissance oestrogénique que le DES oral chez les femmes. Le DES intra-utérin a été étudié pour le traitement de l'hypoplasie utérine . On pense que le DES oral a environ 17 à 50 % de la puissance oestrogénique clinique du DES par injection.
La demi-vie de distribution du DES est de 80 minutes. Il n'a aucune affinité pour la SHBG ou la globuline liant les corticostéroïdes et n'est donc pas lié à ces protéines dans la circulation. La liaison aux protéines plasmatiques du DES est supérieure à 95 %.
L'hydroxylation des cycles aromatiques du DES et la conjugaison subséquente des chaînes latérales éthyle représentent 80 à 90 % du métabolisme du DES , tandis que l' oxydation représente les 10 à 20 % restants et est dominée par les réactions de conjugaison. La conjugaison du DES consiste en une glucuronidation , tandis que l' oxydation comprend une déshydrogénation en ( Z , Z )-dienestrol . Le médicament est également connu pour produire de la paroxypropione en tant que métabolite . Le DES produit des intermédiaires réactifs transitoires de type quinone qui causent des dommages cellulaires et génétiques , ce qui peut aider à expliquer les effets cancérogènes connus du DES chez l'homme. Cependant, d'autres recherches indiquent que les effets toxiques du DES peuvent simplement être dus à une suractivation des RE. Contrairement à l' œstradiol , les groupes hydroxyle du DES ne subissent pas d'oxydation en un équivalent de type œstrone .
La demi-vie d' élimination du DES est de 24 heures. Les métabolites du DES sont excrétés dans l' urine et les fèces .
Chimie
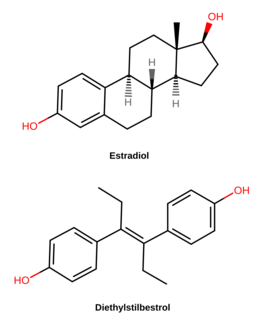
Le DES appartient au groupe de composés stilbestrol (4,4'-dihydroxy stilbène ). C'est un analogue non stéroïdien à anneau ouvert de l' œstrogène stéroïdien estradiol . Le DES peut être préparé à partir d' anéthole , qui se trouve également être faiblement œstrogénique. L'anéthole a été déméthylé pour former de l' anol et de l'anol, puis dimérisé spontanément en dianol et hexestrol , le DES étant ensuite synthétisé via une modification structurelle de l'hexestrol. Comme le montre la cristallographie aux rayons X , les dimensions moléculaires du DES sont presque identiques à celles de l'estradiol, en particulier en ce qui concerne la distance entre les groupes hydroxyles terminaux .
Histoire
Synthèse
Le DES a été synthétisé pour la première fois au début de 1938 par Leon Golberg, alors étudiant diplômé de Sir Robert Robinson au Dyson Perrins Laboratory de l' Université d'Oxford . La recherche de Golberg était basée sur les travaux de Wilfrid Lawson au Courtauld Institute of Biochemistry (dirigé par Sir Edward Charles Dodds à la Middlesex Hospital Medical School, qui fait maintenant partie de l' University College London ). Un rapport de sa synthèse a été publié dans Nature le 5 février 1938.
La recherche DES a été financée par le Medical Research Council (MRC) du Royaume-Uni , qui avait une politique contre le brevetage des médicaments découverts à l'aide de fonds publics. Parce qu'il n'était pas breveté, le DES a été produit par plus de 200 sociétés pharmaceutiques et chimiques dans le monde.
Utilisation clinique
DES a été commercialisé pour un usage médical en 1939. Il a été approuvé par les États-Unis Food and Drug Administration (FDA) le 19 Septembre 1941, sous forme de comprimés jusqu'à 5 mg pour quatre indications: gonorrheal vaginite , vaginite atrophique , la ménopause symptômes et suppression de la lactation post-partum pour prévenir l'engorgement mammaire. L'indication de vaginite gonorrhéique a été abandonnée lorsque l' antibiotique pénicilline est devenu disponible. Dès sa création, le médicament a été très controversé.
En 1941, Charles Huggins et Clarence Hodges de l' Université de Chicago ont découvert que le benzoate d'estradiol et le DES étaient les premiers médicaments efficaces pour le traitement du cancer de la prostate métastatique . Le DES a été le premier médicament anticancéreux.
Orchidectomie ou DES , ou les deux ont été le traitement initial standard pour le cancer de la prostate avancé symptomatique depuis plus de 40 ans, jusqu'à ce que l' agoniste de la GnRH leuproréline a été constaté une efficacité similaire à DES sans effets oestrogéniques et a été approuvé en 1985.
Depuis les années 1940 jusqu'à la fin des années 1980, le DES a été approuvé par la FDA comme thérapie de remplacement des œstrogènes pour les états de carence en œstrogènes tels que la dysgénésie ovarienne , l'insuffisance ovarienne prématurée et après une ovariectomie .
Dans les années 1940, le DES était utilisé hors indication pour prévenir les issues défavorables de la grossesse chez les femmes ayant des antécédents de fausse couche. Le 1er juillet 1947, la FDA a approuvé l'utilisation du DES pour cette indication. La première de ces autorisations a été accordée à Bristol-Myers Squibb , permettant l'utilisation de comprimés de 25 mg (et plus tard de 100 mg) de DES pendant la grossesse. Des approbations ont été accordées à d'autres sociétés pharmaceutiques plus tard dans la même année. Le régime recommandé a commencé à 5 mg par jour au cours des septième et huitième semaines de grossesse (à partir du premier jour des dernières règles), augmenté toutes les deux semaines de 5 mg par jour jusqu'à la 14e semaine, puis augmenté chaque semaine de 5 mg par jour. jour de 25 mg par jour la 15e semaine à 125 mg par jour la 35e semaine de grossesse. Le DES était à l'origine considéré comme efficace et sans danger pour la femme enceinte et le bébé en développement. Il a été commercialisé agressivement et systématiquement prescrit. Les ventes culminent en 1953.
Au début des années 1950, un essai clinique en double aveugle à l'Université de Chicago a évalué les résultats de la grossesse chez les femmes qui devaient recevoir ou ne pas recevoir de DES. L'étude n'a montré aucun avantage de la prise de DES pendant la grossesse ; les issues défavorables de la grossesse n'ont pas été réduites chez les femmes qui ont reçu du DES. À la fin des années 1960, six des sept principaux manuels d'obstétrique affirmaient que le DES était inefficace pour prévenir les fausses couches.
Malgré l'absence de preuves soutenant l'utilisation du DES pour prévenir les issues défavorables de la grossesse, le DES a continué d'être administré aux femmes enceintes jusqu'aux années 1960. En 1971, un rapport publié dans le New England Journal of Medicine montrait un lien probable entre le DES et l'adénocarcinome vaginal à cellules claires chez les filles et les jeunes femmes qui avaient été exposées à ce médicament in utero . Plus tard dans la même année, la FDA a envoyé un FDA Drug Bulletin à tous les médecins américains déconseillant l'utilisation du DES chez les femmes enceintes. La FDA a également supprimé la prévention des fausses couches en tant qu'indication pour l'utilisation du DES et a ajouté la grossesse en tant que contre-indication pour l'utilisation du DES. Le 5 février 1975, la FDA a ordonné le retrait des comprimés de DES à 25 mg et à 100 mg, à compter du 18 février 1975. Le nombre de personnes exposées au DES pendant la grossesse ou in utero au cours de la période de 1940 à 1971 est inconnu, mais peut être jusqu'à 2 millions aux États-Unis. DES a également été utilisé dans d'autres pays, notamment en France, aux Pays-Bas et en Grande-Bretagne.
Des années 1950 au début des années 1970, le DES a été prescrit aux filles prépubères pour commencer la puberté et ainsi arrêter la croissance en fermant les plaques de croissance dans les os. Malgré son lien évident avec le cancer, les médecins ont continué à recommander l'hormone pour « l'excès de taille ».
En 1960, le DES s'est avéré plus efficace que les androgènes dans le traitement du cancer du sein avancé chez les femmes ménopausées. Le DES était le traitement hormonal de choix pour le cancer du sein avancé chez les femmes ménopausées jusqu'en 1977, lorsque la FDA a approuvé le tamoxifène , un modulateur sélectif des récepteurs des œstrogènes avec une efficacité similaire au DES mais moins d'effets secondaires.
Plusieurs sources de la littérature médicale des années 1970 et 1980 indiquent que le DES était utilisé comme composante de l' hormonothérapie pour les femmes transgenres .
En 1973, dans une tentative de restreindre l'utilisation hors indication du DES comme contraceptif post - coïtal (qui était devenue courante dans de nombreux services de santé universitaires suite à la publication d'une étude influente en 1971 dans JAMA ) aux situations d'urgence telles que le viol, un FDA Drug Bulletin a été envoyé à tous les médecins et pharmaciens américains qui ont déclaré que la FDA avait approuvé, dans des conditions restreintes, l'utilisation contraceptive post-coïtale du DES.
En 1975, la FDA a déclaré qu'elle n'avait en fait donné (et n'avait jamais donné) d'approbation à aucun fabricant pour commercialiser le DES comme contraceptif post-coïtal, mais qu'elle approuverait cette indication pour les situations d'urgence telles que le viol ou l'inceste si un fabricant fournissait un étiquetage aux patients et emballage tel qu'énoncé dans une règle finale de la FDA publiée en 1975. Pour décourager l'utilisation hors AMM du DES comme contraceptif post-coïtal, la FDA en 1975 a retiré du marché les comprimés de DES de 25 mg et a ordonné l'étiquetage de doses plus faibles (5 mg et moins ) du DES toujours approuvé pour d'autres indications a été modifié pour indiquer : « Ce produit médicamenteux ne doit pas être utilisé comme contraceptif post-coïtal » en lettres majuscules sur la première ligne de la notice d'information du médecin et à un endroit bien en vue du contenant et étiquette de carton. Dans les années 1980, l'utilisation hors AMM du régime Yuzpe de certaines pilules contraceptives orales combinées régulières a remplacé l'utilisation hors AMM du DES comme contraceptif post-coïtal.
En 1978, la FDA a supprimé la suppression de la lactation post-partum pour éviter l'engorgement mammaire de ses indications approuvées pour le DES et d'autres œstrogènes. Dans les années 1990, les seules indications approuvées pour le DES étaient le traitement du cancer avancé de la prostate et le traitement du cancer du sein avancé chez les femmes ménopausées. Le dernier fabricant américain de DES, Eli Lilly , a cessé de le fabriquer et de le commercialiser en 1997.
Poursuites
Dans les années 1970, la publicité négative entourant la découverte des effets à long terme du DES a entraîné une énorme vague de poursuites aux États-Unis contre ses fabricants. Celles-ci ont abouti à une décision historique de 1980 de la Cour suprême de Californie , Sindell v. Abbott Laboratories , dans laquelle la cour a imposé une présomption réfutable de responsabilité de part de marché à tous les fabricants de DES, proportionnelle à leur part de marché au moment où le médicament a été consommée par la mère d'un plaignant en particulier.
Une action en justice a été déposée devant la Cour fédérale de Boston par 53 filles du DES qui affirment que leur cancer du sein est le résultat de la prescription du DES à leur mère alors qu'elles étaient enceintes. Leurs cas ont survécu à une audience Daubert . En 2013, les sœurs Fecho qui ont initié le litige du lien cancer du sein/DES ont accepté un montant de règlement non divulgué le deuxième jour du procès. Les autres plaideurs ont reçu divers règlements.
Le groupe de défense DES Action USA a aidé à fournir des informations et un soutien aux personnes exposées au DES et engagées dans des poursuites judiciaires.
Société et culture
Alan Turing , le cryptographe révolutionnaire, fondateur de l'informatique et des ordinateurs programmables, qui a également proposé le modèle théorique actuel de la morphogenèse biologique , a été contraint de prendre ce médicament pour induire une castration chimique en tant que "traitement" punitif du comportement homosexuel, peu de temps avant qu'il décédé dans des circonstances ambiguës.
James Herriot décrit un cas concernant le traitement d'une tumeur à cellules de Sertoli testiculaire d'un petit chien dans son livre de 1974 All Things Bright and Beautiful . Herriot a décidé de prescrire une dose élevée du nouveau médicament Stilboestrol pour la tumeur récurrente, avec l'effet secondaire amusant que le chien mâle est devenu "attirant pour les autres chiens mâles", qui ont suivi le terrier dans le village pendant quelques semaines. Herriot commente dans l'histoire qu'il savait que "le nouveau médicament aurait un effet féminisant, mais sûrement pas à ce point".
Usage vétérinaire
Incontinence canine
Le DES a été très efficace dans le traitement de l'incontinence canine féminine résultant d'un mauvais contrôle du sphincter. Il est toujours disponible dans les pharmacies de préparation et à la faible dose (1 mg), il n'a pas les propriétés cancérigènes qui étaient si problématiques chez l'homme. Il est généralement administré une fois par jour pendant sept à dix jours, puis une fois par semaine selon les besoins.
Promotion de la croissance du bétail
La plus grande utilisation du DES était dans l'industrie de l'élevage, utilisé pour améliorer la conversion alimentaire du bœuf et de la volaille. Au cours des années 1960, le DES a été utilisé comme hormone de croissance dans les industries du bœuf et de la volaille. Il s'est avéré plus tard qu'il causait le cancer en 1971, mais n'a été progressivement supprimé qu'en 1979. Bien que le DES ait été découvert comme étant nocif pour l'homme, son utilisation vétérinaire n'a pas été immédiatement arrêtée. En 2011, le DES était toujours utilisé comme stimulateur de croissance chez le bétail ou les poissons terrestres dans certaines parties du monde, dont la Chine.
Les références
Lectures complémentaires
- Johnston E (2017). "Sujets empoisonnés : écriture de vie des filles DES" . Frontières : Un Journal d'Études Féminines . Presse de l'Université du Nebraska . 38 (1) : 31-63. doi : 10.5250/fronjwomestud.38.1.0031 . JSTOR 10.5250/fronjwomestud.38.1.0031 . S2CID 152010855 .
Liens externes
- Diéthylstilbestrol (DES) et Cancer Institut national du cancer
- Mise à jour DES des Centers for Disease Control and Prevention des États-Unis
- DES Action USA, organisation nationale de consommateurs fournissant des informations complètes aux personnes exposées au DES
- Livrets DES des National Institutes of Health des États-Unis (vers 1980)
- Étude de suivi du DES Étude à long terme du National Cancer Institute sur les personnes exposées au DES (y compris le projet DES-AD)
- Registre DES de l'Université de Chicago des patients atteints d'ACC (adénocarcinome à cellules claires) du vagin et/ou du col de l'utérus
- DES Diéthylstilbestrol Fournit des ressources et des liens vers les médias sociaux pour une sensibilisation générale au DES