Éflornithine - Eflornithine
 | |
 | |
| Donnée clinique | |
|---|---|
| Appellations commerciales | Vaniqa, autres |
| Autres noms | α-difluorométhylornithine ou DFMO |
| AHFS / Drugs.com | Monographie |
| Données de licence | |
Catégorie grossesse |
|
| Voies d' administration |
intraveineux , topique |
| code ATC | |
| Statut légal | |
| Statut légal | |
| Données pharmacocinétiques | |
| Biodisponibilité | 100 % (intraveineuse) Négligeable (cutanée) |
| Métabolisme | Non métabolisé |
| Demi-vie d' élimination | 8 heures |
| Excrétion | Reins |
| Identifiants | |
| |
| Numero CAS | |
| CID PubChem | |
| IUPHAR/BPS | |
| Banque de médicaments | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| Tableau de bord CompTox ( EPA ) | |
| Données chimiques et physiques | |
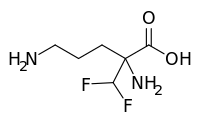
| Formule | C 6 H 12 F 2 N 2 O 2 |
| Masse molaire | 182,171 g·mol -1 |
| Modèle 3D ( JSmol ) | |
| |
| |
|
| |
L'éflornithine , vendue entre autres sous le nom de marque Vaniqa , est un médicament utilisé pour traiter la trypanosomose africaine (maladie du sommeil) et la pilosité excessive sur le visage chez les femmes. Plus précisément, il est utilisé pour le 2e stade de la maladie du sommeil causée par T. b. gambiense et peut être utilisé avec le nifurtimox . Il est utilisé par injection ou appliqué sur la peau.
Les effets secondaires courants lorsqu'ils sont appliqués sous forme de crème comprennent des éruptions cutanées, des rougeurs et des brûlures. Les effets secondaires de la forme injectable comprennent la suppression de la moelle osseuse , les vomissements et les convulsions . On ne sait pas s'il est sans danger pendant la grossesse ou l' allaitement . Il est généralement recommandé aux enfants de plus de 12 ans.
L'éflornithine a été développée dans les années 1970 et est entrée en usage médical en 1990. Elle a été ajoutée à la liste des médicaments essentiels de l' Organisation mondiale de la santé en 2009, les médicaments les plus sûrs et les plus efficaces nécessaires dans un système de santé . Il n'y a pas de version générique à partir de 2015 aux États-Unis. Aux États-Unis, la forme injectable peut être obtenue auprès des Centers for Disease Control and Prevention . Dans les régions du monde où la maladie est courante, l'éflornithine est fournie gratuitement par l' Organisation mondiale de la santé .
Utilisations médicales
Maladie du sommeil
La maladie du sommeil, ou trypanosomiase, est traitée avec de la pentamidine ou de la suramine (selon la sous-espèce de parasite) administrée par injection intramusculaire dans la première phase de la maladie, et par injection intraveineuse de mélarsoprol et d'éflornithine dans la deuxième phase de la maladie. L'éfornithine est généralement administrée en association avec le nifurtimox , ce qui réduit la durée du traitement à 7 jours de perfusions d'éflornithine plus 10 jours de comprimés oraux de nifurtimox.
L'éflornithine est également efficace en association avec d'autres médicaments, tels que le mélarsoprol et le nifurtimox. Une étude réalisée en 2005 a comparé l'innocuité de l'éflornithine seule au mélarsoprol et a trouvé que l'éflornithine était plus efficace et sûre dans le traitement de la maladie du sommeil de deuxième stade Trypanosoma brucei gambiense . L'éflornithine n'est pas efficace dans le traitement de Trypanosoma brucei rhodesiense en raison de la faible sensibilité du parasite au médicament. Au lieu de cela, le mélarsoprol est utilisé pour traiter Trypanosoma brucei rhodesiense . Un autre essai contrôlé randomisé en Ouganda a comparé l'efficacité de diverses combinaisons de ces médicaments et a constaté que la combinaison nifurtimox-éflornithine était le régime théorique de première intention le plus prometteur.
Un essai contrôlé randomisé a été mené au Congo, en Côte d'Ivoire, en République démocratique du Congo et en Ouganda pour déterminer si un régime intraveineux de 7 jours était aussi efficace que le régime standard de 14 jours pour les nouveaux cas et les cas récurrents. Les résultats ont montré que le régime raccourci était efficace dans les cas de rechute, mais était inférieur au régime standard pour les nouveaux cas de la maladie.
Le traitement combiné nifurtimox-éflornithine (NECT) est un schéma thérapeutique efficace pour le traitement de la trypanosomose africaine à gambiense de deuxième stade .
Résistance aux trypanosomes
Après son introduction sur le marché dans les années 1980, l'éflornithine a remplacé le mélarsoprol comme médicament de première intention contre la trypanosomose humaine africaine (THA) en raison de sa toxicité réduite pour l'hôte. Trypanosoma brucei résistant à l'éflornithine a été signalé dès le milieu des années 1980.
Le gène TbAAT6, conservé dans le génome des Trypanosomes, serait responsable du transporteur transmembranaire qui amène l'éflornithine dans la cellule. La perte de ce gène due à des mutations spécifiques provoque une résistance à l'éflornithine chez plusieurs trypanosomes. Si l'éflornithine est prescrite à un patient atteint de trypanosomose humaine africaine causée par un trypanosome qui contient un gène TbAAT6 muté ou inefficace, alors le médicament sera inefficace contre la maladie. La résistance à l'éflornithine a augmenté l'utilisation du mélarsoprol malgré sa toxicité, qui a été liée au décès de 5 % des patients receveurs de THA.
L'excès de pilosité faciale chez les femmes
La crème topique est indiquée pour le traitement de l' hirsutisme facial chez la femme. C'est le seul traitement topique sur ordonnance qui ralentit la croissance des poils du visage. Il est appliqué en couche mince deux fois par jour, un minimum de huit heures entre les applications. Dans les études cliniques avec Vaniqa, 81 % des femmes ont montré une amélioration clinique après douze mois de traitement. Des résultats positifs ont été observés après huit semaines. Cependant, l'arrêt de la crème a provoqué la repousse des cheveux aux niveaux de base dans les 8 semaines.
Le traitement Vaniqa réduit considérablement le fardeau psychologique de l'hirsutisme facial.
La chimiothérapie préventive
Il a été noté que l' ornithine décarboxylase (ODC) présente une activité élevée dans les cellules tumorales, favorisant la croissance et la division cellulaires, tandis que l'absence d'activité ODC conduit à l'épuisement de la putrescine, provoquant une altération de la synthèse d'ARN et d'ADN. En règle générale, les médicaments qui inhibent la croissance cellulaire sont considérés comme des candidats pour le traitement du cancer, de sorte que l'éflornithine était naturellement considérée comme ayant une utilité potentielle en tant qu'agent anticancéreux. En inhibant l'ODC, l'éflornithine inhibe la croissance cellulaire et la division des cellules cancéreuses et non cancéreuses.
Cependant, plusieurs essais cliniques ont montré des résultats mineurs. Il a été découvert que l'inhibition de l'ODC par l'éflornithine ne tue pas les cellules en prolifération, rendant l'éflornithine inefficace en tant qu'agent chimiothérapeutique. L'inhibition de la formation de polyamines par l'activité de l'ODC peut être améliorée par des moyens diététiques et bactériens car des concentrations élevées sont trouvées dans le fromage, la viande rouge et certaines bactéries intestinales, fournissant des réserves si l'ODC est inhibée. Bien que le rôle des polyamines dans la cancérogenèse ne soit pas encore clair, il a été soutenu que la synthèse des polyamines était davantage un agent causal qu'un effet associatif dans le cancer.
D'autres études ont suggéré que l'éflornithine peut encore aider dans une certaine chimioprévention en abaissant les niveaux de polyamine dans la muqueuse colorectale, avec des preuves précliniques supplémentaires disponibles pour l'application de l'éflornithine dans la carcinogenèse colorectale et cutanée. Cela a fait de l'éflornithine une thérapie chimiopréventive soutenue spécifiquement pour le cancer du côlon en association avec d'autres médicaments. Plusieurs études supplémentaires ont montré que l'éflornithine en combinaison avec d'autres composés diminue les concentrations cancérigènes d'éthylnitrosourée, de diméthylhydrazine, d'azoxyméthane, de méthylnitrosourée et d'hydroxybutylnitrosamine dans le cerveau, la moelle épinière, l'intestin, la glande mammaire et la vessie.
Contre-indications
Topique
L'utilisation topique est contre-indiquée chez les personnes hypersensibles à l'éflornithine ou à l'un des excipients.
Tout au long des essais cliniques, les données d'un nombre limité de grossesses exposées indiquent qu'il n'y a aucune preuve clinique que le traitement par Vaniqa affecte négativement les femmes enceintes ou les fœtus.
Par la bouche
Lorsqu'il est pris par voie orale, le rapport bénéfice/risque doit être évalué chez les personnes atteintes d'insuffisance rénale ou d'anomalies hématologiques préexistantes, ainsi que chez les personnes atteintes d'une insuffisance du nerf crânien. Des études adéquates et bien contrôlées avec l'éflornithine n'ont pas été réalisées concernant la grossesse chez l'homme. L'éflornithine ne doit être utilisée pendant la grossesse que si le bénéfice potentiel l'emporte sur le risque potentiel pour le fœtus. Cependant, étant donné que la trypanosomose africaine a un taux de mortalité élevé si elle n'est pas traitée, le traitement par l'éflornithine peut justifier tout risque potentiel pour le fœtus.
Effets secondaires
L'éflornithine n'est pas génotoxique; aucun effet inducteur de tumeur n'a été observé dans les études de cancérogénicité, y compris une étude de photocarcinogénicité. Aucun effet tératogène n'a été détecté.
Topique
La forme topique d'elflornithine est vendue sous le nom de marque Vaniqa. L'effet secondaire le plus fréquemment rapporté est l'acné (7-14%). D'autres effets indésirables fréquemment (> 1%) rapportés sont des problèmes de peau, tels que des réactions cutanées dues à des poils incarnés, une chute des cheveux, des sensations de brûlure, de picotement ou de picotement, une peau sèche, des démangeaisons, des rougeurs ou des éruptions cutanées.
Intraveineux
La forme posologique intraveineuse d'éflornithine est vendue sous le nom de marque Ornidyl. La plupart des effets secondaires liés à l'utilisation systémique par injection sont transitoires et réversibles en arrêtant le médicament ou en diminuant la dose. Des anomalies hématologiques sont fréquentes, allant de 10 à 55 %. Ces anomalies sont liées à la dose et sont généralement réversibles. On pense que la thrombocytopénie est due à un défaut de production plutôt qu'à une destruction périphérique. Des convulsions ont été observées chez environ 8 % des patients, mais peuvent être liées à l'état de la maladie plutôt qu'au médicament. Une perte auditive réversible est survenue chez 30 à 70 % des patients recevant un traitement à long terme (plus de 4 à 8 semaines de traitement ou une dose totale de > 300 grammes) ; l'audition des hautes fréquences est perdue en premier, suivie de l'audition des fréquences moyennes et basses. Étant donné que le traitement de la trypanosomose africaine est à court terme, il est peu probable que les patients souffrent de perte auditive.
Interactions
Topique
Aucune étude d'interaction avec la forme topique n'a été réalisée.
Mécanisme d'action
La description
L'éflornithine est un « inhibiteur suicide », se liant de manière irréversible à l' ornithine décarboxylase (ODC) et empêchant le substrat naturel ornithine d'accéder au site actif (Figure 1). Au sein du site actif de l'ODC, l'éflornithine subit une décarboxylation à l'aide du cofacteur pyridoxal 5'-phosphate (PLP). En raison de son groupe difluorométhyle supplémentaire par rapport à l'ornithine, l'éflornithine est capable de se lier à un résidu Cys-360 voisin, restant en permanence fixé dans le site actif.
Au cours de la réaction, le mécanisme de décarboxylation de l'éflornithine est analogue à celui de l'ornithine dans le site actif, où la transamination se produit avec le PLP suivie d'une décarboxylation. En cas de décarboxylation, les atomes de fluorure attachés au groupe méthyle supplémentaire tirent la charge négative résultante de la libération de dioxyde de carbone, provoquant la libération d'un ion fluorure. Dans le substrat naturel de l'ODC, l'anneau du PLP accepte les électrons qui résultent de la libération de CO 2 .
L' atome de fluorure restant attaché au groupe méthyle supplémentaire crée un carbone électrophile qui est attaqué par le groupe thiol voisin de Cys-360, permettant à l'éflornithine de rester définitivement attachée à l'enzyme après la libération du deuxième atome de fluorure et la transimination.
Preuve
Le mécanisme de réaction de Trypanosoma brucei ' ODC s avec ornithine a été caractérisé par spectroscopie UV-VIS, afin d'identifier des intermédiaires uniques qui se sont produits pendant la réaction. La méthode spécifique de spectroscopie à flux arrêté à plusieurs longueurs d'onde a utilisé la lumière monochromatique et la fluorescence pour identifier cinq intermédiaires spécifiques en raison de changements dans les mesures d'absorbance. Le nombre de renouvellement à l'état d'équilibre, k cat , de l'ODC a été calculé comme étant de 0,5 s -1 à 4 °C. A partir de cette caractérisation, l'étape limitante a été déterminée comme étant la libération du produit putrescine de la réaction de l'ODC avec l'ornithine. En étudiant le mécanisme de réaction hypothétique de l'éflornithine, les informations recueillies à partir de la cartographie des peptides radioactifs et de l'éflornithine, de la chromatographie liquide à haute pression et du séquençage des peptides en phase gazeuse suggèrent que Lys-69 et Cys-360 sont liés de manière covalente à l'éflornithine dans le site actif de T. brucei ODC. En utilisant la spectrométrie de masse par bombardement d'atomes rapides (FAB-MS), la conformation structurelle de l'éflornithine après son interaction avec l'ODC a été déterminée comme étant ( S )-((2-(1-pyrroline-methyl) cysteine, un adduit d'imine cyclique. Présence de ce produit particulier était étayée par la possibilité de réduire davantage le produit final en ( S )-((2-pyrrole) méthyl) cystéine en présence de NaBH 4 et d'oxyder le produit final en ( S )-((2-pyrrolidine ) méthyl) cystéine (Figure 2).
Site actif
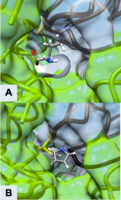
L'inhibition suicide de l'ODC par l'éflornithine bloque physiquement l'accès du substrat naturel ornithine au site actif de l'enzyme (Figure 3). Il existe deux sites actifs distincts formés par l' homodimérisation de l'ornithine décarboxylase. La taille de l'ouverture vers le site actif est d'environ 13,6 . Lorsque ces ouvertures vers le site actif sont bloquées, il n'y a aucun autre moyen par lequel l'ornithine peut entrer dans le site actif. Au stade intermédiaire de l'éflornithine avec le PLP, sa position à proximité de Cys-360 permet une interaction. Comme le phosphate de PLP est stabilisé par Arg 277 et une boucle riche en Gly (235-237), le groupe difluorométhyle de l'éflornithine est capable d'interagir et de rester fixé à la fois sur Cys-360 et PLP avant la transimination. Comme le montre la figure, l'anneau pyrroline interfère avec l'entrée de l'ornithine (figure 4). L'éflornithine restera liée en permanence dans cette position à Cys-360. Comme l'ODC a deux sites actifs, deux molécules d'éflornithine sont nécessaires pour inhiber complètement l'ODC de la décarboxylation de l'ornithine.
Figure 3
Site actif d'ODC formé par homodimérisation (structures de surface vertes et blanches) (A) Ornithine dans le site actif d'ODC, Cys-360 surligné en jaune (B) Produit de décarboxylation de l'éflornithine lié à Cys 360 (surligné en jaune). L'anneau pyrroline empêche l'ornithine d'entrer dans le site actif
Histoire
L'éflornithine a été initialement développée pour le traitement du cancer au Merrell Dow Research Institute à la fin des années 1970, mais s'est avérée inefficace dans le traitement des tumeurs malignes. Cependant, il s'est avéré très efficace pour réduire la pousse des cheveux, ainsi que dans le traitement de la trypanosomose africaine (maladie du sommeil), en particulier la forme ouest-africaine (Trypanosoma brucei gambiense).
Hirsutisme
Dans les années 1980, Gillette a obtenu un brevet pour la découverte que l'application topique de la crème eflornithine HCl inhibe la croissance des cheveux. Dans les années 1990, Gillette a mené des études de dosage de l'éflornithine chez des femmes hirsutes qui ont démontré que le médicament ralentissait la croissance des poils du visage. Gillette dépose alors un brevet pour la formulation de crème à l'éflornithine. En juillet 2000, la Food and Drug Administration (FDA) des États-Unis a accordé une demande de nouveau médicament pour Vaniqa. L'année suivante, la Commission européenne a délivré son autorisation de mise sur le marché.
Traitement de la maladie du sommeil
Le médicament a été enregistré pour le traitement de la maladie du sommeil gambiense le 28 novembre 1990. Cependant, en 1995, Aventis (aujourd'hui Sanofi-Aventis) a cessé de produire le médicament, dont le principal marché était les pays africains, car il ne faisait pas de profit.
En 2001, Aventis et l'OMS ont noué un partenariat de cinq ans, au cours duquel plus de 320 000 flacons de pentamidine, plus de 420 000 flacons de mélarsoprol et plus de 200 000 flacons d'éflornithine ont été produits par Aventis, destinés à être remis à l'OMS et distribués par le l'association Médecins sans Frontières (également appelée Médecins Sans Frontières) dans les pays où la maladie du sommeil est endémique.
Selon Médecins sans frontières, cela ne s'est produit qu'après « des années de pression internationale », et coïncidant avec la période où l'attention des médias a été générée en raison du lancement d'un autre produit à base d'éflornithine (Vaniqa, pour la prévention de la pilosité faciale chez les femmes) , alors que sa formulation vitale (pour la maladie du sommeil) n'était pas produite.
De 2001 (date de redémarrage de la production) à 2006, 14 millions de diagnostics ont été posés. Cela a grandement contribué à endiguer la propagation de la maladie du sommeil et à sauver près de 110 000 vies.
Société et culture
Formulaires disponibles
Vaniqa est une crème de couleur blanche à blanc cassé. Il est fourni en tubes de 30 g et 60 g en Europe. Vaniqa contient 15 % p/p de chlorhydrate d'éflornithine monohydraté, correspondant à 11,5 % p/p d'éflornithine anhydre (UE), respectivement 13,9 % p/p de chlorhydrate d'éflornithine anhydre (US), dans une crème pour administration topique.
Ornidyl, destiné à l'injection, était fourni à raison de 200 mg de chlorhydrate d'éflornithine par ml.
Marché
Vaniqa, dont la mise sur le marché a été approuvée par la FDA américaine, ainsi que par la Commission européenne entre autres, est actuellement le seul traitement topique sur ordonnance qui ralentit la croissance des poils du visage. En plus d'être un traitement non mécanique et non cosmétique, c'est la seule option de prescription non hormonale et non systémique disponible pour les femmes souffrant d'hirsutisme facial. Vaniqa est commercialisé par Almirall en Europe, SkinMedica aux États-Unis, Triton au Canada, Medison en Israël et Menarini en Australie.
Ornidyl, la forme injectable du chlorhydrate d'éflornithine, est autorisé par Sanofi-Aventis, mais est actuellement abandonné aux États-Unis.