Glutathion synthétase - Glutathione synthetase
| Glutathion synthétase | |||||||
|---|---|---|---|---|---|---|---|
 Structure de la glutathion synthétase chez la levure . Généré à partir de 1M0W.
| |||||||
| Identifiants | |||||||
| symbole | GSS | ||||||
| gène NCBI | 2937 | ||||||
| HGNC | 4624 | ||||||
| OMIM | 601002 | ||||||
| RéfSeq | NM_000178 | ||||||
| UniProt | P48637 | ||||||
| Autre informations | |||||||
| Numéro CE | 6.3.2.3 | ||||||
| Lieu | Chr. 20 q11.2 | ||||||
| |||||||
| Glutathion synthase eucaryote | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Glutathion synthétase humaine
| |||||||||
| Identifiants | |||||||||
| symbole | GSH_synthase | ||||||||
| Pfam | PF03199 | ||||||||
| Clan Pfam | CL0483 | ||||||||
| InterPro | IPR004887 | ||||||||
| SCOP2 | 2hgs / SCOPe / SUPFAM | ||||||||
| |||||||||
| glutathion synthase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 dimère de glutathion synthétase, humain
| |||||||||
| Identifiants | |||||||||
| CE n° | 6.3.2.3 | ||||||||
| N ° CAS. | 9023-62-5 | ||||||||
| Bases de données | |||||||||
| IntEnz | Vue IntEnz | ||||||||
| BRENDA | Entrée BRENDA | ||||||||
| ExPASy | Vue NiceZyme | ||||||||
| KEGG | Entrée KEGG | ||||||||
| MétaCycle | voie métabolique | ||||||||
| PRIAM | profil | ||||||||
| Structures de l' APB | RCSB PDB PDBe PDBsum | ||||||||
| Ontologie des gènes | AmiGO / QuickGO | ||||||||
| |||||||||
| Glutathion synthase eucaryote, domaine de liaison à l'ATP | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Glutathion synthétase humaine
| |||||||||
| Identifiants | |||||||||
| symbole | GSH_synth_ATP | ||||||||
| Pfam | PF03917 | ||||||||
| InterPro | IPR005615 | ||||||||
| SCOP2 | 1m0t / SCOPE / SUPFAM | ||||||||
| |||||||||
| Glutathion synthétase procaryote, domaine N-terminal | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Structure de la glutathion synthétase d'Escherichia coli à pH 7,5
| |||||||||
| Identifiants | |||||||||
| symbole | GSH-S_N | ||||||||
| Pfam | PF02951 | ||||||||
| InterPro | IPR004215 | ||||||||
| SCOP2 | 1glv / SCOPe / SUPFAM | ||||||||
| |||||||||
| Glutathion synthétase procaryote, domaine de saisie ATP | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Structure de la glutathion synthétase d'Escherichia coli à pH 7,5
| |||||||||
| Identifiants | |||||||||
| symbole | GSH-S_ATP | ||||||||
| Pfam | PF02955 | ||||||||
| Clan Pfam | CL0179 | ||||||||
| InterPro | IPR004218 | ||||||||
| SCOP2 | 1glv / SCOPe / SUPFAM | ||||||||
| |||||||||
La glutathion synthétase ( GSS ) (EC 6.3.2.3) est la deuxième enzyme de la voie de biosynthèse du glutathion (GSH). Il catalyse la condensation de la gamma-glutamylcystéine et de la glycine , pour former du glutathion. La glutathion synthétase est également un puissant antioxydant. On le trouve dans de nombreuses espèces, notamment les bactéries, les levures, les mammifères et les plantes.
Chez l'homme, les anomalies du SGS sont héréditaires sur un mode autosomique récessif et sont à l'origine d'une acidose métabolique sévère , d'une 5-oxoprolinurie , d'une augmentation du taux d' hémolyse et d'un dysfonctionnement du système nerveux central . Des carences en GSS peuvent provoquer un éventail de symptômes délétères chez les plantes et les êtres humains.
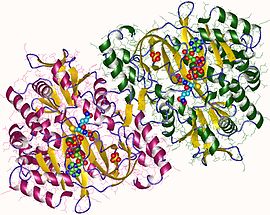
Chez les eucaryotes , il s'agit d'une enzyme homodimérique . Le domaine de liaison au substrat a une structure alpha / bêta /alpha à trois couches . Cette enzyme utilise et stabilise un intermédiaire acylphosphate pour effectuer plus tard une attaque nucléophile favorable de la glycine .
Structure
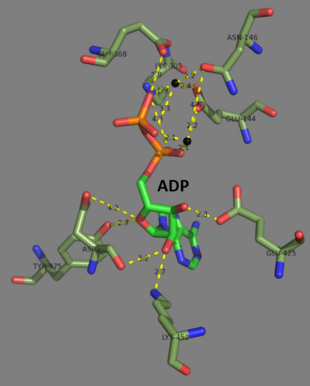
Les glutathion synthétases humaines et de levure sont des homodimères , ce qui signifie qu'elles sont composées de deux sous - unités identiques d'elle -même liées de manière non covalente l' une à l'autre. D'autre part, la glutathion synthétase d' E. coli est un homotétramère . Néanmoins, ils font partie de la superfamille ATP-grasp , qui se compose de 21 enzymes contenant un pli ATP-grasp. Chaque sous-unité interagit les unes avec les autres par le biais d' interactions de liaison hydrogène en hélice alpha et en feuillet bêta et contient deux domaines. Un domaine facilite le mécanisme ATP-portée et l'autre est le catalyseur site actif de γ-glutamylcystéine . Le pli ATP-grasp est conservé au sein de la superfamille ATP-grasp et est caractérisé par deux hélices alpha et des feuillets bêta qui retiennent la molécule d'ATP entre elles. Le domaine contenant le site actif présente des propriétés de spécificité intéressantes. Contrairement à la -glutamylcystéine synthétase, la glutathion synthétase accepte une grande variété d'analogues glutamyl-modifiés de la γ-glutamylcystéine, mais est beaucoup plus spécifique pour les analogues modifiés par la cystéine de la γ-glutamylcystéine. Les structures cristallines ont montré que la glutathion synthétase était liée au GSH, à l'ADP, à deux ions magnésium et à un ion sulfate. Deux ions magnésium fonctionnent pour stabiliser l'intermédiaire acylphosphate, faciliter la liaison de l'ATP et activer l'élimination du groupe phosphate de l'ATP. L'ion sulfate remplace le phosphate inorganique une fois que l'intermédiaire acylphosphate est formé à l'intérieur du site actif.
À la fin de 2007, 7 structures ont été résolues pour cette classe d'enzymes, avec les codes d'accession PDB 1GLV , 1GSA , 1GSH , 1M0T , 1M0W , 2GLT et 2HGS .
Mécanisme
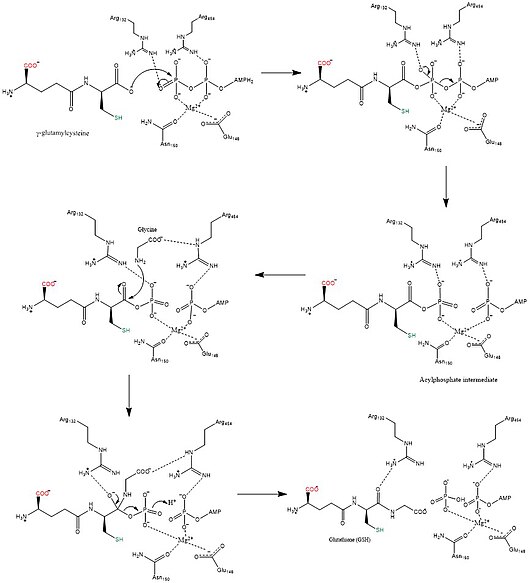
La glutathion synthase catalyse la réaction chimique
- ATP + gamma-L-glutamyl-L-cystéine + glycine ADP + phosphate + glutathion
Les 3 substrats de cette enzyme sont l' ATP , la gamma-L-glutamyl-L-cystéine et la glycine , tandis que ses 3 produits sont l' ADP , le phosphate et le glutathion .
Cette enzyme appartient à la famille des ligases , en particulier celles qui forment des liaisons carbone-azote sous forme de ligases acides-D-amino-acides (peptides synthases). Le nom systématique de cette classe d'enzymes est gamma-L-glutamyl-L-cystéine:glycine ligase (formant l'ADP) . D'autres noms d'usage courant comprennent la glutathion synthétase et la GSH synthétase . Cette enzyme participe au métabolisme du glutamate et au métabolisme du glutathion . Au moins un composé, le Phosphinate, est connu pour inhiber cette enzyme .
Les mécanismes de biosynthèse des synthétases utilisent l'énergie des nucléosides triphosphates , contrairement aux synthases . La glutathion synthétase reste fidèle à cette règle, en ce sens qu'elle utilise l'énergie générée par l'ATP. Initialement, le groupe carboxylate sur la γ-glutamylcystéine est converti en un phosphate d' acyle par le transfert d'un groupe phosphate inorganique d'ATP pour générer un intermédiaire phosphate d'acyle. Ensuite, le groupe amino de la glycine participe à une attaque nucléophile, déplaçant le groupe phosphate et formant du GSH. Une fois le produit GSH final fabriqué, il peut être utilisé par la glutathion peroxydase pour neutraliser les espèces réactives de l'oxygène (ROS) telles que H 2 O 2 ou les glutathion S-transférases dans la détoxification des xénobiotiques .
Fonction
La glutathion synthétase est importante pour une variété de fonctions biologiques dans plusieurs organismes. Chez Arabidopsis thaliana , de faibles niveaux de glutathion synthétase ont entraîné une vulnérabilité accrue aux facteurs de stress tels que les métaux lourds , les produits chimiques organiques toxiques et le stress oxydatif . La présence d'un groupe fonctionnel thiol permet à son produit GSH de servir à la fois d' agent oxydant et réducteur efficace dans de nombreux scénarios biologiques. Les thiols peuvent facilement accepter une paire d'électrons et s'oxyder en disulfures , et les disulfures peuvent être facilement réduits pour régénérer les thiols. De plus, la chaîne latérale thiol des cystéines sert de puissants nucléophiles et réagit avec les oxydants et les espèces électrophiles qui, autrement, endommageraient la cellule. Les interactions avec certains métaux stabilisent également les intermédiaires thiolates.
Chez l'homme, la glutathion synthétase fonctionne de manière similaire. Son produit GSH participe aux voies cellulaires impliquées dans l'homéostasie et la maintenance cellulaire. Par exemple, les glutathion peroxydases catalysent l'oxydation du GSH en glutathion disulfure (GSSG) en réduisant les radicaux libres et les espèces réactives de l'oxygène telles que le peroxyde d'hydrogène. La glutathion S-transférase utilise le GSH pour nettoyer divers métabolites, xénobiotiques et électrophiles en mercaptures pour l'excrétion. En raison de son rôle antioxydant, le GSS produit principalement du GSH à l'intérieur du cytoplasme des cellules hépatiques et importé dans les mitochondries où se produit la détoxification. Le GSH est également essentiel pour l'activation du système immunitaire afin de générer des mécanismes de défense robustes contre les agents pathogènes envahissants. Le GSH est capable de prévenir l'infection par le virus de la grippe.
Signification clinique
Les patients présentant des mutations du gène GSS développent un déficit en glutathion synthétase (GSS) , une maladie autosomique récessive. Les patients développent un large éventail de symptômes en fonction de la gravité des mutations. Les patients légèrement atteints présentent une anémie hémolytique compensée car les mutations affectent la stabilité de l'enzyme. Les individus modérément et sévèrement touchés ont des enzymes avec des sites catalytiques dysfonctionnels, ce qui les rend incapables de participer aux réactions de détoxification. Les symptômes physiologiques comprennent une acidose métabolique , des anomalies neurologiques et une susceptibilité accrue aux infections pathogènes.
Le traitement des individus présentant un déficit en glutathion synthétase implique généralement des traitements thérapeutiques pour traiter des symptômes et des affections légers à sévères. Afin de traiter l' acidose métabolique , les patients gravement touchés sont données de grandes quantités de bicarbonate et des antioxydants tels que la vitamine E et la vitamine C . Dans les cas bénins, il a été démontré que l' ascorbate et la N- acétylcystéine augmentent les niveaux de glutathion et augmentent la production d' érythrocytes . Il est important de noter que parce que le déficit en glutathion synthétase est si rare, il est mal compris. La maladie apparaît également sur un spectre, il est donc encore plus difficile de généraliser parmi les quelques cas qui surviennent.
Voir également
Les références
- Loi MY, Halliwell B (1986). « Purification et propriétés de la glutathion synthétase des feuilles (Spinacia oleracea) ». Plante Sci . 43 (3) : 185–191. doi : 10.1016/0168-9452(86)90016-6 .
- Macnicol PK (1987). « Homoglutathion et glutathion synthétases de semis de légumineuses - purification partielle et spécificité de substrat ». Plante Sci . 53 (3) : 229-235. doi : 10.1016/0168-9452(87)90159-2 .
Liens externes
- Glutathion + Synthétase à la National Library of Medicine Medical Subject Headings (MeSH) des États-Unis