Cône de croissance - Growth cone
Un cône de croissance est une grande extension soutenue par l' actine d'un neurite en développement ou en régénération à la recherche de sa cible synaptique . Leur existence a été initialement proposée par l' histologue espagnol Santiago Ramón y Cajal sur la base d' images stationnaires qu'il a observées au microscope . Il a d'abord décrit le cône de croissance à base de cellules fixes comme « une concentration de protoplasme de forme conique, doté de mouvements amiboïdes » (Cajal, 1890). Les cônes de croissance sont situés à l'extrémité des neurites, soit des dendrites, soit des axones , de la cellule nerveuse . Les fonctions sensorielles, motrices, intégratives et adaptatives des axones et des dendrites en croissance sont toutes contenues dans cette structure spécialisée.
Structure

La morphologie du cône de croissance peut être facilement décrite en utilisant la main comme analogie. Les fines extensions du cône de croissance sont des filopodes pointus appelés microspikes. Les filopodes sont comme les "doigts" du cône de croissance ; ils contiennent des faisceaux de filaments d' actine (F-actine) qui leur donnent forme et support. Les filopodes sont les structures dominantes dans les cônes de croissance, et ils apparaissent comme des extensions cylindriques étroites qui peuvent s'étendre de plusieurs micromètres au-delà du bord du cône de croissance. Les filopodes sont liés par une membrane qui contient des récepteurs et des molécules d'adhésion cellulaire qui sont importantes pour la croissance et le guidage des axones .
Entre les filopodes—un peu comme la sangle des mains—sont les " lamellipodes ". Ce sont des régions plates de maillage dense d'actine au lieu d'actine F groupée comme dans les filopodes. Ils apparaissent souvent adjacents au bord d'attaque du cône de croissance et sont placés entre deux filopodes, ce qui leur donne une apparence de "voile". Dans les cônes de croissance, de nouveaux filopodes émergent généralement de ces voiles inter-filopodes.
Le cône de croissance est décrit en termes de trois régions : le domaine périphérique (P), le domaine transitionnel (T) et le domaine central (C). Le domaine périphérique est la région mince entourant le bord extérieur du cône de croissance. Il est composé principalement d'un cytosquelette à base d'actine et contient les lamellipodes et les filopodes qui sont très dynamiques. Les microtubules , cependant, sont connus pour pénétrer transitoirement dans la région périphérique via un processus appelé instabilité dynamique. Le domaine central est situé au centre du cône de croissance le plus proche de l'axone. Cette région est composée principalement d'un cytosquelette à base de microtubules, est généralement plus épaisse et contient de nombreux organites et vésicules de différentes tailles. Le domaine de transition est la région située dans la bande mince entre les domaines central et périphérique.
Les cônes de croissance sont moléculairement spécialisés, avec des transcriptomes et des protéomes distincts de ceux de leurs corps cellulaires parentaux. Il existe de nombreuses protéines associées au cytosquelette, qui remplissent diverses fonctions au sein du cône de croissance, telles que l'ancrage de l'actine et des microtubules les uns aux autres, à la membrane et à d'autres composants du cytosquelette. Certains de ces composants comprennent des moteurs moléculaires qui génèrent une force dans le cône de croissance et des vésicules liées à la membrane qui sont transportées dans et hors du cône de croissance via des microtubules. Quelques exemples de protéines associées au cytosquelette sont la fascine et les filamines (regroupement d'actine), la taline (ancrage de l'actine), la myosine (transport des vésicules) et mDia ( liaison microtubule-actine).
Ramification et excroissance des axones
La nature hautement dynamique des cônes de croissance leur permet de réagir au milieu environnant en changeant rapidement de direction et en se ramifiant en réponse à divers stimuli. Il y a trois stades de croissance axonale, qui sont appelés : protrusion, engorgement et consolidation. Au cours de la protrusion, il y a une extension rapide des filopodes et des extensions lamellaires le long du bord d'attaque du cône de croissance. L'engorgement se produit lorsque les filopodes se déplacent vers les bords latéraux du cône de croissance et que les microtubules envahissent davantage le cône de croissance, apportant des vésicules et des organites tels que les mitochondries et le réticulum endoplasmique. Enfin, la consolidation se produit lorsque la F-actine au col du cône de croissance se dépolymérise et que les filopodes se rétractent. La membrane se rétracte ensuite pour former un arbre axonal cylindrique autour du faisceau de microtubules. Une forme de ramification axonale se produit également via le même processus, sauf que le cône de croissance «se divise» pendant la phase d'engorgement. Cela se traduit par la bifurcation de l'axone principal. Une forme supplémentaire de ramification axonale est appelée ramification collatérale (ou interstitielle). La ramification collatérale, contrairement aux bifurcations axonales, implique la formation d'une nouvelle branche à partir de la tige axonale établie et est indépendante du cône de croissance à l'extrémité de l'axone en croissance. Dans ce mécanisme, l'axone génère initialement un filopode ou un lamellipodium qui, après invasion par les microtubules axonaux, peut ensuite se développer davantage en une branche s'étendant perpendiculairement à la tige axonale. Les branches collatérales établies, comme l'axone principal, présentent un cône de croissance et se développent indépendamment de la pointe de l'axone principal.
Dans l'ensemble, l'allongement des axones est le produit d'un processus connu sous le nom de croissance de la pointe. Dans ce processus, du nouveau matériel est ajouté au cône de croissance tandis que le reste du cytosquelette axonal reste stationnaire. Cela se produit via deux processus : la dynamique basée sur le cytosquelette et la tension mécanique. Avec la dynamique du cytosquelette, les microtubules polymérisent dans le cône de croissance et délivrent des composants vitaux. Une tension mécanique se produit lorsque la membrane est étirée en raison de la génération de force par des moteurs moléculaires dans le cône de croissance et de fortes adhérences au substrat le long de l'axone. En général, les cônes de croissance à croissance rapide sont petits et ont un grand degré d'étirement, tandis que les cônes de croissance lents ou en pause sont très gros et ont un faible degré d'étirement.
Les cônes de croissance sont continuellement construits par la construction des microfilaments d'actine et l'extension de la membrane plasmique via la fusion des vésicules . Les filaments d'actine se dépolymérisent et se désassemblent sur l'extrémité proximale pour permettre aux monomères libres de migrer vers le bord d'attaque (extrémité distale) du filament d'actine où il peut polymériser et ainsi se rattacher. Les filaments d'actine sont également constamment transportés loin du bord d'attaque par un processus entraîné par un moteur de myosine connu sous le nom de flux rétrograde d'actine F. Les filaments d'actine sont polymérisés dans la région périphérique puis transportés vers la région de transition, où les filaments sont dépolymérisés ; libérant ainsi les monomères pour répéter le cycle. Ceci est différent du tapis roulant à l'actine puisque toute la protéine bouge. Si la protéine était simplement un tapis roulant, les monomères se dépolymériseraient d'un bout et se polymériseraient à l'autre tandis que la protéine elle-même ne bougerait pas.
La capacité de croissance des axones réside dans les microtubules situés juste au-delà des filaments d'actine. Les microtubules peuvent polymériser rapidement et ainsi «sonder» la région périphérique riche en actine du cône de croissance. Lorsque cela se produit, les extrémités polymérisantes des microtubules entrent en contact avec les sites d'adhésion de l'actine F, où les protéines associées à la pointe des microtubules agissent comme des « ligands ». Les laminines de la membrane basale interagissent avec les intégrines du cône de croissance pour favoriser le mouvement vers l'avant du cône de croissance. De plus, la croissance axonale est également soutenue par la stabilisation des extrémités proximales des microtubules, qui fournissent le support structurel de l'axone.
Guidage axonal
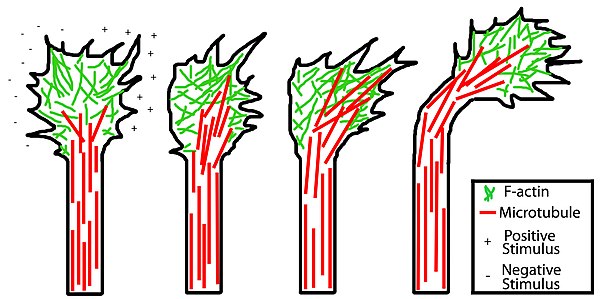
Le mouvement des axones est contrôlé par une intégration de sa fonction sensorielle et motrice (décrite ci-dessus) qui est établie par des seconds messagers tels que le calcium et les nucléotides cycliques. La fonction sensorielle des axones dépend des signaux de la matrice extracellulaire qui peuvent être attrayants ou répulsifs, aidant ainsi à éloigner l'axone de certains chemins et à les attirer vers leurs destinations cibles appropriées. Les signaux attractifs inhibent le flux rétrograde des filaments d'actine et favorisent leur assemblage tandis que les signaux répulsifs ont l'effet exactement inverse. Les protéines stabilisant l'actine sont également impliquées et sont essentielles à la protrusion continue des filopodes et des lamellipodes en présence d'indices attractifs, tandis que les protéines déstabilisant l'actine sont impliquées en présence d'un indice répulsif.
Un processus similaire est impliqué avec les microtubules . En présence d'un signal attractif d'un côté du cône de croissance, des microtubules spécifiques sont ciblés de ce côté par des protéines de stabilisation des microtubules, ce qui entraîne une rotation du cône de croissance dans la direction du stimulus positif. Avec les signaux répulsifs, le contraire est vrai : la stabilisation des microtubules est favorisée du côté opposé du cône de croissance en tant que stimulus négatif entraînant le détournement du cône de croissance du répulsif. Ce processus couplé à des processus associés à l'actine entraîne la croissance globale dirigée d'un axone.
Les récepteurs des cônes de croissance détectent la présence de molécules de guidage axonal telles que la nétrine , la fente, les éphrines et les sémaphorines . Il a été montré plus récemment que les déterminants du destin cellulaire tels que Wnt ou Shh peuvent également servir d'indices de guidage. Le même indice de guidage peut agir comme un attractif ou un répulsif, selon le contexte. Un excellent exemple de ceci est Netrin-1, qui signale l'attraction via le récepteur DCC et la répulsion via le récepteur Unc-5. De plus, il a été découvert que ces mêmes molécules sont impliquées dans le guidage de la croissance des vaisseaux. Le guidage axonal dirige le câblage initial du système nerveux et est également important dans la régénération axonale à la suite d'une blessure .