Guanine - Guanine
|
|||
|
|
|||
| Noms | |||
|---|---|---|---|
|
Nom IUPAC préféré
2-Amino-1,9-dihydro-6 H -purine-6-one |
|||
| Autres noms
2-amino-6-hydroxypurine,
2-aminohypoxanthine, Guanine |
|||
| Identifiants | |||
|
Modèle 3D ( JSmol )
|
|||
| 147911 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Banque de médicaments | |||
| Carte d'information de l'ECHA |
100.000.727 |
||
| Numéro CE | |||
| 431879 | |||
| KEGG | |||
|
CID PubChem
|
|||
| Numéro RTECS | |||
| UNII | |||
|
Tableau de bord CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriétés | |||
| C 5 H 5 N 5 O | |||
| Masse molaire | 151,13 g/mol | ||
| Apparence | Solide amorphe blanc. | ||
| Densité | 2.200 g/cm 3 (calculé) | ||
| Point de fusion | 360 °C (680 °F; 633 K) se décompose | ||
| Point d'ébullition | Sublime | ||
| Insoluble. | |||
| Acidité (p K a ) | 3,3 (amide), 9,2 (secondaire), 12,3 (primaire) | ||
| Dangers | |||
| Principaux dangers | Irritant | ||
| NFPA 704 (diamant de feu) | |||
| point de rupture | Ininflammable | ||
| Composés apparentés | |||
|
Composés apparentés
|
Cytosine ; Adénine ; thym ; uracile | ||
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa). |
|||
|
|
|||
| Références de l'infobox | |||
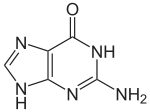
Guanine ( / ɡ w ɑː n ɪ n / ) ( symbole G ou Gua ) est l' un des quatre nucléobases trouvés dans les acides nucléiques ADN et ARN , les autres étant l' adénine , la cytosine et la thymine ( uracile dans l' ARN). Dans l' ADN , la guanine est associée à la cytosine. Le nucléoside guanine est appelé guanosine .
Avec la formule C 5 H 5 N 5 O, la guanine est un dérivé de purine , constitué d'un système cyclique pyrimidine - imidazole fusionné avec des doubles liaisons conjuguées. Cet arrangement insaturé signifie que la molécule bicyclique est plane.
Propriétés
La guanine, avec l'adénine et la cytosine, est présente à la fois dans l'ADN et l'ARN, tandis que la thymine n'est généralement observée que dans l'ADN et l'uracile uniquement dans l'ARN. La guanine a deux formes tautomères , la forme céto majeure (voir figures) et la forme énol rare .
Il se lie à la cytosine par trois liaisons hydrogène . Dans la cytosine, le groupe amino agit comme donneur de liaison hydrogène et le carbonyle C-2 et l'amine N-3 comme accepteurs de liaison hydrogène. La guanine a le groupe carbonyle C-6 qui agit en tant qu'accepteur de liaison hydrogène, tandis qu'un groupe en N-1 et le groupe amino en C-2 agissent en tant que donneurs de liaison hydrogène.
La guanine peut être hydrolysée avec un acide fort en glycine , ammoniac , dioxyde de carbone et monoxyde de carbone . Premièrement, la guanine est désaminée pour devenir de la xanthine . La guanine s'oxyde plus facilement que l'adénine, l'autre base dérivée de la purine dans l'ADN. Son point de fusion élevé de 350 °C reflète la liaison hydrogène intermoléculaire entre les groupes oxo et amino dans les molécules du cristal. En raison de cette liaison intermoléculaire, la guanine est relativement insoluble dans l'eau, mais elle est soluble dans les acides et les bases dilués.
Histoire
Le premier isolement de guanine a été rapporté en 1844 par le chimiste allemand Julius Bodo Unger (1819-1885), qui l'a obtenu comme un minéral formé à partir d'excréments d'oiseaux marins, qui est connu sous le nom de guano et qui a été utilisé comme un source d'engrais; la guanine a été nommée en 1846. Entre 1882 et 1906, Hermann Emil Fischer a déterminé la structure et a également montré que l'acide urique peut être converti en guanine.
Synthèse
Des traces de guanine se forment par polymérisation du cyanure d'ammonium ( NH
4CN ). Deux expériences menées par Levy et al. a montré que chauffer 10 mol·L −1 NH
4CN à 80 °C pendant 24 heures a donné un rendement de 0,0007 %, en utilisant 0,1 mol·L −1 NH
4Le CN congelé à -20 °C pendant 25 ans a donné un rendement de 0,0035 %. Ces résultats indiquent que la guanine pourrait apparaître dans les régions gelées de la terre primitive. En 1984, Yuasa a rapporté un rendement de 0,00017% de guanine après la décharge électrique de NH
3, CH
4, C
2H
6, et 50 ml d'eau, suivi d'une hydrolyse acide subséquente. Cependant, on ne sait pas si la présence de guanine n'était pas simplement un contaminant résultant de la réaction.
- 10NH 3 + 2CH 4 + 4C 2 H 6 + 2H 2 O → 2C 5 H 8 N 5 O (guanine) + 25H 2
Une synthèse de Fischer-Tropsch peut également être utilisée pour former de la guanine, avec l' adénine , l' uracile et la thymine . Le chauffage d'un mélange gazeux équimolaire de CO, H 2 et NH 3 à 700 °C pendant 15 à 24 minutes, suivi d'un refroidissement rapide puis d'un réchauffage prolongé à 100 à 200 °C pendant 16 à 44 heures avec un catalyseur d'alumine, a donné de la guanine et l'uracile :
- 10CO + H 2 + 10NH 3 → 2C 5 H 8 N 5 O (guanine) + 8H 2 O
Une autre voie abiotique possible a été explorée en éteignant un plasma à haute température de mélange gazeux 90 % N 2 –10 % CO–H 2 O.
La synthèse de Traube consiste à chauffer la 2,4,5-triamino-1,6-dihydro-6-oxypyrimidine (sous forme de sulfate) avec de l'acide formique pendant plusieurs heures.

Biosynthèse
La guanine n'est pas synthétisée de novo , mais est séparée de la molécule plus complexe, la guanosine , par l'enzyme guanosine phosphorylase :
- guanosine + phosphate guanine + alpha-D-ribose 1-phosphate
Autres occurrences et utilisations biologiques
Le mot guanine dérive de l'emprunt espagnol guano (« fientes d'oiseaux/de chauve-souris »), qui lui-même vient du mot quechua wanu , qui signifie « crottin ». Comme le note l' Oxford English Dictionary , la guanine est « une substance amorphe blanche obtenue en abondance à partir du guano, formant un constituant des excréments des oiseaux ».
En 1656 à Paris, un M. Jaquin extrait des écailles du poisson Alburnus alburnus ce qu'on appelle "l'essence de perle", qui est de la guanine cristalline. Dans l'industrie cosmétique, la guanine cristalline est utilisée comme additif à divers produits (par exemple, les shampooings), où elle procure un effet nacré irisé . Il est également utilisé dans les peintures métallisées et les imitations de perles et de plastiques. Il donne un éclat chatoyant aux ombres à paupières et au vernis à ongles . Des soins du visage utilisant les excréments, ou guano, des rossignols japonais ont été utilisés au Japon et ailleurs, car la guanine contenue dans les excréments rend la peau plus pâle. Les cristaux de guanine sont des plaquettes rhombiques composées de plusieurs couches transparentes, mais elles ont un indice de réfraction élevé qui réfléchit et transmet partiellement la lumière d'une couche à l'autre, produisant ainsi un lustre nacré. Il peut être appliqué par pulvérisation, peinture ou trempage. Cela peut irriter les yeux. Ses alternatives sont le mica , la fausse perle (provenant de coquillages broyés) et les particules d' aluminium et de bronze .
La guanine a une très grande variété d'utilisations biologiques qui incluent une gamme de fonctions allant à la fois en complexité et en polyvalence. Ceux-ci incluent le camouflage, l'affichage et la vision, entre autres.
Les araignées, les scorpions et certains amphibiens convertissent l'ammoniac, en tant que produit du métabolisme des protéines dans les cellules, en guanine, car il peut être excrété avec une perte d'eau minimale.
La guanine se trouve également dans les cellules cutanées spécialisées des poissons appelées iridocytes (par exemple, l' esturgeon ), ainsi que dans les dépôts réfléchissants des yeux des poissons d'eau profonde et de certains reptiles , tels que les crocodiles .
Le 8 août 2011, un rapport, basé sur des études de la NASA avec des météorites trouvées sur Terre, a été publié, suggérant que des éléments constitutifs de l'ADN et de l'ARN (guanine, adénine et molécules organiques apparentées ) pourraient avoir été formés de manière extraterrestre dans l'espace.
Voir également
Les références
Liens externes
- Spectre guanine MS
- Guanine sur Chemicalland21.com