Tache H&E - H&E stain

La coloration à l' hématoxyline et à l' éosine ( ou coloration à l' hématoxyline et à l' éosine ou coloration à l' hématoxyline-éosine ; souvent abrégée en coloration H&E ou coloration HE ) est l' une des principales colorations tissulaires utilisées en histologie . C'est la tache la plus utilisée dans le diagnostic médical et c'est souvent l' étalon-or . Par exemple, lorsqu'un pathologiste examine une biopsie d'un cancer suspecté , la section histologique est susceptible d'être colorée avec H&E.
H&E est la combinaison de deux colorations histologiques : l' hématoxyline et l' éosine . L'hématoxyline colore les noyaux cellulaires en bleu violacé et l'éosine colore la matrice extracellulaire et le cytoplasme en rose, tandis que d'autres structures prennent différentes nuances, teintes et combinaisons de ces couleurs. Par conséquent, un pathologiste peut facilement différencier les parties nucléaire et cytoplasmique d'une cellule et, en outre, les motifs généraux de coloration de la coloration montrent la disposition et la distribution générales des cellules et donnent un aperçu général de la structure d'un échantillon de tissu. Ainsi, la reconnaissance des formes, à la fois par des humains experts eux - mêmes et par un logiciel qui aide ces experts (en pathologie numérique ), fournit des informations histologiques.
Cette combinaison de teinture a été introduite pour la première fois en 1876 par A. Wissowzky.
Les usages
La procédure de coloration H&E est la coloration principale en histologie en partie parce qu'elle peut être effectuée rapidement, n'est pas chère et colore les tissus de telle manière qu'une quantité considérable d' anatomie microscopique est révélée et peut être utilisée pour diagnostiquer un large éventail de conditions histopathologiques . Les résultats de la coloration H&E ne dépendent pas trop du produit chimique utilisé pour fixer le tissu ou de légères incohérences dans le protocole de laboratoire, et ces facteurs contribuent à son utilisation de routine en histologie.
La coloration H&E ne fournit pas toujours suffisamment de contraste pour différencier tous les tissus, les structures cellulaires ou la distribution des substances chimiques, et dans ces cas, des colorations et des méthodes plus spécifiques sont utilisées.
Méthode d'application
Il existe de nombreuses façons de préparer les solutions d'hématoxyline (formulation) utilisées dans la procédure H&E, en outre, il existe de nombreux protocoles de laboratoire pour produire des lames colorées H&E, dont certains peuvent être spécifiques à un certain laboratoire. Bien qu'il n'y ait pas de procédure standard, les résultats par convention sont raisonnablement cohérents dans la mesure où les noyaux cellulaires sont colorés en bleu et le cytoplasme et la matrice extracellulaire sont colorés en rose. Les laboratoires d'histologie peuvent également ajuster la quantité ou le type de coloration pour un pathologiste particulier.
Une fois que les tissus ont été collectés (souvent sous forme de biopsies ) et fixés, ils sont généralement déshydratés et inclus dans de la cire de paraffine fondue , le bloc résultant est monté sur un microtome et coupé en fines tranches. Les tranches sont apposées sur des lames de microscope, après quoi la cire est retirée avec un solvant et les tranches de tissus attachées aux lames sont réhydratées et prêtes à être colorées. Alternativement, la coloration H&E est la coloration la plus utilisée en chirurgie de Mohs dans laquelle les tissus sont généralement congelés, coupés sur un cryostat (un microtome qui coupe les tissus congelés), fixés dans de l'alcool, puis colorés.
La méthode de coloration H&E implique l'application d' hématoxyline mélangée à un sel métallique, ou mordant , souvent suivie d'un rinçage dans une solution acide faible pour éliminer l'excès de coloration ( différenciation ), suivi d'un bleuissement dans de l' eau légèrement alcaline . Après l'application d'hématoxyline, le tissu est contre- coloré à l'éosine (le plus souvent à l' éosine Y ).
Résultats
L'hématoxyline colore principalement les noyaux des cellules en bleu ou en violet foncé, ainsi que quelques autres tissus, tels que les granules de kératohyaline et le matériel calcifié . L'éosine colore le cytoplasme et certaines autres structures, y compris la matrice extracellulaire telle que le collagène, jusqu'à cinq nuances de rose. Les structures éosinophiles (substances colorées par l'éosine) sont généralement composées de protéines intracellulaires ou extracellulaires . Les corps de Lewy et les corps de Mallory sont des exemples de structures éosinophiles. La majeure partie du cytoplasme est éosinophile et est rendue rose. Les globules rouges sont intensément colorés en rouge.
Mode d'action
Bien que l' hématéine , une forme oxydée de l'hématoxyline, soit le colorant actif (lorsqu'elle est associée à un mordant), la tache est toujours appelée hématoxyline . L'hématoxyline, lorsqu'elle est combinée avec un mordant (le plus souvent l' alun d' aluminium ) est souvent considérée comme "ressemblant" à un colorant basique, chargé positivement ou cationique . L'éosine est un colorant anionique (chargé négativement) et acide. La coloration des noyaux par l' hémalum (une combinaison d'ions aluminium et d'hématéine) est généralement due à la liaison du complexe colorant-métal à l'ADN, mais la coloration nucléaire peut être obtenue après extraction de l'ADN à partir de coupes de tissus. Le mécanisme est différent de celui de la coloration nucléaire par des colorants basiques (cationiques) comme la thionine ou le bleu de toluidine . La coloration par les colorants basiques ne se produit qu'à partir de solutions moins acides que l'hémalum, et elle est empêchée par une extraction chimique ou enzymatique préalable des acides nucléiques. Il existe des preuves indiquant que des liaisons de coordination, similaires à celles qui maintiennent l'aluminium et l'hématine ensemble, lient le complexe hémalum à l'ADN et aux groupes carboxy des protéines de la chromatine nucléaire .
Les structures n'ont pas besoin d'être acides ou basiques pour être dites basophiles et éosinophiles ; la terminologie est basée sur l'affinité des composants cellulaires pour les colorants. D'autres couleurs, par exemple le jaune et le marron, peuvent être présentes dans l'échantillon ; elles sont causées par des pigments intrinsèques tels que la mélanine . Les lames basales doivent être colorées au PAS ou à l' argent si elles doivent être bien visibles. Les fibres réticulaires nécessitent également une coloration à l'argent. Les structures hydrophobes ont également tendance à rester claires ; ceux-ci sont généralement riches en graisses, par exemple les adipocytes , la myéline autour des axones des neurones et les membranes de l'appareil de Golgi .
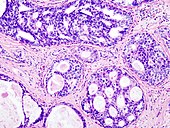
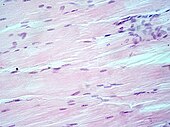
Exemples de tissus colorés H&E
Os , noyaux cellulaires (bleu-violet), matrice osseuse (rose).
Carcinome canalaire in situ (CCIS) dans le tissu mammaire, noyaux cellulaires (bleu-violet), matériel extracellulaire (rose).
Tissu pulmonaire prélevé sur un patient souffrant d' emphysème . Noyaux cellulaires (bleu-violet), globules rouges (rouge vif), autres corps cellulaires et matériel extracellulaire (rose) et espaces aériens (blanc).
Tissu musculaire , noyaux cellulaires (bleu-violet), matériel extracellulaire (rose).
Carcinome basocellulaire de la peau , noyaux cellulaires (bleu-violet), matériel extracellulaire (rose).
Les références
Lectures complémentaires
- Kiernan JA (2008) Méthodes histologiques et histochimiques : théorie et pratique. 4e éd. Bloxham, Royaume-Uni : Scion.
- Lillie RD, Pizzolato P, Donaldson PT (1976) Colorations nucléaires avec des colorants de lac mordants métachromes solubles. L'effet des réactions chimiques de blocage des groupes terminaux et l'introduction artificielle de groupes acides dans les tissus. Histochimie 49 : 23-35.
- Llewellyn BD (2009) Coloration nucléaire à l'alun-hématoxyline. Biotechnologies. Histochem. 84 : 159-177.
- Puchtler H, Meloan SN, Waldrop FS (1986) Application des concepts chimiques actuels aux colorations métal-hématéine et -brazileine. Histochimie 85 : 353-364.