Hémiacétal - Hemiacetal
Un hémiacétal ou un hémicétal a la formule générale R 1 R 2 C(OH)OR, où R 1 ou R 2 est l'hydrogène ou un substituant organique. Ils résultent généralement de l'addition d'un alcool à un aldéhyde ou à une cétone , bien que ces derniers soient parfois appelés hémimétaux. La plupart des sucres sont des hémiacétals.
Nomenclature
Selon la définition IUPAC , dans R 1 R 2 C(OH)OR R 1 et R 2 peuvent être ou non un hydrogène. Dans un hémimétal, aucun des groupes R ne peut être un hydrogène. Les hémiacétals sont considérés comme des hémiacétals où aucun des groupes R n'est H, et sont donc une sous-classe des hémiacétals. Le préfixe grec hèmi signifie moitié, fait référence au fait qu'un seul alcool a été ajouté au groupe carbonyle , contrairement aux acétals ou cétals , qui se forment lorsqu'un deuxième groupe alcoxy a été ajouté à la structure.
Les hémiacétals et les hémicétals cycliques sont parfois appelés lactols . Ils se forment souvent facilement, surtout lorsqu'il s'agit de cycles à 5 et 6 chaînons. Dans ce cas, un groupe OH intramoléculaire réagit avec le groupe carbonyle. Le glucose et de nombreux autres aldoses existent sous forme d'hémiacétals cycliques, tandis que le fructose et les cétoses similaires existent sous forme d' hémiacétals cycliques.
Formation

|
| Formation d'hémiacétals |
|
|

|
| Formation d'hémimétaux |
Les solutions d'aldéhydes simples dans les alcools sont principalement constituées d'hémiacétal. L'équilibre est facilement inversé et dynamique. L'équilibre est sensible aux effets stériques.
| Composé carbonylé | solvant d'alcool | %hémiacétal |
|---|---|---|
| acétaldéhyde | méthanol | 97 |
| acétaldéhyde | éthanol | 91 |
| propionaldéhyde | méthanol | 95 |
| bromoacétone | méthanol | 47 |
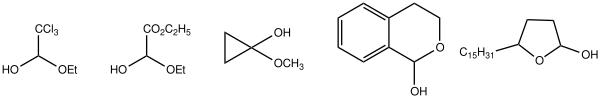
Hémiacétals dans la nature
Les hémiacétals les plus courants sont sans doute les sucres, par exemple le glucose . La favorabilité de la formation d'un cycle à six chaînons sans contrainte et l'électrophilie d'un aldéhyde se combinent pour favoriser fortement la forme acétal.
| A gauche, le glucose, un hémiacétal cyclique. A droite un lactol de fructose, un hémimétal cyclique. |
|
Réactions
Les hémiacétals et les hémicétals peuvent être considérés comme des intermédiaires dans la réaction entre les alcools et les aldéhydes ou les cétones, le produit final étant un acétal ou un cétal :
- R 2 C=O + R'OH R 2 C(OH)(OR')
- R 2 C(OH)(OR') + R'OH R 2 C(OR') 2 + H 2 O
Habituellement, la deuxième réaction est défavorable. En présence d'un agent déshydratant, il procède.
Les références
- ^ IUPAC , Compendium de terminologie chimique , 2e éd. (le "Livre d'or") (1997). Version corrigée en ligne : (2006–) " hemiketals ". doi : 10.1351/goldbook.H02776
- ^ Renard, Marye Anne; Whitesell, James K. (2004). Chimie Organique . Jones & Bartlett Apprentissage. p. 590. ISBN 9780763721978.
- ^ Lactols du livre d'or de l'IUPAC
- ^ un b Schmitz, Ernst; Eichhorn, Inge (1967). "Acétals et Hémiacétals". La liaison éther (chimie des groupes fonctionnels de PATAI) . p. 309–351. doi : 10.1002/9780470771075.ch7 . ISBN 9780470771075.
- ^ Salaun, Jacques (1983). "Hémiacétals de cyclopropanone". Critiques chimiques . 83 (6) : 619-632. doi : 10.1021/cr00058a002 .


