Potentiel membranaire - Membrane potential

Le potentiel membranaire (également potentiel transmembranaire ou tension membranaire ) est la différence de potentiel électrique entre l'intérieur et l'extérieur d'une cellule biologique . Pour l'extérieur de la cellule, les valeurs typiques de potentiel de membrane, normalement données en unités de milli volts et désignées comme mV, la plage de -40 mV à -80 mV.
Toutes les cellules animales sont entourées d'une membrane composée d'une bicouche lipidique contenant des protéines . La membrane sert à la fois d'isolant et de barrière de diffusion au mouvement des ions . Les protéines transmembranaires , également connues sous le nom de protéines de transport d'ions ou de pompes à ions , poussent activement les ions à travers la membrane et établissent des gradients de concentration à travers la membrane, et les canaux ioniques permettent aux ions de se déplacer à travers la membrane le long de ces gradients de concentration. Les pompes ioniques et les canaux ioniques sont électriquement équivalents à un ensemble de batteries et de résistances insérées dans la membrane, et créent donc une tension entre les deux côtés de la membrane.
Presque toutes les membranes plasmiques ont un potentiel électrique à travers elles, l'intérieur étant généralement négatif par rapport à l'extérieur. Le potentiel membranaire a deux fonctions de base. Premièrement, il permet à une cellule de fonctionner comme une batterie, fournissant de l'énergie pour faire fonctionner une variété de « dispositifs moléculaires » intégrés dans la membrane. Deuxièmement, dans les cellules électriquement excitables telles que les neurones et les cellules musculaires , il est utilisé pour transmettre des signaux entre différentes parties d'une cellule. Les signaux sont générés par l'ouverture ou la fermeture de canaux ioniques en un point de la membrane, produisant un changement local du potentiel membranaire. Ce changement dans le champ électrique peut être rapidement détecté par des canaux ioniques adjacents ou plus éloignés dans la membrane. Ces canaux ioniques peuvent alors s'ouvrir ou se fermer en raison du changement de potentiel, reproduisant le signal.
Dans les cellules non excitables et dans les cellules excitables dans leurs états de base, le potentiel membranaire est maintenu à une valeur relativement stable, appelée potentiel de repos . Pour les neurones, les valeurs typiques du potentiel de repos vont de –70 à –80 millivolts ; c'est-à-dire que l'intérieur d'une cellule a une tension de base négative d'un peu moins d'un dixième de volt. L'ouverture et la fermeture des canaux ioniques peuvent induire un écart par rapport au potentiel de repos. C'est ce qu'on appelle une dépolarisation si la tension intérieure devient moins négative (disons de -70 mV à -60 mV), ou une hyperpolarisation si la tension intérieure devient plus négative (disons de -70 mV à -80 mV). Dans les cellules excitables, une dépolarisation suffisamment importante peut évoquer un potentiel d'action , dans lequel le potentiel membranaire change rapidement et de manière significative pendant une courte période (de l'ordre de 1 à 100 millisecondes), inversant souvent sa polarité. Les potentiels d'action sont générés par l'activation de certains canaux ioniques voltage-dépendants .
Dans les neurones, les facteurs qui influencent le potentiel membranaire sont divers. Ils comprennent de nombreux types de canaux ioniques, dont certains sont chimiquement déclenchés et d'autres sont voltage-dépendants. Étant donné que les canaux ioniques voltage-dépendants sont contrôlés par le potentiel membranaire, alors que le potentiel membranaire lui-même est influencé par ces mêmes canaux ioniques, des boucles de rétroaction qui permettent une dynamique temporelle complexe se produisent, y compris des oscillations et des événements régénératifs tels que des potentiels d'action.
Base physique
Le potentiel de membrane dans une cellule dérive finalement de deux facteurs : la force électrique et la diffusion. La force électrique résulte de l'attraction mutuelle entre des particules de charges électriques opposées (positives et négatives) et de la répulsion mutuelle entre des particules de même type de charge (à la fois positives ou négatives). La diffusion résulte de la tendance statistique des particules à se redistribuer des régions où elles sont fortement concentrées vers les régions où la concentration est faible.
Tension
La tension, qui est synonyme de différence de potentiel électrique , est la capacité de conduire un courant électrique à travers une résistance. En effet, la définition la plus simple d'une tension est donnée par la loi d'Ohm : V=IR, où V est la tension, I est le courant et R est la résistance. Si une source de tension telle qu'une batterie est placée dans un circuit électrique, plus la tension de la source est élevée, plus la quantité de courant qu'elle conduira à travers la résistance disponible est élevée. La signification fonctionnelle de la tension réside uniquement dans les différences de potentiel entre deux points d'un circuit. L'idée d'une tension en un seul point n'a pas de sens. Il est classique en électronique d'attribuer une tension de zéro à un élément arbitrairement choisi du circuit, puis d'attribuer des tensions pour d'autres éléments mesurés par rapport à ce point zéro. L'élément choisi comme point zéro n'a aucune importance - la fonction d'un circuit ne dépend que des différences et non des tensions en soi . Cependant, dans la plupart des cas et par convention, le niveau zéro est le plus souvent affecté à la portion d'un circuit qui est en contact avec la masse.
Le même principe s'applique à la tension en biologie cellulaire. Dans les tissus électriquement actifs, la différence de potentiel entre deux points quelconques peut être mesurée en insérant une électrode à chaque point, par exemple une à l'intérieur et une à l'extérieur de la cellule, et en connectant les deux électrodes aux fils de ce qui est essentiellement un voltmètre spécialisé. Par convention, la valeur de potentiel zéro est affectée à l'extérieur de la cellule et le signe de la différence de potentiel entre l'extérieur et l'intérieur est déterminé par le potentiel de l'intérieur par rapport au zéro extérieur.
En termes mathématiques, la définition de la tension commence par le concept d'un champ électrique E , un champ vectoriel attribuant une amplitude et une direction à chaque point de l'espace. Dans de nombreuses situations, le champ électrique est un champ conservateur , ce qui signifie qu'il peut être exprimé comme le gradient d'une fonction scalaire V , c'est-à-dire E = –∇ V . Ce champ scalaire V est appelé distribution de tension. Notez que la définition permet une constante d'intégration arbitraire - c'est pourquoi les valeurs absolues de tension ne sont pas significatives. En général, les champs électriques ne peuvent être traités comme conservateurs que si les champs magnétiques ne les influencent pas de manière significative, mais cette condition s'applique généralement bien aux tissus biologiques.
Parce que le champ électrique est le gradient de la distribution de tension, des changements rapides de tension dans une petite région impliquent un champ électrique fort ; au contraire, si la tension reste approximativement la même sur une grande région, les champs électriques dans cette région doivent être faibles. Un fort champ électrique, équivalent à un fort gradient de tension, implique qu'une force forte est exercée sur toutes les particules chargées qui se trouvent dans la région.
Les ions et les forces entraînant leur mouvement

Les signaux électriques dans les organismes biologiques sont, en général, entraînés par des ions . Les cations les plus importants pour le potentiel d'action sont le sodium (Na + ) et le potassium (K + ). Les deux sont des cations monovalents qui portent une seule charge positive. Les potentiels d'action peuvent également impliquer le calcium (Ca 2+ ), qui est un cation divalent qui porte une double charge positive. L' anion chlorure (Cl − ) joue un rôle majeur dans les potentiels d'action de certaines algues , mais joue un rôle négligeable dans les potentiels d'action de la plupart des animaux.
Les ions traversent la membrane cellulaire sous deux influences : la diffusion et les champs électriques . Un exemple simple dans lequel deux solutions - A et B - sont séparées par une barrière poreuse illustre que la diffusion garantira qu'elles finiront par se mélanger en solutions égales. Ce mélange se produit en raison de la différence de leurs concentrations. La région à forte concentration diffusera vers la région à faible concentration. Pour étendre l'exemple, supposons que la solution A ait 30 ions sodium et 30 ions chlorure. De plus, la solution B ne contient que 20 ions sodium et 20 ions chlorure. En supposant que la barrière permette aux deux types d'ions de la traverser, alors un état stable sera atteint dans lequel les deux solutions contiennent 25 ions sodium et 25 ions chlorure. Si, cependant, la barrière poreuse est sélective vers laquelle les ions sont laissés passer, alors la diffusion seule ne déterminera pas la solution résultante. En revenant à l'exemple précédent, construisons maintenant une barrière perméable uniquement aux ions sodium. Désormais, seul le sodium est autorisé à diffuser à travers la barrière de sa concentration plus élevée dans la solution A à sa concentration plus faible dans la solution B. Cela entraînera une plus grande accumulation d'ions sodium que les ions chlorure dans la solution B et un nombre inférieur d'ions sodium que ions chlorure dans la solution A.
Cela signifie qu'il y a une charge positive nette dans la solution B due à la concentration plus élevée d'ions sodium chargés positivement que d'ions chlorure chargés négativement. De même, il existe une charge négative nette dans la solution A due à la plus grande concentration d'ions chlorure négatifs que d'ions sodium positifs. Étant donné que les charges opposées s'attirent et que les charges similaires se repoussent, les ions sont désormais également influencés par les champs électriques ainsi que par les forces de diffusion. Par conséquent, les ions sodium positifs seront moins susceptibles de se déplacer vers la solution B désormais plus positive et de rester dans la solution A désormais plus négative. Le point auquel les forces des champs électriques contrecarrent complètement la force due à la diffusion est appelé potentiel d'équilibre. À ce stade, le flux net de l'ion spécifique (dans ce cas le sodium) est nul.
Membranes plasmiques

Chaque cellule est enfermée dans une membrane plasmique , qui a la structure d'une bicouche lipidique contenant de nombreux types de grosses molécules. Parce qu'elle est constituée de molécules lipidiques, la membrane plasmique présente intrinsèquement une résistivité électrique élevée, c'est-à-dire une faible perméabilité intrinsèque aux ions. Cependant, certaines des molécules intégrées dans la membrane sont capables soit de transporter activement des ions d'un côté de la membrane à l'autre, soit de fournir des canaux à travers lesquels ils peuvent se déplacer.
Dans la terminologie électrique, la membrane plasmique fonctionne comme une résistance et un condensateur combinés . La résistance provient du fait que la membrane empêche le mouvement des charges à travers elle. La capacité provient du fait que la bicouche lipidique est si mince qu'une accumulation de particules chargées d'un côté donne lieu à une force électrique qui tire les particules de charge opposée vers l'autre côté. La capacité de la membrane est relativement peu affectée par les molécules qui y sont incrustées, elle a donc une valeur plus ou moins invariante estimée à environ 2 µF/cm 2 (la capacité totale d'un patch de membrane est proportionnelle à sa surface). En revanche, la conductance d'une bicouche lipidique pure est si faible que, dans les situations biologiques, elle est toujours dominée par la conductance de voies alternatives fournies par des molécules intégrées. Ainsi, la capacité de la membrane est plus ou moins fixe, mais la résistance est très variable.
L'épaisseur d'une membrane plasmique est estimée à environ 7-8 nanomètres. Parce que la membrane est si mince, il ne faut pas une très grande tension transmembranaire pour créer un fort champ électrique à l'intérieur. Les potentiels membranaires typiques des cellules animales sont de l'ordre de 100 millivolts (c'est-à-dire un dixième de volt), mais les calculs montrent que cela génère un champ électrique proche du maximum que la membrane peut supporter. une différence beaucoup plus grande que 200 millivolts pourrait provoquer une panne diélectrique , c'est-à-dire un arc électrique à travers la membrane.
Diffusion et transport facilités

La résistance d'une bicouche lipidique pure au passage des ions à travers elle est très élevée, mais les structures intégrées dans la membrane peuvent grandement améliorer le mouvement des ions, activement ou passivement , via des mécanismes appelés transport facilité et diffusion facilitée . Les deux types de structure qui jouent les rôles les plus importants sont les canaux ioniques et les pompes ioniques , tous deux généralement formés à partir d'assemblages de molécules de protéines. Les canaux ioniques fournissent des passages à travers lesquels les ions peuvent se déplacer. Dans la plupart des cas, un canal ionique n'est perméable qu'à des types spécifiques d'ions (par exemple, le sodium et le potassium mais pas le chlorure ou le calcium), et parfois la perméabilité varie en fonction de la direction du mouvement des ions. Les pompes ioniques, également connues sous le nom de transporteurs d'ions ou de protéines porteuses, transportent activement des types spécifiques d'ions d'un côté de la membrane à l'autre, parfois en utilisant pour ce faire l'énergie dérivée de processus métaboliques.
Pompes ioniques
Les pompes à ions sont des protéines membranaires intégrales qui assurent le transport actif , c'est-à-dire qu'elles utilisent l'énergie cellulaire (ATP) pour "pomper" les ions contre leur gradient de concentration. De telles pompes à ions aspirent des ions d'un côté de la membrane (en diminuant sa concentration là-bas) et les libèrent de l'autre côté (en augmentant sa concentration là-bas).
La pompe à ions la plus pertinente pour le potentiel d'action est la pompe sodium-potassium , qui transporte trois ions sodium hors de la cellule et deux ions potassium vers l' intérieur . En conséquence, la concentration d' ions potassium K + à l'intérieur du neurone est environ 20 fois supérieure. plus grande que la concentration extérieure, alors que la concentration de sodium à l'extérieur est environ neuf fois plus grande qu'à l'intérieur. De la même manière, d'autres ions ont des concentrations différentes à l'intérieur et à l'extérieur du neurone, comme le calcium , le chlorure et le magnésium .
Si les nombres de chaque type d'ions étaient égaux, la pompe sodium-potassium serait électriquement neutre, mais, en raison de l'échange trois pour deux, elle donne un mouvement net d'une charge positive de l'intracellulaire à l'extracellulaire pour chaque cycle, contribuant ainsi à une différence de tension positive. La pompe a trois effets : (1) elle rend la concentration de sodium élevée dans l'espace extracellulaire et faible dans l'espace intracellulaire ; (2) il rend la concentration de potassium élevée dans l'espace intracellulaire et faible dans l'espace extracellulaire ; (3) il donne à l'espace intracellulaire une tension négative par rapport à l'espace extracellulaire.
La pompe sodium-potassium est relativement lente en fonctionnement. Si une cellule était initialisée avec des concentrations égales de sodium et de potassium partout, il faudrait des heures à la pompe pour établir l'équilibre. La pompe fonctionne en permanence, mais devient progressivement moins efficace au fur et à mesure que les concentrations de sodium et de potassium disponibles pour le pompage diminuent.
Les pompes à ions n'influencent le potentiel d'action qu'en établissant le rapport relatif des concentrations d'ions intracellulaires et extracellulaires. Le potentiel d'action implique principalement l'ouverture et la fermeture des canaux ioniques et non des pompes ioniques. Si les pompes ioniques sont désactivées en supprimant leur source d'énergie ou en ajoutant un inhibiteur tel que l' ouabaïne , l'axone peut encore déclencher des centaines de milliers de potentiels d'action avant que leurs amplitudes ne commencent à décliner de manière significative. En particulier, les pompes ioniques ne jouent pas de rôle significatif dans la repolarisation de la membrane après un potentiel d'action.
Une autre pompe à ions fonctionnellement importante est l' échangeur sodium-calcium . Cette pompe fonctionne de manière conceptuellement similaire à la pompe sodium-potassium, sauf qu'à chaque cycle, elle échange trois Na + de l'espace extracellulaire contre un Ca ++ de l'espace intracellulaire. Parce que le flux net de charge est vers l'intérieur, cette pompe fonctionne "en descente", en effet, et ne nécessite donc aucune source d'énergie à l'exception de la tension de la membrane. Son effet le plus important est de pomper le calcium vers l'extérieur - il permet également un écoulement de sodium vers l'intérieur, contrecarrant ainsi la pompe sodium-potassium, mais, comme les concentrations globales de sodium et de potassium sont beaucoup plus élevées que les concentrations de calcium, cet effet est relativement peu important. Le résultat net de l'échangeur sodium-calcium est qu'à l'état de repos, les concentrations de calcium intracellulaire deviennent très faibles.
Canaux ioniques
Les canaux ioniques sont des protéines membranaires intégrales avec un pore à travers lequel les ions peuvent voyager entre l'espace extracellulaire et l'intérieur de la cellule. La plupart des canaux sont spécifiques (sélectifs) pour un ion ; par exemple, la plupart des canaux potassiques sont caractérisés par un rapport de sélectivité de 1000:1 pour le potassium par rapport au sodium, bien que les ions potassium et sodium aient la même charge et ne diffèrent que légèrement dans leur rayon. Le pore du canal est généralement si petit que les ions doivent le traverser en file indienne. Les pores des canaux peuvent être ouverts ou fermés pour le passage des ions, bien qu'un certain nombre de canaux présentent divers niveaux de sous-conductance. Lorsqu'un canal est ouvert, les ions pénètrent à travers le pore du canal le long du gradient de concentration transmembranaire pour cet ion particulier. Le débit du flux ionique à travers le canal, c'est-à-dire l'amplitude du courant monocanal, est déterminé par la conductance maximale du canal et la force motrice électrochimique pour cet ion, qui est la différence entre la valeur instantanée du potentiel de membrane et la valeur du potentiel d'inversion .
Un canal peut avoir plusieurs états différents (correspondant à différentes conformations de la protéine), mais chacun de ces états est soit ouvert, soit fermé. En général, les états fermés correspondent soit à une contraction du pore - le rendant infranchissable à l'ion - soit à une partie distincte de la protéine, bouchant le pore. Par exemple, le canal sodique voltage-dépendant subit une inactivation , dans laquelle une partie de la protéine bascule dans le pore, le scellant. Cette inactivation coupe le courant de sodium et joue un rôle critique dans le potentiel d'action.
Les canaux ioniques peuvent être classés selon la façon dont ils réagissent à leur environnement. Par exemple, les canaux ioniques impliqués dans le potentiel d'action sont des canaux sensibles au voltage ; ils s'ouvrent et se ferment en réponse à la tension à travers la membrane. Les canaux ligand-dépendants forment une autre classe importante ; ces canaux ioniques s'ouvrent et se ferment en réponse à la liaison d'une molécule de ligand , telle qu'un neurotransmetteur . D'autres canaux ioniques s'ouvrent et se ferment avec des forces mécaniques. D'autres canaux ioniques, tels que ceux des neurones sensoriels, s'ouvrent et se ferment en réponse à d'autres stimuli, tels que la lumière, la température ou la pression.
Canaux de fuite
Les canaux de fuite sont le type de canal ionique le plus simple, en ce sens que leur perméabilité est plus ou moins constante. Les types de canaux de fuite qui ont la plus grande importance dans les neurones sont les canaux potassium et chlorure. Même ceux-ci ne sont pas parfaitement constants dans leurs propriétés : Premièrement, la plupart d'entre eux sont dépendants de la tension dans le sens où ils conduisent mieux dans un sens que dans l'autre (en d'autres termes, ce sont des redresseurs ) ; deuxièmement, certains d'entre eux sont capables d'être bloqués par des ligands chimiques même s'ils n'ont pas besoin de ligands pour fonctionner.
Canaux Ligand-Gated
Les canaux ioniques ligand-dépendants sont des canaux dont la perméabilité est considérablement augmentée lorsqu'un certain type de ligand chimique se lie à la structure de la protéine. Les cellules animales en contiennent des centaines, voire des milliers. Un grand sous-ensemble fonctionne comme des récepteurs de neurotransmetteurs - ils se produisent au niveau des sites postsynaptiques , et le ligand chimique qui les contrôle est libéré par la terminaison axonale présynaptique . Un exemple de ce type est le récepteur AMPA , un récepteur du neurotransmetteur glutamate qui, lorsqu'il est activé, permet le passage des ions sodium et potassium. Un autre exemple est le GABA A récepteur , un récepteur pour le neurotransmetteur GABA qui , lorsqu'il est activé permet le passage des ions chlorure.
Les récepteurs des neurotransmetteurs sont activés par des ligands qui apparaissent dans la zone extracellulaire, mais il existe d'autres types de canaux ligand-dépendants qui sont contrôlés par des interactions du côté intracellulaire.
Canaux dépendant de la tension
Les canaux ioniques voltage-dépendants , également appelés canaux ioniques voltage-dépendants , sont des canaux dont la perméabilité est influencée par le potentiel membranaire. Ils forment un autre très grand groupe, chaque membre ayant une sélectivité ionique particulière et une dépendance à la tension particulière. Beaucoup dépendent également du temps - en d'autres termes, ils ne répondent pas immédiatement à un changement de tension mais seulement après un délai.
L'un des membres les plus importants de ce groupe est un type de canal sodique voltage-dépendant qui sous-tend les potentiels d'action - ceux-ci sont parfois appelés canaux sodiques de Hodgkin-Huxley car ils ont été initialement caractérisés par Alan Lloyd Hodgkin et Andrew Huxley dans études de la physiologie du potentiel d'action. Le canal est fermé au niveau de tension de repos, mais s'ouvre brutalement lorsque la tension dépasse un certain seuil, permettant un afflux important d'ions sodium qui produit une variation très rapide du potentiel membranaire. La récupération à partir d'un potentiel d'action dépend en partie d'un type de canal potassique voltage-dépendant qui est fermé au niveau de tension de repos mais s'ouvre en raison du grand changement de tension produit pendant le potentiel d'action.
Potentiel d'inversion
Le potentiel d'inversion (ou potentiel d'équilibre ) d'un ion est la valeur de la tension transmembranaire à laquelle les forces de diffusion et électriques s'équilibrent, de sorte qu'il n'y a pas de flux net d'ions à travers la membrane. Cela signifie que la tension transmembranaire s'oppose exactement à la force de diffusion de l'ion, de sorte que le courant net de l'ion à travers la membrane est nul et constant. Le potentiel d'inversion est important car il donne la tension qui agit sur les canaux perméables à cet ion - en d'autres termes, il donne la tension que le gradient de concentration ionique génère lorsqu'il agit comme une batterie .
Le potentiel d'équilibre d'un ion particulier est généralement désigné par la notation E ion . Le potentiel d'équilibre pour tout ion peut être calculé à l'aide de l' équation de Nernst . Par exemple, le potentiel d'inversion des ions potassium sera le suivant :
où
- E eq,K + est le potentiel d'équilibre du potassium, mesuré en volts
- R est la constante universelle des gaz , égale à 8,314 joules ·K −1 ·mol −1
- T est la température absolue , mesurée en kelvins (= K = degrés Celsius + 273,15)
- z est le nombre de charges élémentaires de l'ion en question impliquées dans la réaction
- F est la constante de Faraday , égale à 96 485 coulombs ·mol −1 ou J·V −1 ·mol −1
- [K + ] o est la concentration extracellulaire de potassium, mesurée en mol ·m -3 ou mmol.l -1
- [K + ] i est la concentration intracellulaire de potassium
Même si deux ions différents ont la même charge (c'est-à-dire K + et Na + ), ils peuvent toujours avoir des potentiels d'équilibre très différents, à condition que leurs concentrations extérieures et/ou intérieures diffèrent. Prenons, par exemple, les potentiels d'équilibre du potassium et du sodium dans les neurones. Le potentiel d'équilibre du potassium E K est de -84 mV avec 5 mM de potassium à l'extérieur et 140 mM à l'intérieur. D'autre part, le potentiel d'équilibre du sodium, E Na , est d'environ +66 mV avec environ 12 mM de sodium à l'intérieur et 140 mM à l'extérieur.
Modifications du potentiel membranaire au cours du développement
Le potentiel membranaire au repos d' un neurone change en fait au cours du développement d'un organisme. Pour qu'un neurone puisse finalement adopter sa pleine fonction adulte, son potentiel doit être étroitement régulé au cours du développement. Au fur et à mesure qu'un organisme progresse dans le développement, le potentiel membranaire au repos devient plus négatif. Les cellules gliales se différencient et prolifèrent également au fur et à mesure que le développement progresse dans le cerveau . L'ajout de ces cellules gliales augmente la capacité de l'organisme à réguler le potassium extracellulaire . La baisse du potassium extracellulaire peut conduire à une diminution du potentiel membranaire de 35 mV.
Excitabilité cellulaire
L'excitabilité cellulaire est la modification du potentiel membranaire nécessaire aux réponses cellulaires dans divers tissus. L'excitabilité cellulaire est une propriété induite au cours de l'embriogenèse précoce. L'excitabilité d'une cellule a également été définie comme la facilité avec laquelle une réponse peut être déclenchée. Les potentiels de repos et de seuil constituent la base de l'excitabilité cellulaire et ces processus sont fondamentaux pour la génération de potentiels gradués et d'action.
Les régulateurs les plus importants de l'excitabilité cellulaire sont les concentrations d' électrolytes extracellulaires (c'est-à-dire Na + , K + , Ca 2+ , Cl − , Mg 2+ ) et les protéines associées. Protéines importantes qui régulent l' excitabilité cellulaire sont des canaux ioniques voltage-dépendants , les transporteurs d'ions (par exemple Na + / K + -ATPase , les transporteurs de magnésium , les transporteurs acide-base ), récepteurs membranaires et hyperpolarisation activé canaux cycliques nucléotidiques-dépendants . Par exemple, les canaux potassiques et les récepteurs sensibles au calcium sont d'importants régulateurs de l'excitabilité des neurones , des myocytes cardiaques et de nombreuses autres cellules excitables comme les astrocytes . L'ion calcium est également le deuxième messager le plus important dans la signalisation cellulaire excitable . L'activation des récepteurs synaptiques initie des changements durables de l'excitabilité neuronale. Les hormones thyroïdiennes , surrénales et autres régulent également l'excitabilité des cellules, par exemple, la progestérone et les œstrogènes modulent l' excitabilité des cellules musculaires lisses du myomètre .
De nombreux types de cellules sont considérés comme ayant une membrane excitable. Les cellules excitables sont des neurones, myocytes (cardiaque, squelettique, lisser ), vasculaires cellules endothéliales , péricytes , cellules juxtaglomérulaires , cellules interstitielles de Cajal , de nombreux types de cellules épithéliales (par exemple , les cellules bêta , les cellules alpha , les cellules delta , cellules endocrines , les cellules neuroendocrines pulmonaires , les pinéalocytes ), les cellules gliales (par exemple les astrocytes), les cellules mécanoréceptrices (par exemple les cellules ciliées et les cellules de Merkel ), les cellules chimioréceptrices (par exemple les cellules du glomus , les récepteurs du goût ), certaines cellules végétales et éventuellement les cellules immunitaires . Les astrocytes présentent une forme d'excitabilité non électrique basée sur des variations calciques intracellulaires liées à l'expression de plusieurs récepteurs grâce auxquels ils peuvent détecter le signal synaptique. Dans les neurones, il existe différentes propriétés membranaires dans certaines parties de la cellule, par exemple, l'excitabilité dendritique confère aux neurones la capacité de détecter des coïncidences d'entrées spatialement séparées.
Circuit équivalent
Les électrophysiologistes modélisent les effets des différences de concentration ionique, des canaux ioniques et de la capacité membranaire en termes de circuit équivalent , qui est destiné à représenter les propriétés électriques d'un petit morceau de membrane. Le circuit équivalent est constitué d'un condensateur en parallèle avec quatre voies constituées chacune d'une batterie en série à conductance variable. La capacité est déterminée par les propriétés de la bicouche lipidique et est considérée comme fixe. Chacune des quatre voies parallèles provient de l'un des principaux ions, sodium, potassium, chlorure et calcium. Le voltage de chaque voie ionique est déterminé par les concentrations de l'ion de chaque côté de la membrane ; voir la section Potentiel d'inversion ci-dessus. La conductance de chaque voie ionique à tout moment est déterminée par les états de tous les canaux ioniques potentiellement perméables à cet ion, y compris les canaux de fuite, les canaux dépendants du ligand et les canaux ioniques dépendants du voltage.

Pour des concentrations d'ions fixes et des valeurs fixes de conductance de canal ionique, le circuit équivalent peut être encore réduit, en utilisant l' équation de Goldman comme décrit ci-dessous, à un circuit contenant une capacité en parallèle avec une batterie et une conductance. En termes électriques, il s'agit d'un type de circuit RC ( circuit résistance-capacité), et ses propriétés électriques sont très simples. À partir de n'importe quel état initial, le courant circulant à travers la conductance ou la capacité décroît avec une évolution temporelle exponentielle, avec une constante de temps de = RC , où C est la capacité du patch de membrane, et R = 1/g net est la résistance nette. Pour des situations réalistes, la constante de temps se situe généralement entre 1 et 100 millisecondes. Dans la plupart des cas, les changements dans la conductance des canaux ioniques se produisent sur une échelle de temps plus rapide, donc un circuit RC n'est pas une bonne approximation ; cependant, l'équation différentielle utilisée pour modéliser un patch de membrane est généralement une version modifiée de l'équation du circuit RC.
Potentiel de repos
Lorsque le potentiel membranaire d'une cellule dure longtemps sans changer de manière significative, on parle de potentiel de repos ou de tension de repos. Ce terme est utilisé pour le potentiel membranaire des cellules non excitables, mais aussi pour le potentiel membranaire des cellules excitables en l'absence d'excitation. Dans les cellules excitables, les autres états possibles sont des potentiels membranaires gradués (d'amplitude variable) et des potentiels d'action, qui sont importants, des augmentations tout ou rien du potentiel membranaire qui suivent généralement un cours de temps fixe. Les cellules excitables comprennent les neurones , les cellules musculaires et certaines cellules sécrétoires dans les glandes . Même dans d'autres types de cellules, cependant, la tension membranaire peut subir des changements en réponse à des stimuli environnementaux ou intracellulaires. Par exemple, la dépolarisation de la membrane plasmique semble être une étape importante dans la mort cellulaire programmée .
Les interactions qui génèrent le potentiel de repos sont modélisées par l' équation de Goldman . Celle-ci est similaire dans sa forme à l'équation de Nernst présentée ci-dessus, en ce qu'elle est basée sur les charges des ions en question, ainsi que sur la différence entre leurs concentrations intérieure et extérieure. Cependant, il prend également en considération la perméabilité relative de la membrane plasmique à chaque ion en question.
Les trois ions qui apparaissent dans cette équation sont le potassium (K + ), le sodium (Na + ) et le chlorure (Cl − ). Le calcium est omis, mais peut être ajouté pour faire face aux situations dans lesquelles il joue un rôle important. Étant un anion, les termes chlorure sont traités différemment des termes cations ; la concentration intracellulaire est dans le numérateur, et la concentration extracellulaire dans le dénominateur, qui est inversée par rapport aux termes cationiques. P i représente la perméabilité relative de l'ion de type i.
En substance, la formule de Goldman exprime le potentiel de membrane comme une moyenne pondérée des potentiels d'inversion pour les types d'ions individuels, pondérés par la perméabilité. (Bien que le potentiel membranaire change d'environ 100 mV au cours d'un potentiel d'action, les concentrations d'ions à l'intérieur et à l'extérieur de la cellule ne changent pas de manière significative. Elles restent proches de leurs concentrations respectives lorsque la membrane est alors au potentiel de repos.) Dans la plupart des cellules animales, le la perméabilité au potassium est beaucoup plus élevée au repos que la perméabilité au sodium. En conséquence, le potentiel de repos est généralement proche du potentiel d'inversion du potassium. La perméabilité au chlorure peut être suffisamment élevée pour être significative, mais contrairement aux autres ions, le chlorure n'est pas activement pompé et s'équilibre donc à un potentiel d'inversion très proche du potentiel de repos déterminé par les autres ions.
Les valeurs du potentiel membranaire au repos dans la plupart des cellules animales varient généralement entre le potentiel d'inversion du potassium (généralement autour de -80 mV) et autour de -40 mV. Le potentiel de repos dans les cellules excitables (capables de produire des potentiels d'action) est généralement proche de -60 mV - des tensions plus dépolarisées conduiraient à une génération spontanée de potentiels d'action. Les cellules immatures ou indifférenciées présentent des valeurs très variables de tension au repos, généralement significativement plus positives que dans les cellules différenciées. Dans de telles cellules, la valeur du potentiel au repos est en corrélation avec le degré de différenciation : les cellules indifférenciées dans certains cas peuvent ne présenter aucune différence de tension transmembranaire.
Le maintien du potentiel de repos peut être métaboliquement coûteux pour une cellule en raison de son exigence de pompage actif d'ions pour contrer les pertes dues aux canaux de fuite. Le coût est le plus élevé lorsque la fonction de la cellule nécessite une valeur de tension membranaire particulièrement dépolarisée. Par exemple, le potentiel de repos dans la lumière du jour adapté blowfly ( Calliphora vicina ) photorécepteurs peut être aussi élevée que -30 mV. Ce potentiel membranaire élevé permet aux cellules de répondre très rapidement aux entrées visuelles ; le coût est que le maintien du potentiel de repos peut consommer plus de 20 % de l' ATP cellulaire global .
D'autre part, le potentiel de repos élevé dans les cellules indifférenciées n'entraîne pas nécessairement un coût métabolique élevé. Ce paradoxe apparent est résolu par l'examen de l'origine de ce potentiel de repos. Les cellules peu différenciées sont caractérisées par une résistance d'entrée extrêmement élevée, ce qui implique que peu de canaux de fuite sont présents à ce stade de la vie de la cellule. Comme résultat apparent, la perméabilité du potassium devient similaire à celle des ions sodium, ce qui place le potentiel de repos entre les potentiels d'inversion pour le sodium et le potassium comme discuté ci-dessus. Les courants de fuite réduits signifient également qu'il y a peu de besoin de pompage actif pour compenser, donc un faible coût métabolique.
Potentiels gradués
Comme expliqué ci-dessus, le potentiel en tout point de la membrane d'une cellule est déterminé par les différences de concentration en ions entre les zones intracellulaire et extracellulaire, et par la perméabilité de la membrane à chaque type d'ion. Les concentrations d'ions ne changent normalement pas très rapidement (à l'exception de Ca 2+ , où la concentration intracellulaire de base est si faible que même un petit afflux peut l'augmenter de plusieurs ordres de grandeur), mais les perméabilités des ions peuvent changer dans un fraction de milliseconde, à la suite de l'activation des canaux ioniques ligand-dépendants. Le changement de potentiel membranaire peut être grand ou petit, selon le nombre de canaux ioniques activés et leur type, et peut être long ou court, selon la durée pendant laquelle les canaux restent ouverts. Les changements de ce type sont appelés potentiels gradués , contrairement aux potentiels d'action, qui ont une amplitude et une durée fixes.
Comme on peut le déduire de l' équation de Goldman montrée ci-dessus, l'effet de l'augmentation de la perméabilité d'une membrane à un type particulier d'ion déplace le potentiel de la membrane vers le potentiel d'inversion pour cet ion. Ainsi, l'ouverture des canaux Na + déplace le potentiel membranaire vers le potentiel d'inversion Na + , qui se situe généralement autour de +100 mV. De même, l'ouverture des canaux K + déplace le potentiel membranaire vers environ -90 mV, et l'ouverture des canaux Cl - le déplace vers environ -70 mV (potentiel de repos de la plupart des membranes). Ainsi, les canaux Na + déplacent le potentiel membranaire dans le sens positif, les canaux K + le déplacent dans le sens négatif (sauf lorsque la membrane est hyperpolarisée à une valeur plus négative que le potentiel d'inversion K + ), et les canaux Cl − ont tendance à se déplacer vers le potentiel de repos.
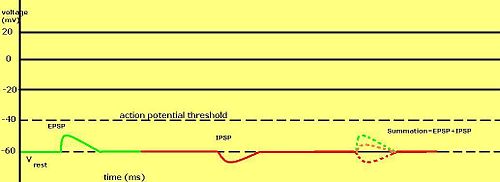
Les potentiels membranaires gradués sont particulièrement importants dans les neurones , où ils sont produits par les synapses — un changement temporaire du potentiel membranaire produit par l'activation d'une synapse par un seul potentiel gradué ou d'action est appelé potentiel postsynaptique . Les neurotransmetteurs qui agissent pour ouvrir les canaux Na + rendent généralement le potentiel membranaire plus positif, tandis que les neurotransmetteurs qui activent les canaux K + le rendent généralement plus négatif; ceux qui inhibent ces canaux ont tendance à avoir l'effet inverse.
Le fait qu'un potentiel postsynaptique soit considéré comme excitateur ou inhibiteur dépend du potentiel d'inversion des ions de ce courant et du seuil pour que la cellule déclenche un potentiel d'action (environ -50 mV). Un courant postsynaptique avec un potentiel d'inversion supérieur au seuil, tel qu'un courant Na + typique , est considéré comme excitateur. Un courant avec un potentiel d'inversion inférieur au seuil, tel qu'un courant K + typique , est considéré comme inhibiteur. Un courant avec un potentiel d'inversion au-dessus du potentiel de repos, mais en dessous du seuil, ne provoquera pas par lui-même des potentiels d'action, mais produira des oscillations de potentiel de membrane sous le seuil . Ainsi, les neurotransmetteurs qui agissent pour ouvrir les canaux Na + produisent des potentiels postsynaptiques excitateurs , ou EPSP, tandis que les neurotransmetteurs qui agissent pour ouvrir les canaux K + ou Cl - produisent généralement des potentiels postsynaptiques inhibiteurs , ou IPSP. Lorsque plusieurs types de canaux sont ouverts au cours de la même période, leurs potentiels postsynaptiques s'additionnent (s'additionnent).
Autres valeurs
Du point de vue de la biophysique, le potentiel membranaire au repos est simplement le potentiel membranaire qui résulte des perméabilités membranaires qui prédominent lorsque la cellule est au repos. L'équation ci-dessus des moyennes pondérées s'applique toujours, mais l'approche suivante peut être plus facilement visualisée. À un moment donné, il existe deux facteurs pour un ion qui déterminent l'influence que cet ion aura sur le potentiel membranaire d'une cellule :
- La force motrice de cet ion
- La perméabilité de cet ion
Si la force motrice est élevée, alors l'ion est « poussé » à travers la membrane. Si la perméabilité est élevée, il sera plus facile pour l'ion de diffuser à travers la membrane.
- La force motrice est la force électrique nette disponible pour déplacer cet ion à travers la membrane. Il est calculé comme la différence entre la tension à laquelle l'ion « veut » être (son potentiel d'équilibre) et le potentiel membranaire réel ( E m ). Donc, en termes formels, la force motrice pour un ion = E m - E ion
- Par exemple, à notre potentiel de repos calculé précédemment de −73 mV, la force motrice sur le potassium est de 7 mV : (−73 mV) − (−80 mV) = 7 mV. La force motrice sur le sodium serait (−73 mV) − (60 mV) = −133 mV.
- La perméabilité est une mesure de la facilité avec laquelle un ion peut traverser la membrane. Elle est normalement mesurée comme la conductance (électrique) et l'unité, siemens , correspond à 1 C.s -1 .V -1 , soit un coulomb par seconde par volt de potentiel.
Ainsi, dans une membrane au repos, alors que la force motrice du potassium est faible, sa perméabilité est très élevée. Le sodium a une force motrice énorme mais presque aucune perméabilité au repos. Dans ce cas, le potassium transporte environ 20 fois plus de courant que le sodium et a donc 20 fois plus d'influence sur E m que le sodium.
Cependant, considérons un autre cas : le pic du potentiel d'action. Ici, la perméabilité au Na est élevée et la perméabilité au K est relativement faible. Ainsi, la membrane se déplace vers E Na et loin de E K .
Plus il y a d'ions perméants, plus il devient compliqué de prédire le potentiel membranaire. Cependant, cela peut être fait en utilisant l' équation de Goldman-Hodgkin-Katz ou l'équation des moyennes pondérées. En branchant à tout instant les gradients de concentration et les perméabilités des ions, on peut déterminer le potentiel membranaire à cet instant. Ce que signifient les équations GHK, c'est qu'à tout moment, la valeur du potentiel de membrane sera une moyenne pondérée des potentiels d'équilibre de tous les ions perméants. La « pondération » est la perméabilité relative des ions à travers la membrane.
Effets et implications
Alors que les cellules dépensent de l'énergie pour transporter des ions et établir un potentiel transmembranaire, elles utilisent à leur tour ce potentiel pour transporter d'autres ions et métabolites tels que le sucre. Le potentiel transmembranaire des mitochondries entraîne la production d' ATP , qui est la monnaie commune de l'énergie biologique.
Les cellules peuvent puiser dans l'énergie qu'elles stockent dans le potentiel de repos pour générer des potentiels d'action ou d'autres formes d'excitation. Ces changements dans le potentiel membranaire permettent la communication avec d'autres cellules (comme avec les potentiels d'action) ou initient des changements à l'intérieur de la cellule, ce qui se produit dans un ovule lorsqu'il est fécondé par un spermatozoïde .
Dans les cellules neuronales, un potentiel d'action commence par un afflux d'ions sodium dans la cellule par les canaux sodiques, entraînant une dépolarisation, tandis que la récupération implique un afflux de potassium vers l'extérieur par les canaux potassiques. Ces deux flux se produisent par diffusion passive .
Voir également
- Bioélectrochimie
- Potentiel électrochimique
- Équation de Goldman
- Biophysique membranaire
- Réseau de microélectrodes
- Conduction saltatoire
- Potentiel de surface
- Effet Gibbs-Donnan
- Potentiel synaptique
Remarques
- ^ Notez que les signes de E Na et E K sont opposés. En effet, le gradient de concentration du potassium est dirigé hors de la cellule, tandis que le gradient de concentration du sodium est dirigé vers la cellule. Les potentiels membranaires sont définis par rapport à l'extérieur de la cellule ; ainsi, un potentiel de -70 mV implique que l'intérieur de la cellule est négatif par rapport à l'extérieur.
Les références
Lectures complémentaires
- Alberts et al. Biologie moléculaire de la cellule . Édition de guirlande ; 4e édition Bk&Cdr (mars 2002). ISBN 0-8153-3218-1 . Niveau premier cycle.
- Guyton, Arthur C., John E. Hall. Manuel de physiologie médicale . Société WB Saunders ; 10e édition (15 août 2000). ISBN 0-7216-8677-X . Niveau de premier cycle.
- Hille, B. Canal ionique des membranes excitables Sinauer Associates, Sunderland, MA, États-Unis ; 1ère édition, 1984. ISBN 0-87893-322-0
- Nicholls, JG, Martin, AR et Wallace, BG Du neurone au cerveau Sinauer Associates, Inc. Sunderland, MA, États-Unis 3e édition, 1992. ISBN 0-87893-580-0
- Ove-Sten Knudsen. Membranes biologiques : théorie du transport, potentiels et impulsions électriques . Cambridge University Press (26 septembre 2002). ISBN 0-521-81018-3 . Niveau d'études supérieures.
- Série médicale nationale pour étude indépendante. Physiologie . Lippincott Williams & Wilkins. Philadelphie, PA, États-Unis 4e édition, 2001. ISBN 0-683-30603-0






![E_{eq,K^+} = \frac{RT}{zF} \ln \frac{[K^+]_{o}}{[K^+]_{i}} ,](https://wikimedia.org/api/rest_v1/media/math/render/svg/b7eb1afcc5d7a5032ff24be5c403b43b1307b01e)

![E_{m} = \frac{RT}{F} \ln{ \left( \frac{ P_{\mathrm{K}}[\mathrm{K}^{+}]_\mathrm{out} + P_{ \mathrm{Na}}[\mathrm{Na}^{+}]_\mathrm{out} + P_{\mathrm{Cl}}[\mathrm{Cl}^{-}]_\mathrm{in}} { P_{\mathrm{K}}[\mathrm{K}^{+}]_\mathrm{in} + P_{\mathrm{Na}}[\mathrm{Na}^{+}]_\mathrm{ in} + P_{\mathrm{Cl}}[\mathrm{Cl}^{-}]_\mathrm{out}} \right) }](https://wikimedia.org/api/rest_v1/media/math/render/svg/4b29151571b6fb807674bf342d01f178908a1a98)