Microglie - Microglia
| Microglie | |
|---|---|
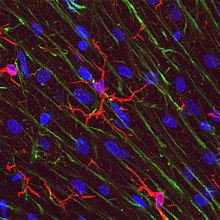
 Microglie à l'état de repos du cortex de rat avant une lésion cérébrale traumatique (coloration de lectine avec HRP )
| |
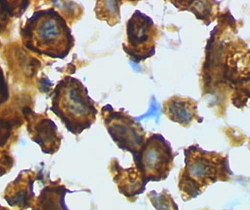 Microglie/macrophage - forme activée du cortex de rat après un traumatisme crânien (coloration de la lectine avec HRP)
| |
| Des détails | |
| Précurseur | Macrophage primitif dérivé du sac vitellin |
| Système | Système nerveux central |
| Identifiants | |
| Engrener | D017628 |
| E | H2.00.06.2.00004, H2.00.06.2.01025 |
| FMA | 54539 |
|
Termes anatomiques de la microanatomie | |
La microglie est un type de névroglie (cellule gliale) située dans tout le cerveau et la moelle épinière . La microglie représente 10 à 15 % de toutes les cellules présentes dans le cerveau. En tant que cellules macrophages résidentes , elles agissent comme la première et principale forme de défense immunitaire active dans le système nerveux central (SNC). La microglie (et d'autres névroglies, y compris les astrocytes ) sont réparties dans de grandes régions sans chevauchement dans tout le SNC. Les microglies sont des cellules clés dans l'entretien général du cerveau - elles nettoient constamment le SNC à la recherche de plaques , de neurones et de synapses endommagés ou inutiles et d'agents infectieux. Étant donné que ces processus doivent être efficaces pour éviter des dommages potentiellement mortels, la microglie est extrêmement sensible aux changements pathologiques, même minimes, du SNC. Cette sensibilité est obtenue en partie par la présence de canaux potassiques uniques qui répondent à même de petits changements dans le potassium extracellulaire . Des preuves récentes montrent que la microglie est également un acteur clé dans le maintien des fonctions cérébrales normales dans des conditions saines. La microglie surveille également en permanence les fonctions neuronales par le biais de contacts somatiques directs et exerce des effets neuroprotecteurs en cas de besoin.
Le cerveau et la moelle épinière, qui constituent le SNC, ne sont généralement pas accessibles directement par des facteurs pathogènes dans la circulation corporelle en raison d'une série de cellules endothéliales connues sous le nom de barrière hémato-encéphalique ou BHE. La BHE empêche la plupart des infections d'atteindre les tissus nerveux vulnérables. Dans le cas où des agents infectieux sont directement introduits dans le cerveau ou traversent la barrière hémato-encéphalique, les cellules microgliales doivent réagir rapidement pour diminuer l' inflammation et détruire les agents infectieux avant qu'ils n'endommagent le tissu nerveux sensible. En raison du manque d' anticorps du reste du corps (peu d'anticorps sont assez petits pour traverser la barrière hémato-encéphalique), la microglie doit être capable de reconnaître les corps étrangers, de les avaler et d'agir comme des cellules présentatrices d'antigène activant les lymphocytes T .
Formes
Les cellules microgliales sont extrêmement plastiques et subissent une variété de changements structurels en fonction de l'emplacement et des besoins du système. Ce niveau de plasticité est nécessaire pour remplir la grande variété de fonctions remplies par la microglie. La capacité de transformation distingue la microglie des macrophages , qui doivent être remplacés régulièrement, et leur donne la capacité de défendre le SNC dans un délai extrêmement court sans provoquer de perturbation immunologique. Les microglies adoptent une forme spécifique, ou phénotype , en réponse aux conditions locales et aux signaux chimiques qu'elles ont détectés.
Génétique sensuelle
Le sensome microglial est un concept biologique relativement nouveau qui semble jouer un rôle important dans le neurodéveloppement et la neurodégénérescence . Le sensome fait référence au regroupement unique de transcrits protéiques utilisés pour détecter les ligands et les microbes . En d'autres termes, le sensome représente les gènes nécessaires aux protéines utilisées pour détecter les molécules dans le corps. Le sensome peut être analysé avec une variété de méthodes, y compris la qPCR , l' ARN-seq , l' analyse de microarray et le séquençage direct de l'ARN. Les gènes inclus dans le sensome codent pour des récepteurs et des protéines transmembranaires sur la membrane plasmique qui sont plus fortement exprimés dans la microglie que dans les neurones. Il n'inclut pas les protéines sécrétées ou les protéines transmembranaires spécifiques aux organites liés à la membrane, tels que le noyau , les mitochondries et le réticulum endoplasmique . La pluralité de gènes sensomes identifiés codent pour les récepteurs de reconnaissance de formes, cependant, il existe une grande variété de gènes inclus. Les microglies partagent un sensome similaire aux autres macrophages, mais elles contiennent 22 gènes uniques, dont 16 sont utilisés pour l'interaction avec des ligands endogènes. Ces différences créent un biomarqueur microglial unique qui comprend plus de 40 gènes, dont P2ry12 et HEXB . DAP12 semble jouer un rôle important dans l'interaction des protéines sensorielles, agissant comme un adaptateur de signalisation et une protéine régulatrice.
La régulation des gènes au sein du sensome doit pouvoir changer afin de répondre aux dommages potentiels. La microglie peut assumer un rôle de neuroprotection ou de neurotoxicité afin de faire face à ces dangers. Pour ces raisons, on soupçonne que le sensome pourrait jouer un rôle dans la neurodégénérescence. Les gènes sensomes qui sont régulés à la hausse avec le vieillissement sont principalement impliqués dans la détection des ligands microbiens infectieux, tandis que ceux qui sont régulés à la baisse sont principalement impliqués dans la détection des ligands endogènes. Cette analyse suggère une régulation spécifique de la glie favorisant la neuroprotection dans la neurodégénérescence naturelle. Cela contraste avec l'évolution vers la neurotoxicité observée dans les maladies neurodégénératives.
Le sensome peut également jouer un rôle dans le neurodéveloppement. Une infection cérébrale au début de la vie entraîne une microglie hypersensible aux stimuli immunitaires ultérieurs. Lorsqu'ils sont exposés à une infection, il y a une régulation positive des gènes sensomes impliqués dans la neuroinflammation et une régulation négative des gènes impliqués dans la neuroplasticité. La capacité du sensome à modifier le développement neurologique peut cependant être en mesure de lutter contre la maladie. La suppression de CX3CL1 , un gène sensome hautement exprimé, dans des modèles de rongeurs du syndrome de Rett a entraîné une amélioration de la santé et une durée de vie plus longue. La régulation négative de Cx 3 cr1 chez les humains sans syndrome de Rett est associée à des symptômes similaires à ceux de la schizophrénie . Cela suggère que le sensome joue non seulement un rôle dans divers troubles du développement, mais nécessite également une régulation stricte afin de maintenir un état sans maladie.
Ramifié
Cette forme de cellule microgliale se trouve couramment à des endroits spécifiques dans tout le cerveau et la moelle épinière en l'absence de matière étrangère ou de cellules mourantes. Cette forme "au repos" de microglie est composée de longs processus de ramification et d'un petit corps cellulaire. Contrairement aux formes amiboïdes de la microglie, le corps cellulaire de la forme ramifiée reste en place tandis que ses branches se déplacent constamment et surveillent la zone environnante. Les rameaux sont très sensibles aux petits changements d'état physiologique et nécessitent des conditions de culture très spécifiques pour être observés in vitro .
Contrairement aux microglies activées ou amiboïdes, les microglies ramifiées ne phagocytent pas les cellules et sécrètent moins d'immunomolécules (dont les protéines du CMH de classe I / II ). La microglie dans cet état est capable de rechercher et d'identifier les menaces immunitaires tout en maintenant l'homéostasie dans le SNC. Bien que cela soit considéré comme l'état de repos, les microglies sous cette forme sont toujours extrêmement actives dans l'étude chimique de l'environnement. La microglie ramifiée peut être transformée en forme activée à tout moment en réponse à une blessure ou à une menace.
Réactif (Activé)
Bien qu'historiquement fréquemment utilisé, le terme microglie "activée" devrait être remplacé par microglie "réactive". En effet, les microglies apparemment au repos ne sont pas dépourvues de fonctions actives et le terme « activation » est trompeur car il tend à indiquer une polarisation « tout ou rien » de la réactivité cellulaire. Le marqueur Iba1 , régulé positivement dans la microglie réactive, est souvent utilisé pour visualiser ces cellules.
Non phagocytaire
Cet état fait en fait partie d'une réponse graduelle lorsque la microglie passe de sa forme ramifiée à sa forme phagocytaire pleinement active. La microglie peut être activée par divers facteurs, notamment : les cytokines pro-inflammatoires , les facteurs de nécrose cellulaire , les lipopolysaccharides et les modifications du potassium extracellulaire (indiquant des cellules rompues). Une fois activées, les cellules subissent plusieurs changements morphologiques clés, notamment l'épaississement et la rétraction des branches, l'absorption des protéines du CMH de classe I/II, l'expression d'immunomolécules, la sécrétion de facteurs cytotoxiques , la sécrétion de molécules de recrutement et la sécrétion de molécules de signalisation pro-inflammatoires (résultant dans une cascade de signaux pro-inflammatoires). Les microglies non phagocytaires activées apparaissent généralement sous la forme de « buissonnantes », de « tiges » ou de petites amiboïdes en fonction de la distance parcourue le long du continuum de transformation phagocytaire ramifiée à complète. De plus, les microglies subissent également une prolifération rapide afin d'augmenter leur nombre. D'un point de vue strictement morphologique, la variation de la forme microgliale le long du continuum est associée à l'évolution de la complexité morphologique et peut être quantifiée à l'aide des méthodes d'analyse fractale, qui se sont avérées sensibles aux changements même subtils et visuellement indétectables associés à différentes morphologies dans différents états pathologiques. .
Phagocytaire
La microglie phagocytaire activée est la forme de microglie à réponse immunitaire maximale. Ces cellules prennent généralement une grande forme amiboïde, bien que certaines variations aient été observées. En plus d'avoir la signalisation de présentation d'antigène, cytotoxique et de médiation de l'inflammation de la microglie non phagocytaire activée, ils sont également capables de phagocyter des matières étrangères et d'afficher les immunomolécules résultantes pour l' activation des lymphocytes T. La microglie phagocytaire se rend sur le site de la blessure, engloutit le matériel incriminé et sécrète des facteurs pro-inflammatoires pour favoriser la prolifération de plus de cellules et faire de même. La microglie phagocytaire activée interagit également avec les astrocytes et les cellules neurales pour combattre toute infection ou inflammation le plus rapidement possible avec un minimum de dommages aux cellules cérébrales saines.
amiboïde
Cette forme permet à la microglie de se déplacer librement dans tout le tissu neural, ce qui lui permet de remplir son rôle de cellule charognarde. La microglie amiboïde est capable de phagocyter les débris, mais ne remplit pas les mêmes rôles de présentation d'antigène et d'inflammation que la microglie activée . Les microglies amiboïdes sont particulièrement répandues pendant le développement et le recâblage du cerveau, lorsqu'il y a de grandes quantités de débris extracellulaires et de cellules apoptotiques à éliminer. Cette forme de cellule microgliale se trouve principalement dans les zones périnatales de la substance blanche du corps calleux connues sous le nom de « Fontaines de la microglie ».
Cellules Gitter
Les cellules Gitter sont le résultat final de la phagocytose des cellules microgliales de matériel infectieux ou de débris cellulaires. Finalement, après avoir englouti une certaine quantité de matériel, la cellule microgliale phagocytaire devient incapable de phagocyter d'autres matériaux. La masse cellulaire résultante est connue sous le nom de corpuscule granulaire, du nom de son aspect « granuleux ». En examinant les tissus colorés pour révéler les cellules gitter, les pathologistes peuvent visualiser les zones guéries après l'infection.
périvasculaire
Contrairement aux autres types de microglie mentionnés ci-dessus, la microglie "périvasculaire" fait référence à l'emplacement de la cellule plutôt qu'à sa forme/fonction. Les microglies périvasculaires se trouvent principalement enfermées dans les parois de la lame basale . Ils remplissent des fonctions microgliales normales, mais, contrairement à la microglie normale, ils sont régulièrement remplacés par des cellules précurseurs dérivées de la moelle osseuse et expriment des antigènes du CMH de classe II quel que soit leur environnement. La microglie périvasculaire réagit également fortement aux antigènes de différenciation des macrophages. Ces microglies se sont avérées essentielles pour la réparation des parois vasculaires , comme le montrent les expériences et les observations de Ritter sur la rétinopathie ischémique . La microglie périvasculaire favorise la prolifération des cellules endothéliales , permettant la formation de nouveaux vaisseaux et la réparation des vaisseaux endommagés. Au cours de ces processus, le recrutement et la différenciation myéloïdes en cellules microgliales sont fortement accélérés pour accomplir ces tâches.
Juxtavasculaire
Comme la microglie périvasculaire, la microglie juxtavasculaire se distingue principalement par sa localisation. Les microglies juxtavasculaires se trouvent en contact direct avec la paroi de la lame basale des vaisseaux sanguins, mais ne se trouvent pas à l'intérieur des parois. Comme les cellules périvasculaires, elles expriment les protéines du CMH de classe II même à de faibles niveaux d' activité des cytokines inflammatoires . Contrairement aux cellules périvasculaires, mais similaires à la microglie résidente, la microglie juxtavasculaire ne présente pas de renouvellement rapide ou de remplacement régulier par des cellules précurseurs myéloïdes .
Les fonctions

Les cellules microgliales remplissent une variété de tâches différentes au sein du SNC, principalement liées à la fois à la réponse immunitaire et au maintien de l'homéostasie. Voici quelques-unes des principales fonctions connues exécutées par ces cellules.
Balayage
En plus d'être très sensible aux petits changements dans leur environnement, chaque cellule microgliale surveille également physiquement son domaine de manière régulière. Cette action est réalisée dans les états amiboïde et au repos. En se déplaçant dans sa région définie, si la cellule microgliale trouve un matériau étranger, des cellules endommagées, des cellules apoptotiques , des enchevêtrements neurofibrillaires , des fragments d'ADN ou des plaques, elle activera et phagocytera le matériau ou la cellule. De cette manière, les cellules microgliales agissent également comme des « femmes de ménage », nettoyant les débris cellulaires aléatoires. Au cours du câblage du développement du cerveau, les cellules microgliales jouent un rôle important dans la régulation du nombre de cellules précurseurs neurales et l'élimination des neurones apoptotiques. Il existe également des preuves que la microglie peut affiner les circuits synaptiques en engloutissant et en éliminant les synapses. Après le développement, la majorité des cellules mortes ou apoptotiques se trouvent dans le cortex cérébral et la substance blanche sous-corticale . Cela peut expliquer pourquoi la majorité des cellules microgliales amiboïdes se trouvent dans les « fontaines de microglie » dans le cortex cérébral.
Phagocytose
Le rôle principal de la microglie, la phagocytose , implique l'engloutissement de divers matériaux. Les matériaux engloutis sont généralement constitués de débris cellulaires, de lipides et de cellules apoptotiques à l'état non enflammé, et de virus envahissants , de bactéries ou d'autres matières étrangères à l'état enflammé. Une fois que la cellule microgliale est "pleine", elle arrête l' activité phagocytaire et se transforme en une cellule gitter relativement non réactive .
Signalisation extracellulaire
Une grande partie du rôle des cellules microgliales dans le cerveau est de maintenir l' homéostasie dans les régions non infectées et de favoriser l' inflammation dans les tissus infectés ou endommagés. La microglie accomplit cela grâce à une série extrêmement compliquée de molécules de signalisation extracellulaires qui leur permettent de communiquer avec d'autres microglies, astrocytes , nerfs , lymphocytes T et cellules progénitrices myéloïdes . Comme mentionné ci-dessus, la cytokine IFN-γ peut être utilisée pour activer les cellules microgliales. De plus, après avoir été activée par l'IFN-γ, la microglie libère également plus d'IFN-γ dans l'espace extracellulaire. Cela active plus de microglies et démarre une cascade d'activation induite par les cytokines activant rapidement toutes les microglies voisines. Le TNF-α produit par la microglie provoque l' apoptose du tissu neural et augmente l'inflammation. L'IL-8 favorise la croissance et la différenciation des cellules B , ce qui lui permet d'aider la microglie à combattre l'infection. Une autre cytokine, IL-1 , inhibe les cytokines IL-10 et TGF-β , qui régulent négativement la présentation de l'antigène et la signalisation pro-inflammatoire. Des cellules dendritiques et des cellules T supplémentaires sont recrutées sur le site de la lésion par la production microgliale de molécules chimiotactiques telles que MDC , IL-8 et MIP-3β . Enfin, la PGE 2 et d'autres prostanoïdes préviennent l'inflammation chronique en inhibant la réponse pro-inflammatoire microgliale et en régulant négativement la réponse Th1 (cellule T auxiliaire).
Présentation de l'antigène
Comme mentionné ci-dessus, les microglies résidentes non activées agissent comme de mauvaises cellules présentatrices d'antigène en raison de leur manque de protéines du CMH de classe I/II. Lors de l'activation, ils absorbent rapidement les protéines du CMH de classe I/II et deviennent rapidement des présentateurs d'antigènes efficaces. Dans certains cas, la microglie peut également être activée par l'IFN-γ pour présenter des antigènes , mais ne fonctionne pas aussi efficacement que si elle avait subi l'absorption des protéines du CMH de classe I/II. Au cours de l' inflammation , les lymphocytes T traversent la barrière hémato-encéphalique grâce à des marqueurs de surface spécialisés, puis se lient directement à la microglie afin de recevoir des antigènes . Une fois qu'on leur a présenté des antigènes, les lymphocytes T remplissent une variété de rôles, notamment le recrutement pro-inflammatoire, la formation d'immuno-mémoires, la sécrétion de matériaux cytotoxiques et les attaques directes contre les membranes plasmiques des cellules étrangères.
Cytotoxicité
En plus de pouvoir détruire les organismes infectieux par contact de cellule à cellule via la phagocytose , la microglie peut également libérer une variété de substances cytotoxiques . La microglie en culture sécrète de grandes quantités de peroxyde d'hydrogène et d'oxyde nitrique dans un processus connu sous le nom de « éclatement respiratoire ». Ces deux produits chimiques peuvent endommager directement les cellules et entraîner la mort des cellules neuronales. Les protéases sécrétées par la microglie catabolisent des protéines spécifiques causant des dommages cellulaires directs, tandis que des cytokines comme l' IL-1 favorisent la démyélinisation des axones neuronaux. Enfin, la microglie peut endommager les neurones par le biais de processus médiés par les récepteurs NMDA en sécrétant du glutamate , de l' aspartate et de l' acide quinolinique . La sécrétion cytotoxique vise à détruire les neurones, les virus et les bactéries infectés, mais peut également causer de grandes quantités de dommages neuraux collatéraux. En conséquence, une réponse inflammatoire chronique peut entraîner des dommages neuronaux à grande échelle lorsque la microglie ravage le cerveau dans le but de détruire l'infection envahissante. Edaravone , un piégeur de radicaux, empêche la neurotoxicité oxydative précipitée par la microglie activée.
Décapage synaptique
Dans un phénomène remarqué pour la première fois dans les lésions vertébrales par Blinzinger et Kreutzberg en 1968, la microglie post-inflammatoire enlève les branches des nerfs à proximité des tissus endommagés. Cela aide à favoriser la repousse et le remappage des circuits neuronaux endommagés .
Promotion de la réparation
Après l'inflammation, la microglie subit plusieurs étapes pour favoriser la repousse du tissu neural. Ceux-ci incluent le décapage synaptique, la sécrétion de cytokines anti-inflammatoires , le recrutement de neurones et d' astrocytes dans la zone endommagée et la formation de cellules gitter . Sans les cellules microgliales, la repousse et le remappage seraient considérablement plus lents dans les zones résidentes du SNC et presque impossibles dans de nombreux systèmes vasculaires entourant le cerveau et les yeux. Des recherches récentes ont confirmé que les processus microgliaux surveillent en permanence les fonctions neuronales à travers des jonctions somatiques spécialisées et détectent le « bien-être » des cellules nerveuses. Via cette voie de communication intercellulaire, la microglie est capable d'exercer des effets neuroprotecteurs robustes, contribuant de manière significative à la réparation après une lésion cérébrale.
Développement
On a longtemps pensé que les cellules microgliales se différencient dans la moelle osseuse des cellules souches hématopoïétiques , les progéniteurs de toutes les cellules sanguines. Cependant, des études récentes montrent que la microglie prend naissance dans le sac vitellin pendant une période embryonnaire remarquablement restreinte et peuple le mésenchyme cérébral . De plus, ils se renouvellent continuellement et persistent tout au long de la vie sans se reconstituer en précurseurs monocytaires périphériques.
Les monocytes peuvent également se différencier en cellules dendritiques myéloïdes et en macrophages dans les systèmes périphériques. Comme les macrophages dans le reste du corps, la microglie utilise des mécanismes phagocytaires et cytotoxiques pour détruire les corps étrangers. La microglie et les macrophages contribuent tous deux à la réponse immunitaire en agissant comme des cellules présentatrices d'antigènes , ainsi qu'en favorisant l'inflammation et les mécanismes homéostatiques dans le corps en sécrétant des cytokines et d'autres molécules de signalisation.
Sous leur forme régulée à la baisse, la microglie est dépourvue des protéines du CMH de classe I / CMH de classe II , des cytokines IFN-γ , des antigènes CD45 et de nombreux autres récepteurs de surface nécessaires pour agir dans les rôles de présentation de l'antigène, phagocytaire et cytotoxique qui distinguent les macrophages normaux. La microglie diffère également des macrophages en ce qu'elle est beaucoup plus étroitement régulée spatialement et temporellement afin de maintenir une réponse immunitaire précise.
Une autre différence entre la microglie et les autres cellules qui se différencient des cellules progénitrices myéloïdes est le taux de renouvellement. Les macrophages et les cellules dendritiques sont constamment épuisés et remplacés par des cellules progénitrices myéloïdes qui se différencient en le type requis. En raison de la barrière hémato-encéphalique , il serait assez difficile pour le corps de remplacer constamment la microglie. Par conséquent, au lieu d'être constamment remplacées par des cellules progénitrices myéloïdes , les microglies maintiennent leur statu quo dans leur état de repos, puis, lorsqu'elles sont activées, elles prolifèrent rapidement afin de maintenir leur nombre. Des études sur les chimères osseuses ont cependant montré qu'en cas d' infection extrême , la barrière hémato-encéphalique s'affaiblit et la microglie sera remplacée par des cellules hématogènes dérivées de la moelle, à savoir des cellules progénitrices myéloïdes et des macrophages. Une fois que l'infection a diminué, la déconnexion entre les systèmes périphérique et central est rétablie et seule la microglie est présente pour la période de récupération et de repousse.
Vieillissement
La microglie subit une explosion d' activité mitotique lors d'une blessure ; cette prolifération est suivie d'une apoptose pour ramener le nombre de cellules à la ligne de base. L'activation de la microglie exerce une charge sur la machinerie anabolique et catabolique des cellules, provoquant la mort de la microglie activée plus tôt que les cellules non activées. Pour compenser la perte de la microglie au fil du temps, la microglie subit une mitose et les cellules progénitrices dérivées de la moelle osseuse migrent dans le cerveau via les méninges et le système vasculaire.
L'accumulation de lésions neuronales mineures qui se produisent au cours du vieillissement normal peut transformer la microglie en cellules agrandies et activées. Ces augmentations chroniques et associées à l'âge de l'activation microgliale et de l'expression de l'IL-1 peuvent contribuer à un risque accru de maladie d'Alzheimer avec l'âge en favorisant la formation de plaques névritiques chez les patients sensibles. Les dommages à l'ADN pourraient contribuer à l'activation microgliale associée à l'âge. Un autre facteur pourrait être l'accumulation de produits finaux de glycation avancée , qui s'accumulent avec le vieillissement. Ces protéines sont fortement résistantes aux processus protéolytiques et favorisent la réticulation des protéines .
La recherche a découvert une microglie humaine dystrophique (développement défectueux). "Ces cellules sont caractérisées par des anomalies dans leur structure cytoplasmique, telles que des processus déramifiés, atrophiques, fragmentés ou inhabituellement tortueux, portant fréquemment des gonflements sphéroïdaux ou bulbeux." L'incidence de la microglie dystrophique augmente avec l'âge. La dégénérescence et la mort microgliales ont été rapportées dans des recherches sur la maladie à prions , la schizophrénie et la maladie d'Alzheimer, indiquant que la détérioration microgliale pourrait être impliquée dans les maladies neurodégénératives. Une complication de cette théorie est le fait qu'il est difficile de faire la distinction entre les microglies « activées » et « dystrophiques » dans le cerveau humain.
Chez la souris, il a été démontré que le blocage de CD22 restaure la phagocytose microgliale homéostatique dans les cerveaux vieillissants.
Signification clinique
Les microglies sont les cellules immunitaires primaires du système nerveux central, similaires aux macrophages périphériques. Ils réagissent aux agents pathogènes et aux blessures en changeant de morphologie et en migrant vers le site d'infection/de blessure, où ils détruisent les agents pathogènes et éliminent les cellules endommagées. Dans le cadre de leur réponse, ils sécrètent des cytokines, des chimiokines, des prostaglandines et des espèces réactives de l'oxygène, qui aident à orienter la réponse immunitaire. De plus, ils contribuent à la résolution de la réponse inflammatoire, grâce à la production de cytokines anti-inflammatoires. Les microglies ont également été largement étudiées pour leurs rôles nocifs dans les maladies neurodégénératives, telles que la maladie d'Alzheimer , la maladie de Parkinson , la sclérose en plaques , ainsi que les maladies cardiaques, le glaucome et les infections virales et bactériennes. Il existe de plus en plus de preuves que le dérèglement immunitaire contribue à la physiopathologie du trouble obsessionnel-compulsif (TOC) , du syndrome de Tourette et des troubles neuropsychiatriques auto-immuns pédiatriques associés aux infections streptococciques (PANDAS) .
Histoire
La capacité de visualiser et de caractériser différentes cellules neurales, y compris la microglie, a commencé en 1880 lorsque la coloration Nissl a été développée par Franz Nissl . Franz Nissl et F. Robertson ont d'abord décrit les cellules microgliales au cours de leurs expériences d' histologie . Les techniques de coloration cellulaire dans les années 1880 ont montré que la microglie est liée aux macrophages . L'activation de la microglie et la formation d'amas microgliaux ramifiés ont été notées pour la première fois par Victor Babeş alors qu'il étudiait un cas de rage en 1897. Babeş a noté que les cellules avaient été trouvées dans diverses infections cérébrales virales mais ne savait pas quels étaient les amas de microglies qu'il avait vus. Pío del Río Hortega , un étudiant de Santiago Ramón y Cajal , a d'abord appelé les cellules "microglie" vers 1920. Il a ensuite caractérisé la réponse microgliale aux lésions cérébrales en 1927 et a noté les "fontaines de microglie" présentes dans le corps calleux et d'autres zones de substance blanche périnatale en 1932. Après de nombreuses années de recherche, Rio Hortega est devenu généralement considéré comme le « père de la microglie ». Pendant une longue période de temps, peu d'améliorations ont été apportées à notre connaissance de la microglie. Puis, en 1988, Hickey et Kimura ont montré que les cellules microgliales périvasculaires sont dérivées de la moelle osseuse et expriment des niveaux élevés de protéines du CMH de classe II utilisées pour la présentation des antigènes. Cela a confirmé le postulat de Pio Del Rio-Hortega selon lequel les cellules microgliales fonctionnaient de la même manière que les macrophages en effectuant la phagocytose et la présentation de l'antigène .
Voir également
Les références
Lectures complémentaires
- Rock RB, Gekker G, Hu S, Sheng WS, Cheeran M, Lokensgard JR, Peterson PK (octobre 2004). "Rôle de la microglie dans les infections du système nerveux central" . Revues de microbiologie clinique . 17 (4) : 942–64, table des matières. doi : 10.1128/CMR.17.4.942-964.2004 . PMC 523558 . PMID 15489356 .
- Han X, Li Q, Lan X et al. (février 2019). "L'épuisement des microglies avec les liposomes de clodronate augmente les niveaux de cytokines pro-inflammatoires, induit l'activation des astrocytes et endommage l'intégrité des vaisseaux sanguins" . Mol Neurobiol . 56 (9) : 6184-6196. doi : 10.1007/s12035-019-1502-9 . PMC 6684378 . PMID 30734229 .
Liens externes
- Page d'accueil de Microglia sur microglia.net
- Creeping into your Head - Une brève introduction à la microglie - Une revue du Science Creative Quarterly
- "Les charognards immunitaires ciblent les plaques d'Alzheimer" . 6 avril 2007.
- Le département des neurosciences de Wikiversité
- Recherche NIF - Cellule microgliale via le cadre d'information en neurosciences