Biogenèse mitochondriale - Mitochondrial biogenesis
La biogenèse mitochondriale est le processus par lequel les cellules augmentent le nombre de mitochondries . Il a été décrit pour la première fois par John Holloszy dans les années 1960, lorsqu'il a été découvert que l' entraînement d'endurance physique induisait des niveaux de contenu mitochondrial plus élevés, entraînant une plus grande absorption de glucose par les muscles. La biogenèse mitochondriale est activée par de nombreux signaux différents pendant les périodes de stress cellulaire ou en réponse à des stimuli environnementaux, tels que l'exercice aérobie .
Arrière-plan
La capacité d'une mitochondrie à s'auto-répliquer est enracinée dans son histoire évolutive. On pense généralement que les mitochondries descendent de cellules qui ont formé des relations endosymbiotiques avec les -protobactéries , elles ont leur propre génome pour la réplication. Cependant, des preuves récentes suggèrent que les mitochondries peuvent avoir évolué sans symbiose. La mitochondrie est un régulateur clé de l'activité métabolique de la cellule, et est également un organite important dans la production et la dégradation des radicaux libres. Il est postulé qu'un nombre de copies mitochondriale plus élevé (ou une masse mitochondriale plus élevée) protège la cellule.
Les mitochondries sont produites à partir de la transcription et de la traduction de gènes à la fois dans le génome nucléaire et dans le génome mitochondrial . La majorité des protéines mitochondriales proviennent du génome nucléaire, tandis que le génome mitochondrial code des parties de la chaîne de transport d'électrons avec l' ARNr et l' ARNt mitochondriaux . La biogenèse mitochondriale augmente les enzymes métaboliques pour la glycolyse, la phosphorylation oxydative et finalement une plus grande capacité métabolique mitochondriale. Cependant, selon les substrats énergétiques disponibles et l'état REDOX de la cellule, la cellule peut augmenter ou diminuer le nombre et la taille des mitochondries. De manière critique, le nombre et la morphologie des mitochondries varient en fonction du type de cellule et de la demande spécifique au contexte, l'équilibre entre la fusion/fission mitochondriale régulant la distribution, la morphologie et la fonction mitochondriale.
Importation de protéines
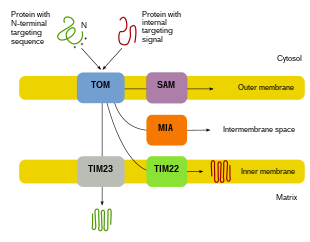
Étant donné que la majorité des protéines mitochondriales proviennent du génome nucléaire, les protéines doivent être correctement ciblées et transportées dans les mitochondries pour remplir leurs fonctions. Tout d'abord, l'ARNm est traduit dans le cytosol de la cellule. Les protéines précurseurs dépliées résultantes pourront alors atteindre leurs compartiments mitochondriaux respectifs. Les protéines précurseurs seront transportées vers l'une des quatre zones des mitochondries, qui comprennent la membrane externe, la membrane interne, l'espace intermembranaire et la matrice. Toutes les protéines entreront dans les mitochondries par une translocase sur la membrane mitochondriale externe (TOM). Certaines protéines auront un signal de ciblage N-terminal, et ces protéines seront détectées et transportées dans la matrice, où elles seront ensuite clivées et repliées. D'autres protéines peuvent avoir des informations de ciblage dans leurs séquences et n'incluront pas de signal N-terminal. Au cours des deux dernières décennies, les chercheurs ont découvert plus de trente protéines qui participent à l'importation de protéines mitochondriales. Au fur et à mesure que les chercheurs en apprennent davantage sur ces protéines et comment elles atteignent les compartiments mitochondriaux respectifs qui les utilisent, il devient évident qu'il existe une multitude de processus qui fonctionnent ensemble dans la cellule pour permettre la biogenèse mitochondriale.
Fusion et fission
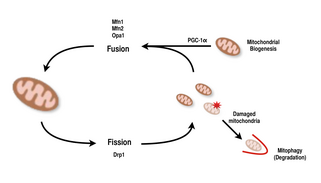
Les mitochondries sont très polyvalentes et sont capables de changer de forme lors d'événements de fission et de fusion. Définitivement, la fission est l'événement d'une seule entité qui se sépare, tandis que la fusion est l'événement de deux ou plusieurs entités qui se rejoignent pour former un tout. Les processus de fission et de fusion s'opposent et permettent au réseau mitochondrial de se remodeler en permanence. Si un stimulus induit un changement dans l'équilibre de la fission et de la fusion dans une cellule, il pourrait altérer de manière significative le réseau mitochondrial. Par exemple, une augmentation de la fission mitochondriale créerait de nombreuses mitochondries fragmentées, ce qui s'est avéré utile pour éliminer les mitochondries endommagées et pour créer des mitochondries plus petites pour un transport efficace vers les zones énergivores. Par conséquent, atteindre un équilibre entre ces mécanismes permet à une cellule d'avoir la bonne organisation de son réseau mitochondrial au cours de la biogenèse et peut avoir un rôle important dans l'adaptation musculaire au stress physiologique.
Chez les mammifères, la fusion mitochondriale et la fission sont toutes deux contrôlées par des GTPases de la famille de la dynamine. Le processus de fission mitochondriale est dirigé par Drp1 , un membre de la famille de la dynamine cytosolique. Cette protéine forme une spirale autour des mitochondries et se resserre pour briser à la fois les membranes externe et interne de l'organite. D'autre part, le processus de fusion est dirigé par différentes protéines de dynamine ancrées dans la membrane à différents niveaux des mitochondries. La fusion au niveau de la membrane mitochondriale externe est médiée par Mfn1 et Mfn2 (Mitofusines 1 et 2), et la fusion au niveau de la membrane mitochondriale interne est médiée par Opa1 . De nombreuses études de recherche ont observé des augmentations corrélées entre la capacité respiratoire mitochondriale avec l'expression des gènes Mfn1, Mnf2 et Drp1 après des exercices d'endurance. Par conséquent, il est soutenu que la réorganisation du réseau mitochondrial dans les cellules musculaires joue un rôle important en réponse à l'exercice.
Régulation
La PGC-1α , membre de la famille des coactivateurs transcriptionnels des récepteurs gamma activés par les proliférateurs de peroxysomes (PGC) , est le principal régulateur de la biogenèse mitochondriale. Il est connu pour co-activer le facteur respiratoire nucléaire 2 (NRF2/GABPA) et, avec le NRF-2, co-active le facteur respiratoire nucléaire 1 ( NRF1 ). Les NRF, à leur tour, activent le facteur de transcription mitochondrial A (tfam) , qui est directement responsable de la transcription des protéines mitochondriales codées dans le noyau. Cela inclut à la fois les protéines mitochondriales structurelles ainsi que celles impliquées dans la transcription, la traduction et la réparation de l'ADNmt . La PGC-1β, une protéine structurellement similaire à la PGC-1α , est également impliquée dans la régulation de la biogenèse mitochondriale, mais diffère en ce qu'elle n'augmente pas en réponse à l'exercice. Bien qu'il y ait eu des augmentations significatives des mitochondries dans les tissus où PGC-1α est surexprimé, car le cofacteur interagit avec ces facteurs de transcription clés, les souris knock-out avec PGC-1α perturbé sont toujours viables et présentent une abondance mitochondriale normale. Ainsi, PGC-1α n'est pas nécessaire au développement normal des mitochondries chez la souris, mais lorsqu'elles sont soumises à un stress physiologique, ces souris présentent une tolérance diminuée par rapport aux souris ayant des niveaux normaux de PGC-1α. De même, chez les souris knock-out avec PGC-1β perturbé, les souris ont montré des niveaux principalement normaux de fonction mitochondriale avec une capacité réduite à s'adapter au stress physiologique. Cependant, une expérience de double knock-out de PGC-1α/β a créé des souris qui sont mortes pour la plupart dans les 24 heures par des défauts de maturation mitochondriale du tissu cardiaque. Ces résultats suggèrent que, bien que PGC-1α et PGC-1β n'établissent pas chacun la capacité d'une cellule à effectuer la biogenèse mitochondriale, ensemble, ils sont capables de se compléter pour une maturation et un fonctionnement mitochondriaux optimaux pendant les périodes de stress physiologique.
La kinase activée par l'AMP (AMPK) régule également la biogenèse mitochondriale en phosphorylant et en activant PGC-1α lors de la détection d'un déficit énergétique dans le muscle. Chez les souris présentant des rapports ATP/AMP réduits qui se produiraient pendant l'exercice, il a été démontré que l'épuisement énergétique était en corrélation avec l'activation de l'AMPK. L'activation de l'AMPK a ensuite continué à activer la PGC-1α et les NRF chez ces souris, et la biogenèse mitochondriale a été stimulée.
Vieillissement
Il a été démontré que la capacité de biogenèse mitochondriale diminue avec l'âge, et une telle diminution de la fonction mitochondriale a été associée au diabète et aux maladies cardiovasculaires. Le vieillissement et la maladie peuvent induire des changements dans les niveaux d'expression des protéines impliquées dans les mécanismes de fission et de fusion des mitochondries, créant ainsi des mitochondries dysfonctionnelles. Une hypothèse des effets néfastes du vieillissement est associée à la perte des télomères , les segments terminaux des chromosomes qui protègent l'information génétique de la dégradation. La perte de télomères a également été associée à une diminution de la fonction mitochondriale. La déficience en transcriptase inverse de la télomérase (TERT) , une enzyme qui joue un rôle dans la préservation des télomères, a été corrélée à la p53 activée, une protéine qui supprime la PGC-1α. Par conséquent, la perte de télomères et de TERT qui accompagne le vieillissement a été associée à une altération de la biogenèse mitochondriale. Il a également été démontré que l'expression de l'AMPK diminue avec l'âge, ce qui peut également contribuer à supprimer la biogenèse mitochondriale.
Les références
Lectures complémentaires
- Smith JA, Stallons LJ, Collier JB, Chavin KD, Schnellmann RG (février 2015). « Suppression de la biogenèse mitochondriale par la signalisation de la protéine kinase kinase régulée par le signal extracellulaire dépendant du récepteur 4 dépendant des mitogènes/kinase régulée par le signal extracellulaire dans les lésions rénales aiguës induites par l'endotoxine » . The Journal of Pharmacology and Experimental Therapeutics . 352 (2) : 346-57. doi : 10.1124/jpet.114.221085 . PMC 4293437 . PMID 25503387 .
- Cameron RB, Beeson CC, Schnellmann RG (décembre 2016). "Développement de thérapies qui induisent la biogenèse mitochondriale pour le traitement des maladies dégénératives aiguës et chroniques" . Journal de chimie médicinale . 59 (23): 10411-10434. doi : 10.1021/acs.jmedchem.6b00669 . PMC 5564430 . PMID 27560192 .
- Whitaker RM, Corum D, Beeson CC, Schnellmann RG (2016). « La biogenèse mitochondriale comme cible pharmacologique : une nouvelle approche des maladies aiguës et chroniques ». Revue annuelle de pharmacologie et toxicologie . 56 : 229–49. doi : 10.1146/annurev-pharmtox-010715-103155 . PMID 26566156 .