Néopentane - Neopentane

|
|||
|
|||
|
|
|||
| Noms | |||
|---|---|---|---|
|
Nom IUPAC préféré
2,2-Diméthylpropane |
|||
| Autres noms
Néopentane
tétraméthylméthane |
|||
| Identifiants | |||
|
Modèle 3D ( JSmol )
|
|||
| 1730722 | |||
| ChEBI | |||
| ChemSpider | |||
| Carte d'information de l'ECHA |
100.006.677 |
||
| Numéro CE | |||
| 1850 | |||
| Engrener | néopentane | ||
|
CID PubChem
|
|||
| UNII | |||
|
Tableau de bord CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriétés | |||
| C 5 H 12 | |||
| Masse molaire | 72,151 g·mol -1 | ||
| Apparence | Gaz incolore | ||
| Odeur | Inodore | ||
| Densité | 3,255 kg/m 3 (gaz, 9,5 °C) 601,172 kg/m 3 (liquide, 9,5 °C) |
||
| Point de fusion | −16,5 °C (2,3 °F; 256,6 K) | ||
| Point d'ébullition | 9,5 °C (49,1 °F ; 282,6 K) | ||
| La pression de vapeur | 146 kPa (à 20 °C) | ||
|
Constante de la loi de Henry ( k H ) |
4,7 nmoles Pa -1 kg -1 | ||
| Thermochimie | |||
|
Capacité calorifique ( C )
|
121,07–120,57 JK -1 mol -1 | ||
|
Entropie molaire standard ( S |
217 JK -1 mol -1 | ||
|
Std enthalpie de
formation (Δ f H ⦵ 298 ) |
−168,5–−167,3 kJ mol −1 | ||
|
Std enthalpie de
combustion (Δ c H ⦵ 298 ) |
−3,51506–−3,51314 MJ mol −1 | ||
| Dangers | |||
|
Classification UE (DSD) (obsolète)
|
|
||
| Phrases R (obsolètes) | R12 , R51/53 | ||
| Phrases S (obsolètes) | (S2) , S16 , S33 | ||
| NFPA 704 (diamant de feu) | |||
| Composés apparentés | |||
|
Alcanes apparentés
|
|||
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa). |
|||
|
|
|||
| Références de l'infobox | |||
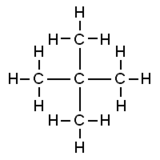
Néopentane , également appelé 2,2-diméthylpropane , est une double chaîne ramifiée alcane avec cinq carbones atomes. Le néopentane est un gaz inflammable à température et pression ambiantes qui peut se condenser en un liquide très volatil par temps froid, dans un bain de glace ou lorsqu'il est comprimé à une pression plus élevée.
Le néopentane est l'alcane le plus simple avec un carbone quaternaire et possède une symétrie tétraédrique achirale . C'est l'un des trois isomères de structure de formule moléculaire C 5 H 12 ( pentanes ), les deux autres étant le n- pentane et l' isopentane . Sur ces trois, c'est le seul à être un gaz aux conditions standard ; les autres sont des liquides.
Nomenclature
Le nom traditionnel néopentane était toujours retenu dans les recommandations IUPAC de 1993 , mais n'est plus recommandé selon les recommandations de 2013. Le nom IUPAC préféré est le nom systématique 2,2-diméthylpropane, mais les numéros de substituants sont superflus car c'est le seul « diméthylpropane » possible.
Un substituant néopentyle , souvent symbolisé par "Np", a la structure Me 3 C-CH 2 - par exemple l' alcool néopentylique (Me 3 CCH 2 OH ou NpOH). Comme Np symbolise également l'élément neptunium (numéro atomique 93), il convient d'utiliser cette abréviation avec précaution.
Le nom obsolète de tétraméthylméthane est également utilisé, en particulier dans les sources plus anciennes.
Propriétés physiques
Points d'ébullition et de fusion
Le point d'ébullition du néopentane n'est que de 9,5 °C, nettement inférieur à ceux de l'isopentane (27,7 °C) et du pentane normal (36,0 °C). Par conséquent, le néopentane est un gaz à température ambiante et à pression atmosphérique, tandis que les deux autres isomères sont (à peine) liquides.
Le point de fusion du néopentane (−16,6 °C), en revanche, est supérieur de 140 degrés à celui de l'isopentane (−159,9 °C) et de 110 degrés supérieur à celui du n- pentane (−129,8 °C). Cette anomalie a été attribuée au meilleur tassement à l'état solide supposé possible avec la molécule de néopentane tétraédrique ; mais cette explication a été contestée en raison de sa densité inférieure à celle des deux autres isomères. De plus, son enthalpie de fusion est inférieure aux enthalpies de fusion du n- pentane et de l'isopentane, indiquant ainsi que son point de fusion élevé est dû à un effet d'entropie résultant d'une symétrie moléculaire plus élevée. En effet, l' entropie de fusion du néopentane est environ quatre fois inférieure à celle du n- pentane et de l'isopentane.
1 Spectre RMN ' H
En raison de la symétrie tétraédrique complète du néopentane , tous les protons sont chimiquement équivalents, ce qui conduit à un seul déplacement chimique RMN δ = 0,902 lorsqu'il est dissous dans du tétrachlorure de carbone . À cet égard, le néopentane est similaire à son analogue silane , le tétraméthylsilane , dont le seul déplacement chimique est nul par convention.
La symétrie de la molécule de néopentane peut être brisée si certains atomes d'hydrogène sont remplacés par des atomes de deutérium . En particulier, si chaque groupe méthyle a un nombre différent d'atomes substitués (0, 1, 2 et 3), on obtient une molécule chirale . La chiralité dans ce cas résulte uniquement de la distribution de masse de ses noyaux, alors que la distribution des électrons est encore essentiellement achirale.
Les références
Liens externes
- Linstrom, Peter J.; Mallard, William G. (éd.) ; NIST Chemistry WebBook, NIST Standard Reference Database Number 69 , National Institute of Standards and Technology, Gaithersburg (MD), http://webbook.nist.gov
- Nomenclature IUPAC de chimie organique (version en ligne du " Blue Book ")