Nocicepteur - Nociceptor
| Nocicepteur | |
|---|---|
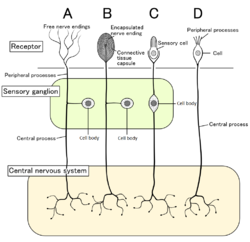 Quatre types de neurones sensoriels et leurs cellules réceptrices. Nocicepteurs représentés comme des terminaisons nerveuses libres de type A
| |
| Identifiants | |
| Engrener | D009619 |
| Terminologie anatomique | |
Un nocicepteur (« récepteur de la douleur ») est un neurone sensoriel qui répond à des stimuli dommageables ou potentiellement dommageables en envoyant des signaux de « menace possible » à la moelle épinière et au cerveau. Si le cerveau perçoit la menace comme crédible, il crée une sensation de douleur pour attirer l'attention sur une partie du corps, de sorte que la menace peut, espérons-le, être atténuée ; ce processus est appelé nociception .
Histoire
Les nocicepteurs ont été découverts par Charles Scott Sherrington en 1906. Au cours des siècles précédents, les scientifiques croyaient que les animaux étaient comme des dispositifs mécaniques qui transformaient l'énergie des stimuli sensoriels en réponses motrices. Sherrington utilisé de nombreuses expériences pour démontrer que les différents types de stimulation à une fibre nerveuse afférences « s champ récepteur conduit à des réponses différentes. Certains stimuli intenses déclenchent le retrait réflexe , certaines réponses autonomes et la douleur . Les récepteurs spécifiques de ces stimuli intenses étaient appelés nocicepteurs.
Emplacement
Chez les mammifères, les nocicepteurs se trouvent dans n'importe quelle zone du corps qui peut détecter des stimuli nocifs. Les nocicepteurs externes se trouvent dans les tissus tels que la peau ( nocicepteurs cutanés ), les cornées et les muqueuses . Les nocicepteurs internes se trouvent dans une variété d'organes, tels que les muscles , les articulations , la vessie , les organes viscéraux et le tube digestif. Les corps cellulaires de ces neurones sont situés soit dans les ganglions de la racine dorsale, soit dans les ganglions du trijumeau . Les ganglions du trijumeau sont des nerfs spécialisés pour le visage, tandis que les ganglions de la racine dorsale sont associés au reste du corps. Les axones s'étendent dans le système nerveux périphérique et se terminent en branches pour former des champs récepteurs.
Développement
Les nocicepteurs se développent à partir de cellules souches de la crête neurale . La crête neurale est responsable d'une grande partie du développement précoce chez les vertébrés. Il est spécifiquement responsable du développement du système nerveux périphérique (SNP). Les cellules souches de la crête neurale se séparent du tube neural lors de sa fermeture et les nocicepteurs se développent à partir de la partie dorsale de ce tissu de la crête neurale. Ils se forment tardivement au cours de la neurogenèse. Les cellules formées plus tôt dans cette région peuvent devenir des récepteurs non sensibles à la douleur, soit des propriocepteurs , soit des mécanorécepteurs à faible seuil . Tous les neurones dérivés de la crête neurale, y compris les nocicepteurs embryonnaires, expriment le TrkA, qui est un récepteur du facteur de croissance nerveuse (NGF). Cependant, les facteurs de transcription qui déterminent le type de nocicepteur restent flous.
Après la neurogenèse sensorielle, la différenciation se produit et deux types de nocicepteurs se forment. Ils sont classés en nocicepteurs peptidergiques ou non peptidergiques, dont chacun exprime un répertoire distinct de canaux ioniques et de récepteurs. Leurs spécialisations permettent aux récepteurs d'innerver différentes cibles centrales et périphériques. Cette différenciation se produit à la fois en période périnatale et postnatale. Les nocicepteurs non peptidergiques éteignent le TrkA et commencent à exprimer Ret, qui est un composant de signalisation transmembranaire qui permet l'expression du facteur de croissance dérivé des cellules gliales (GDNF). Cette transition est assistée par Runx1 qui est vital dans le développement de nocicepteurs non peptidergiques. Au contraire, les nocicepteurs peptidergiques continuent à utiliser TrkA, et ils expriment un type de facteur de croissance complètement différent. Il existe actuellement de nombreuses recherches sur les différences entre les nocicepteurs.
Types et fonctions
La borne périphérique du nocicepteur mature est l'endroit où les stimuli nocifs sont détectés et transformés en énergie électrique. Lorsque l'énergie électrique atteint une valeur seuil, un potentiel d'action est induit et conduit vers le système nerveux central (SNC). Cela conduit au train d'événements qui permet la prise de conscience consciente de la douleur. La spécificité sensorielle des nocicepteurs n'est établie par le seuil élevé que pour des caractéristiques particulières des stimuli. Ce n'est que lorsque le seuil haut a été atteint par des environnements chimiques, thermiques ou mécaniques que les nocicepteurs se déclenchent. La majorité des nocicepteurs sont classés selon les modalités environnementales auxquelles ils répondent. Certains nocicepteurs répondent à plus d'une de ces modalités et sont par conséquent désignés polymodaux. D'autres nocicepteurs ne répondent à aucune de ces modalités (bien qu'ils puissent répondre à une stimulation dans des conditions d'inflammation) et sont appelés endormis ou silencieux.
Les nocicepteurs ont deux types d'axones différents. Les premiers sont les axones de la fibre Aδ . Ils sont myélinisés et peuvent permettre à un potentiel d'action de se déplacer à une vitesse d'environ 20 mètres/seconde vers le SNC. L'autre type est celui des axones de la fibre C à conduction plus lente . Ceux-ci ne conduisent qu'à des vitesses d'environ 2 mètres/seconde. Cela est dû à la lumière ou à la non-myélinisation de l'axone. En conséquence, la douleur se présente en deux phases. La première phase est médiée par les fibres Aδ à conduction rapide et la seconde partie par les fibres C (polymodales). La douleur associée aux fibres Aδ peut être associée à une douleur initiale extrêmement vive. La deuxième phase est une sensation de douleur plus prolongée et légèrement moins intense en raison des dommages aigus. S'il y a un apport massif ou prolongé à une fibre C, il y a une accumulation progressive dans la corne dorsale de la moelle épinière ; ce phénomène est similaire au tétanos dans les muscles mais est appelé liquidation . En cas de liquidation, il existe une probabilité d'augmentation de la sensibilité à la douleur.
Thermique
Les nocicepteurs thermiques sont activés par la chaleur ou le froid nocifs à différentes températures. Il existe des transducteurs nocicepteurs spécifiques qui sont responsables de comment et si la terminaison nerveuse spécifique répond au stimulus thermique. Le premier à être découvert était TRPV1 , et il a un seuil qui coïncide avec la température de la douleur thermique de 43 °C. L'autre température dans la plage chaud-chaud est médiée par plus d'un canal TRP . Chacun de ces canaux exprime un domaine C-terminal particulier qui correspond à la sensibilité chaud-chaud. Les interactions entre tous ces canaux et la façon dont le niveau de température est déterminé au-dessus du seuil de douleur sont inconnues à l'heure actuelle. Les stimuli froids sont détectés par les canaux TRPM8 . Son domaine C-terminal diffère des TRP thermosensibles. Bien que ce canal corresponde à des stimuli froids, on ignore encore s'il contribue également à la détection du froid intense. Une découverte intéressante liée aux stimuli froids est que la sensibilité tactile et la fonction motrice se détériorent tandis que la perception de la douleur persiste.
Mécanique
Les nocicepteurs mécaniques répondent à une surpression ou à une déformation mécanique. Ils réagissent également aux incisions qui cassent la surface de la peau. La réaction au stimulus est traitée comme une douleur par le cortex, tout comme les réponses chimiques et thermiques. Ces nocicepteurs mécaniques ont fréquemment des caractéristiques polymodales. Il est donc possible que certains des transducteurs pour les stimuli thermiques soient les mêmes pour les stimuli mécaniques. Il en va de même pour les stimuli chimiques, puisque TRPA1 semble détecter à la fois les changements mécaniques et chimiques. Certains stimuli mécaniques peuvent provoquer la libération de produits chimiques intermédiaires, tels que l' ATP , qui peut être détecté par les récepteurs purinergiques P2 , ou le facteur de croissance nerveuse , qui peut être détecté par le récepteur kinase A de la tropomyosine (TrkA) .
Chimique
Les nocicepteurs chimiques ont des canaux TRP qui répondent à une grande variété d'épices. Celle qui rencontre le plus de réactions et qui est très largement testée est la capsaïcine . D'autres stimulants chimiques sont des irritants environnementaux comme l' acroléine , une arme chimique de la Première Guerre mondiale et un composant de la fumée de cigarette. En dehors de ces stimulants externes, les nocicepteurs chimiques ont la capacité de détecter des ligands endogènes et certaines amines d'acides gras qui résultent de modifications des tissus internes. Comme dans les nocicepteurs thermiques, TRPV1 peut détecter des produits chimiques comme la capsaïcine et les toxines et acides des araignées. Les canaux ioniques à détection d'acide (ASIC) détectent également l'acidité.
Dormir/silencieux
Bien que chaque nocicepteur puisse avoir une variété de niveaux de seuil possibles, certains ne répondent pas du tout aux stimuli chimiques, thermiques ou mécaniques à moins qu'une blessure ne se soit réellement produite. Ceux-ci sont généralement appelés nocicepteurs silencieux ou endormis, car leur réponse ne survient qu'au début de l'inflammation des tissus environnants.
Polymodal
De nombreux neurones n'exécutent qu'une seule fonction ; par conséquent, les neurones qui remplissent ces fonctions en combinaison reçoivent la classification « polymodale ».
Sentier
Ascendant
Les fibres nociceptives afférentes (celles qui envoient des informations à , plutôt qu'à partir du cerveau) retournent à la moelle épinière où elles forment des synapses dans sa corne dorsale . Cette fibre nociceptive (située en périphérie) est un neurone de premier ordre. Les cellules de la corne dorsale sont divisées en couches physiologiquement distinctes appelées lames. Différents types de fibres forment des synapses dans différentes couches et utilisent soit le glutamate, soit la substance P comme neurotransmetteur. Les fibres Aδ forment des synapses dans les lames I et V, les fibres C se connectent aux neurones dans la lame II, les fibres Aβ se connectent aux lames I, III et V. Après avoir atteint la lame spécifique dans la moelle épinière, le projet nociceptif de premier ordre vers les neurones de second ordre qui traversent la ligne médiane à la commissure blanche antérieure. Les neurones de second ordre envoient alors leurs informations via deux voies au thalamus : le système médio-lemniscal de la colonne dorsale et le système antérolatéral . Le premier est davantage réservé à la sensation régulière non douloureuse, tandis que le second est réservé à la sensation de douleur. En atteignant le thalamus, l'information est traitée dans le noyau ventral postérieur et envoyée au cortex cérébral dans le cerveau via des fibres dans la branche postérieure de la capsule interne.
Descendant
Comme il existe une voie ascendante vers le cerveau qui initie la prise de conscience consciente de la douleur, il existe également une voie descendante qui module la sensation de douleur. Le cerveau peut demander la libération d' hormones ou de produits chimiques spécifiques qui peuvent avoir des effets analgésiques qui peuvent réduire ou inhiber la sensation de douleur. La zone du cerveau qui stimule la libération de ces hormones est l' hypothalamus . Cet effet d'inhibition descendante peut être démontré en stimulant électriquement la zone grise périaqueducale du mésencéphale ou du noyau périventriculaire . Ils se projettent tous deux à leur tour vers d'autres zones impliquées dans la régulation de la douleur, telles que le noyau raphé magnus qui reçoit également des afférences similaires du noyau réticulaire paragigantocellularis (NPG). À son tour, le noyau raphé magnus se projette dans la région de la substance gélatineuse de la corne dorsale et médie la sensation d'entrées spinothalamiques. Cela se fait d'abord par le noyau raphé magnus envoyant des neurones sérotoninergiques aux neurones de la moelle dorsale, qui à leur tour sécrètent de l' enképhaline aux interneurones qui véhiculent la perception de la douleur. L'enképhaline fonctionne en se liant aux récepteurs opioïdes pour provoquer l'inhibition du neurone post-synaptique, inhibant ainsi la douleur. Le gris périaqueduc contient également des récepteurs opioïdes ce qui explique l'un des mécanismes par lesquels les opioïdes tels que la morphine et la diacétylmorphine présentent un effet analgésique.
Sensibilité
La sensibilité des neurones nocicepteurs est modulée par une grande variété de médiateurs dans l'espace extracellulaire. La sensibilisation périphérique représente une forme de plasticité fonctionnelle du nocicepteur. Le nocicepteur peut passer d'un simple détecteur de stimulus nocif à un détecteur de stimuli non nocifs. Le résultat est que des stimuli de faible intensité provenant d'une activité régulière, initient une sensation douloureuse. C'est ce qu'on appelle communément l' hyperalgésie . L'inflammation est une cause fréquente qui entraîne la sensibilisation des nocicepteurs. Normalement, l'hyperalgésie cesse lorsque l'inflammation diminue, cependant, parfois des défauts génétiques et/ou des blessures répétées peuvent entraîner une allodynie : un stimulus totalement non nocif comme un toucher léger provoque une douleur extrême. L'allodynie peut également être causée lorsqu'un nocicepteur est endommagé dans les nerfs périphériques. Cela peut entraîner une désafférentation, ce qui signifie le développement de différents processus centraux à partir du nerf afférent survivant. Dans cette situation, les axones de la racine dorsale survivants des nocicepteurs peuvent entrer en contact avec la moelle épinière, modifiant ainsi l'entrée normale.
Autres animaux
La nociception a été documentée chez les animaux non mammifères, y compris les poissons et un large éventail d' invertébrés , notamment les sangsues , les vers nématodes , les limaces de mer et les larves de mouches des fruits . Bien que ces neurones puissent avoir des voies et des relations avec le système nerveux central différentes de celles des nocicepteurs des mammifères, les neurones nociceptifs des non-mammifères se déclenchent souvent en réponse à des stimuli similaires à ceux des mammifères, tels qu'une température élevée (40 degrés C ou plus), un pH bas , la capsaïcine , et des lésions tissulaires.
Terminologie
En raison de la compréhension historique de la douleur, les nocicepteurs sont également appelés récepteurs de la douleur . Bien que la douleur soit réelle, des facteurs psychologiques peuvent fortement influencer l'intensité subjective.
Voir également
- La capsaïcine et son mécanisme d'action dans les nocicepteurs.
- Pipérine de poivre noir
- canal ionique TRPC
