Voie du pentose phosphate - Pentose phosphate pathway
La voie des pentoses phosphates (également appelée voie des phosphogluconates et shunt hexose monophosphate et shunt HMP ) est une voie métabolique parallèle à la glycolyse . Il génère du NADPH et des pentoses ( sucres à 5 carbones ) ainsi que du ribose 5-phosphate , précurseur de la synthèse des nucléotides . Alors que la voie des pentoses phosphates implique l'oxydation du glucose , son rôle principal est anabolique plutôt que catabolique . La voie est particulièrement importante dans les globules rouges (érythrocytes).
Il y a deux phases distinctes dans le cheminement. La première est la phase oxydative , dans laquelle le NADPH est généré, et la seconde est la synthèse non oxydante des sucres à 5 carbones. Pour la plupart des organismes, la voie des pentoses phosphates se déroule dans le cytosol ; chez les plantes, la plupart des étapes ont lieu dans les plastes .
Comme la glycolyse , la voie des pentoses phosphates semble avoir une origine évolutive très ancienne. Les réactions de cette voie sont principalement catalysées par des enzymes dans les cellules modernes, mais elles se produisent également de manière non enzymatique dans des conditions qui reproduisent celles de l' océan archéen et sont catalysées par des ions métalliques , en particulier des ions ferreux (Fe(II)). Cela suggère que les origines de la voie pourraient remonter au monde prébiotique.
Résultat
Les principaux résultats du parcours sont :
- La génération d'équivalents réducteurs, sous forme de NADPH, utilisés dans les réactions de biosynthèse réductrice au sein des cellules (par exemple , synthèse d'acides gras ).
- Production de ribose 5-phosphate (R5P), utilisé dans la synthèse de nucléotides et d'acides nucléiques.
- Production d' érythrose 4-phosphate (E4P) utilisé dans la synthèse d' acides aminés aromatiques .
Les acides aminés aromatiques, à leur tour, sont des précurseurs de nombreuses voies de biosynthèse, y compris la lignine du bois.
Les sucres pentoses alimentaires dérivés de la digestion des acides nucléiques peuvent être métabolisés par la voie des pentoses phosphates, et les squelettes carbonés des glucides alimentaires peuvent être convertis en intermédiaires glycolytiques/gluconéogènes.
Chez les mammifères, le PPP se produit exclusivement dans le cytoplasme. Chez l'homme, il s'avère être plus actif dans le foie, les glandes mammaires et le cortex surrénalien. Le PPP est l'un des trois principaux moyens par lesquels le corps crée des molécules à pouvoir réducteur , représentant environ 60% de la production de NADPH chez l'homme.
L'une des utilisations du NADPH dans la cellule est de prévenir le stress oxydatif . Il réduit le glutathion via la glutathion réductase , qui convertit le H 2 O 2 réactif en H 2 O par la glutathion peroxydase . En cas d'absence, le H 2 O 2 serait converti en radicaux libres hydroxyles par la chimie de Fenton , qui peuvent attaquer la cellule. Les érythrocytes, par exemple, génèrent une grande quantité de NADPH par la voie des pentoses phosphates à utiliser dans la réduction du glutathion.
Le peroxyde d'hydrogène est également généré pour les phagocytes au cours d'un processus souvent appelé sursaut respiratoire .
Étapes
Phase oxydante
Dans cette phase, deux molécules de NADP + sont réduites en NADPH , utilisant l'énergie de la conversion du glucose-6-phosphate en ribulose 5-phosphate .
L'ensemble des réactions peut être résumé comme suit :
| Réactifs | Des produits | Enzyme | La description |
| Glucose 6-phosphate + NADP+ | → 6-phosphoglucono-δ-lactone + NADPH | glucose 6-phosphate déshydrogénase | Déshydrogénation . L'hydroxyle sur le carbone 1 du glucose 6-phosphate se transforme en carbonyle, générant une lactone, et, dans le processus, du NADPH est généré. |
| 6-phosphoglucono-δ-lactone + H 2 O | → 6-phosphogluconate + H + | 6-phosphogluconolactonase | Hydrolyse |
| 6-phosphogluconate + NADP + | → ribulose 5-phosphate + NADPH + CO 2 | 6-phosphogluconate déshydrogénase | Oxydative décarboxylation . NADP + est l'accepteur d'électrons, générant une autre molécule de NADPH , un CO 2 , et du ribulose 5-phosphate . |
La réaction globale de ce processus est :
- Glucose 6-phosphate + 2 NADP + + H 2 O → ribulose 5-phosphate + 2 NADPH + 2 H + + CO 2
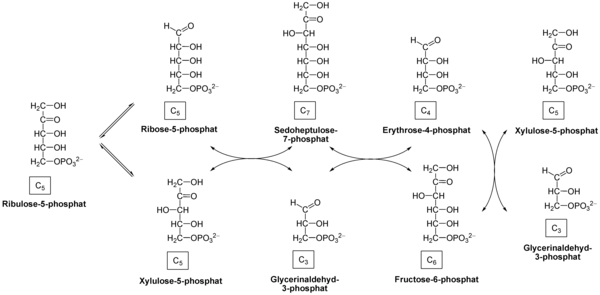
Phase non oxydante
Réaction nette : 3 ribulose-5-phosphate → 1 ribose-5-phosphate + 2 xylulose-5-phosphate → 2 fructose-6-phosphate + glycéraldéhyde-3-phosphate
Régulation
La glucose-6-phosphate déshydrogénase est l'enzyme régulant la vitesse de cette voie. Il est allostériquement stimulé par le NADP + et fortement inhibé par le NADPH . Le rapport NADPH:NADP + est normalement d'environ 100:1 dans le cytosol du foie. Cela fait du cytosol un environnement hautement réducteur. Une voie utilisant le NADPH forme le NADP + , qui stimule la Glucose-6-phosphate déshydrogénase pour produire plus de NADPH. Cette étape est également inhibée par l' acétyl CoA .
L' activité de la G6PD est également régulée post-traductionnellement par la désacétylase cytoplasmique SIRT2 . La désacétylation et l'activation de la G6PD médiées par SIRT2 stimulent la branche oxydative du PPP pour fournir du NADPH cytosolique pour contrer les dommages oxydatifs ou soutenir la lipogenèse de novo .
Érythrocytes
Plusieurs déficiences du niveau d'activité (et non de fonction) de la glucose-6-phosphate déshydrogénase ont été observées comme étant associées à la résistance au parasite du paludisme Plasmodium falciparum chez les individus d'origine méditerranéenne et africaine. La base de cette résistance peut être un affaiblissement de la membrane érythrocytaire (l'érythrocyte est la cellule hôte du parasite) de sorte qu'il ne peut pas maintenir le cycle de vie du parasite assez longtemps pour une croissance productive.
Voir également
- Déficit en G6PD – Une maladie héréditaire qui perturbe la voie des pentoses phosphates
- ARN
- Carence en thiamine
- Frank Dickens FRS
Les références
- ^ Alfarouk, Khalid O.; Ahmed, Samrein BM ; Elliott, Robert L.; Benoit, Amanda; Alqahtani, Saad S. ; Ibrahim, Muntaser E. ; Bashir, Adil HH; Alhoufie, Sari TS ; Elhassan, Gamal O. ; Pays de Galles, Christian C. ; Schwartz, Laurent H. ; Ali, Heyam S.; Ahmed, Ahmed; Fordé, Patrick F.; Devesa, Jésus ; Cardone, Rosa A.; Fais, Stefano; Harguindey, Salvador ; Reshkin, Stephan J. (2020). "La dynamique de la voie du pentose phosphate dans le cancer et sa dépendance au pH intracellulaire" . Métabolites . 10 (7) : 285. doi : 10.3390/metabo10070285 . PMC 7407102 . PMID 32664469 .
- ^ Alfarouk, Khalid O.; Ahmed, Samrein BM ; Elliott, Robert L.; Benoit, Amanda; Alqahtani, Saad S. ; Ibrahim, Muntaser E. ; Bashir, Adil HH; Alhoufie, Sari TS ; Elhassan, Gamal O. ; Pays de Galles, Christian C. ; Schwartz, Laurent H. ; Ali, Heyam S.; Ahmed, Ahmed; Fordé, Patrick F.; Devesa, Jésus ; Cardone, Rosa A.; Fais, Stefano; Harguindey, Salvador ; Reshkin, Stephan J. (2020). "La dynamique de la voie du pentose phosphate dans le cancer et sa dépendance au pH intracellulaire" . Métabolites . 10 (7) : 285. doi : 10.3390/metabo10070285 . PMC 7407102 . PMID 32664469 .
- ^ Kruger, Nicolas J; von Schaewen, Antje (juin 2003). « La voie oxydative des pentoses phosphates : structure et organisation ». Opinion actuelle en biologie végétale . 6 (3) : 236-246. doi : 10.1016/S1369-5266(03)00039-6 . PMID 12753973 .
- ^ Keller, Markus A.; Turchyn, Alexandra V. ; Ralser, Markus (25 avril 2014). "Glycolyse non enzymatique et réactions de type pentose phosphate dans un océan archéen plausible" . Biologie des systèmes moléculaires . 10 (4) : 725. doi : 10.1002/msb.20145228 . PMC 4023395 . PMID 24771084 .
- ^ Immunologie au MCG 1/cytotox
- ^ Voet Donald ; Voet Judith G (2011). Biochimie (4e éd.). p. 894. ISBN 978-0470-57095-1.
- ^ Wang YP, Zhou LS, Zhao YZ, Wang SW, Chen LL, Liu LX, Ling ZQ, Hu FJ, Sun YP, Zhang JY, Yang C, Yang Y, Xiong Y, Guan KL, Ye D (juin 2014). "La régulation de l'acétylation de la G6PD par SIRT2 et KAT9 module l'homéostasie du NADPH et la survie cellulaire pendant le stress oxydatif" . Journal de l'EMBO . 33 (12) : 1304–20. doi : 10.1002/embj.201387224 . PMC 4194121 . PMID 24769394 .
- ^ Xu SN, Wang TS, Li X, Wang YP (septembre 2016). "SIRT2 active la G6PD pour améliorer la production de NADPH et favoriser la prolifération des cellules leucémiques" . Représentant Sci . 6 : 32734. bibcode : 2016NatSR ... 632734X . doi : 10.1038/srep32734 . PMC 5009355 . PMID 27586085 .
- ^ Cappadoro M, Giribaldi G, O'Brien E, et al. (octobre 1998). "La phagocytose précoce des érythrocytes déficients en glucose-6-phosphate déshydrogénase (G6PD) parasités par Plasmodium falciparum peut expliquer la protection contre le paludisme dans le déficit en G6PD" . Du sang . 92 (7) : 2527–34. doi : 10.1182/sang.V92.7.2527 . PMID 9746794 .
Liens externes
- La logique chimique derrière la voie des pentoses phosphates
- Pentose+Phosphate+Pathway à la National Library of Medicine Medical Subject Headings (MeSH) des États-Unis
- Carte de la voie des pentoses phosphates – Homo sapiens