Synthèse peptidique - Peptide synthesis

En chimie organique , la synthèse peptidique est la production de peptides , des composés où plusieurs acides aminés sont liés par des liaisons amides, également appelées liaisons peptidiques . Les peptides sont synthétisés chimiquement par la réaction de condensation du groupe carboxyle d'un acide aminé au groupe amino d'un autre. Des stratégies de groupes protecteurs sont généralement nécessaires pour empêcher des réactions secondaires indésirables avec les diverses chaînes latérales d'acides aminés. La synthèse chimique des peptides commence le plus souvent à l'extrémité carboxyle du peptide (extrémité C) et se poursuit vers l'extrémité amino (extrémité N). Biosynthèse des protéines (peptides longs) dans les organismes vivants se produit dans la direction opposée.
La synthèse chimique des peptides peut être réalisée en utilisant des techniques classiques en phase solution, bien que celles-ci aient été remplacées dans la plupart des contextes de recherche et développement par des méthodes en phase solide (voir ci-dessous). La synthèse en phase solution conserve cependant son utilité dans la production à grande échelle de peptides à des fins industrielles.
La synthèse chimique facilite la production de peptides qui sont difficiles à exprimer dans des bactéries, l'incorporation d'acides aminés non naturels, modification du squelette de peptide / protéine, et la synthèse de protéines D, qui consistent en D-amino-acides .
Synthèse en phase solide
La méthode établie pour la production de peptides synthétiques en laboratoire est connue sous le nom de synthèse peptidique en phase solide (SPPS). Initié par Robert Bruce Merrifield , le SPPS permet l'assemblage rapide d'une chaîne peptidique par des réactions successives de dérivés d'acides aminés sur un support poreux insoluble.
Le support solide est constitué de petites billes de résine polymère fonctionnalisées avec des groupes réactifs (tels que des groupes amine ou hydroxyle) qui se lient à la chaîne peptidique naissante. Etant donné que le peptide reste attaché de manière covalente au support tout au long de la synthèse, les réactifs en excès et les produits secondaires peuvent être éliminés par lavage et filtration. Cette approche évite l'isolement relativement long du peptide produit de la solution après chaque étape de réaction, ce qui serait nécessaire lors de l'utilisation d'une synthèse conventionnelle en phase solution.
Chaque acide aminé à coupler à l'extrémité N-terminale de la chaîne peptidique doit être protégé sur son extrémité N-terminale et sa chaîne latérale en utilisant des groupes protecteurs appropriés tels que Boc (acide-labile) ou Fmoc (base-labile), selon la chaîne latérale et la stratégie de protection utilisée (voir ci-dessous).
La procédure SPPS générale est l'un des cycles répétés de réactions alternées de déprotection et de couplage N-terminal. La résine peut être lavée entre chaque étape. Tout d'abord, un acide aminé est couplé à la résine. Par la suite, l'amine est déprotégée, puis couplée à l'acide libre du deuxième acide aminé. Ce cycle se répète jusqu'à ce que la séquence désirée ait été synthétisée. Les cycles SPPS peuvent également comprendre des étapes de coiffage qui empêchent les extrémités des acides aminés n'ayant pas réagi de réagir. A la fin de la synthèse, le peptide brut est clivé du support solide tout en éliminant simultanément tous les groupes protecteurs à l'aide d'un réactif acide fort comme l'acide trifluoroacétique ou un nucléophile. Le peptide brut peut être précipité à partir d'un solvant non polaire comme l'éther diéthylique afin d'éliminer les sous-produits solubles organiques. Le peptide brut peut être purifié par HPLC en phase inverse . Le processus de purification, en particulier des peptides plus longs, peut être difficile, car de petites quantités de plusieurs sous-produits, qui sont très similaires au produit, doivent être éliminées. Pour cette raison, les procédés dits de chromatographie continue tels que le MCSGP sont de plus en plus utilisés dans les environnements commerciaux pour maximiser le rendement sans sacrifier les niveaux de pureté.
Le SPPS est limité par les rendements de réaction , et typiquement, les peptides et protéines de l'ordre de 70 acides aminés repoussent les limites de l'accessibilité synthétique. La difficulté synthétique dépend également de la séquence ; typiquement, les séquences sujettes à l'agrégation telles que les amyloïdes sont difficiles à fabriquer. Des longueurs plus longues sont accessibles en utilisant des approches de ligature telles que la ligature chimique native , où deux peptides synthétiques plus courts et entièrement déprotégés peuvent être réunis en solution.
Réactifs de couplage peptidique
Une caractéristique importante qui a permis la large application de SPPS est la génération de rendements extrêmement élevés dans l'étape de couplage. Des conditions de formation de liaison amide hautement efficaces sont requises. et ajouter un excès de chaque acide aminé (entre 2 et 10 fois). La minimisation de la racémisation des acides aminés pendant le couplage est également d'une importance vitale pour éviter l' épimérisation dans le produit peptidique final.
La formation de liaisons amides entre une amine et un acide carboxylique est lente et, en tant que telle, nécessite généralement des « réactifs de couplage » ou des « activateurs ». Il existe une large gamme de réactifs de couplage, en partie en raison de leur efficacité variable pour des couplages particuliers, nombre de ces réactifs sont disponibles dans le commerce.
Carbodiimides
Les carbodiimides tels que le dicyclohexylcarbodiimide (DCC) et le diisopropylcarbodiimide (DIC) sont fréquemment utilisés pour la formation de liaisons amide. La réaction se déroule par l' intermédiaire de la formation d'un réactif hautement O -acyliso urée . Cet intermédiaire réactif est attaqué par l'amine N-terminale du peptide, formant une liaison peptidique. Formation de l' O de l'urée se déroule plus rapidement dans les solvants non polaires tels que le dichlorométhane.
Le DIC est particulièrement utile pour le SPPS car, en tant que liquide, il est facilement distribué et le sous-produit d' urée est facilement éliminé par lavage. À l'inverse, le carbodiimide apparenté 1-éthyl-3-(3-diméthylaminopropyl)carbodiimide (EDC) est souvent utilisé pour les couplages peptidiques en phase solution car son sous-produit d'urée peut être éliminé par lavage pendant le traitement aqueux .
L'activation du carbodiimide ouvre la possibilité d'une racémisation de l'acide aminé activé. La racémisation peut être contournée avec des additifs « supprimant la racémisation » tels que les triazoles 1-hydroxy-benzotriazole (HOBt) et 1-hydroxy-7-aza-benzotriazole (HOAt). Ces réactifs attaquent l' intermédiaire O- acylisourée pour former un ester actif , qui réagit ensuite avec le peptide pour former la liaison peptidique souhaitée. Le cyanohydroxyiminoacétate d'éthyle (Oxyma), un additif pour le couplage carbodiimide, agit comme une alternative au HOAt.
Sels d'aminium/uronium et de phosphonium
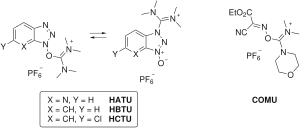
Certains réactifs de couplage omettent complètement le carbodiimide et incorporent la fraction HOAt/HOBt sous la forme d'un sel d'aminium/uronium ou de phosphonium d'un anion non nucléophile ( tétrafluoroborate ou hexafluorophosphate ). Des exemples de réactifs aminium/uronium comprennent HATU (HOAt), HBTU / TBTU (HOBt) et HCTU (6-ClHOBt). HBTU et TBTU ne diffèrent que par le choix de l'anion. Les réactifs au phosphonium comprennent PyBOP (HOBt) et PyAOP (HOAt).
Ces réactifs forment la même espèce ester active que les conditions d'activation du carbodiimide, mais diffèrent par la vitesse de l'étape d'activation initiale, qui est déterminée par la nature du squelette carboné du réactif de couplage. De plus, les réactifs aminium/uronium sont capables de réagir avec l'extrémité N-terminale du peptide pour former un sous-produit guanidino inactif , alors que les réactifs phosphonium ne le sont pas.
Anhydride d'acide propanephosphonique
Depuis la fin des années 2000, l' anhydride d'acide propanephosphonique , vendu dans le commerce sous divers noms tels que "T3P", est devenu un réactif utile pour la formation de liaisons amide dans des applications commerciales. Il convertit l'oxygène de l'acide carboxylique en un groupe partant, dont les sous-produits de couplage peptidique sont solubles dans l'eau et peuvent être facilement éliminés. Dans une comparaison des performances entre l'anhydride d'acide propanephosphonique et d'autres réactifs de couplage peptidique pour la préparation d'un médicament nonapeptide, il a été constaté que ce réactif était supérieur aux autres réactifs en termes de rendement et de faible épimérisation.
Supports solides
Les supports solides pour la synthèse peptidique sont sélectionnés pour leur stabilité physique, afin de permettre la filtration rapide des liquides. Les supports appropriés sont inertes vis-à-vis des réactifs et des solvants utilisés pendant la SPPS, bien qu'ils doivent gonfler dans les solvants utilisés pour permettre la pénétration des réactifs et permettre la fixation du premier acide aminé.
Les trois principaux types de supports solides sont : les supports de type gel, les supports de type surface et les composites. Les améliorations apportées aux supports solides utilisés pour la synthèse de peptides améliorent leur capacité à résister à l'utilisation répétée de TFA pendant l'étape de déprotection de SPPS. Deux résines primaires sont utilisées, selon que l'on souhaite un acide ou un amide carboxylique C-terminal. La résine Wang était, à partir de 1996, la résine la plus couramment utilisée pour les peptides avec des acides carboxyliques C-terminaux.
Régimes de protection des groupes
Comme décrit ci-dessus, l'utilisation de groupes protecteurs N-terminaux et de chaîne latérale est essentielle pendant la synthèse peptidique pour éviter des réactions secondaires indésirables, telles que l'auto-couplage de l'acide aminé activé conduisant à (la polymérisation ). Cela entrerait en compétition avec la réaction de couplage peptidique prévue, entraînant un faible rendement ou même un échec complet de la synthèse du peptide souhaité.
Deux principaux schémas de groupes protecteurs orthogonaux existent pour une utilisation dans la synthèse de peptides en phase solide : les approches dites Boc/Bzl et Fmoc/ t Bu. La stratégie Boc/Bzl utilise une protection Boc N-terminale labile au TFA ainsi qu'une protection des chaînes latérales qui est éliminée à l'aide de fluorure d'hydrogène anhydre lors de l'étape de clivage final (avec clivage simultané du peptide du support solide). Fmoc/tBu SPPS utilise une protection N-terminale Fmoc labile aux bases , avec une protection des chaînes latérales et une liaison résine qui sont labiles aux acides (le clivage acide final est effectué via un traitement au TFA).
Les deux approches, y compris les avantages et les inconvénients de chacune, sont décrites plus en détail ci-dessous.
Boc/Bzl SPPS
Des méthodes plus anciennes pour la synthèse de peptides avant l'avènement de SPSS reposaient sur le tert- butyloxycarbonyle (en abrégé « Boc ») en tant que groupe protecteur N-amino temporaire N-terminal. Le groupe Boc est éliminé avec un acide, tel que l'acide trifluoroacétique (TFA). Cela forme un groupe amino chargé positivement en présence d'un excès de TFA (notez que le groupe amino n'est pas protoné dans l'image de droite), qui est neutralisé et couplé à l'acide aminé activé entrant. La neutralisation peut se produire soit avant le couplage, soit in situ pendant la réaction de couplage basique.
L'approche Boc/Bzl conserve son utilité pour réduire l' agrégation peptidique lors de la synthèse. De plus, Boc/Bzl SPPS peut être préféré à l' approche Fmoc/ t Bu lors de la synthèse de peptides contenant des fragments sensibles aux bases (tels que les depsipeptides ), car un traitement avec une base est requis pendant l'étape de déprotection Fmoc (voir ci-dessous).
Les groupes protecteurs permanents de chaîne latérale utilisés pendant Boc/Bzl SPPS sont typiquement des groupes benzyle ou à base de benzyle. L'élimination finale du peptide du support solide se produit simultanément avec la déprotection de la chaîne latérale en utilisant du fluorure d'hydrogène anhydre via un clivage hydrolytique. Le produit final est un sel de fluorure qui est relativement facile à solubiliser. Des piégeurs tels que le crésol doivent être ajoutés au HF afin d'empêcher les cations t- butyle réactifs de générer des produits indésirables. Un inconvénient de cette approche est le potentiel de dégradation du peptide par le fluorure d'hydrogène.
Fmoc/ t Bu SPPS

L'utilisation de la protection Fmoc N-terminale permet un schéma de déprotection plus doux que celui utilisé pour Boc/Bzl SPPS, et ce schéma de protection est vraiment orthogonal dans des conditions SPPS. La déprotection Fmoc utilise une base, généralement 20 à 50 % de pipéridine dans du DMF . L'amine exposée est donc neutre, et par conséquent aucune neutralisation du peptide-résine n'est requise, comme dans le cas de l'approche Boc/Bzl. L'absence de répulsion électrostatique entre les chaînes peptidiques peut cependant conduire à un risque accru d'agrégation avec Fmoc/ t Bu SPPS. Étant donné que le groupe fluorényle libéré est un chromophore, la déprotection de Fmoc peut être contrôlée par l'absorbance UV du mélange réactionnel, une stratégie qui est utilisée dans les synthétiseurs de peptides automatisés.
La capacité du groupe Fmoc à être clivé dans des conditions basiques relativement douces tout en étant stable à l'acide permet l'utilisation de groupes protecteurs de chaîne latérale tels que Boc et t Bu qui peuvent être éliminés dans des conditions de clivage final acides plus doux que ceux utilisés pour clivage final en Boc/Bzl SPPS (HF). Des piégeurs tels que l'eau et le triisopropylsilane (TIPS) sont ajoutés lors du clivage final afin d'empêcher les réactions secondaires avec les espèces cationiques réactives libérées à la suite de la déprotection de la chaîne latérale. Le peptide brut résultant est obtenu sous forme de sel de TFA, qui est potentiellement plus difficile à solubiliser que les sels de fluorure générés dans Boc SPPS.
Fmoc/ t Bu SPPS est moins économique en atomes , car le groupe fluorényle est beaucoup plus grand que le groupe Boc. En conséquence, les prix des acides aminés Fmoc étaient élevés jusqu'à ce que le pilotage à grande échelle de l'un des premiers médicaments peptidiques synthétisés, l' enfuvirtide , commence dans les années 1990, lorsque la demande du marché a ajusté les prix relatifs des acides aminés Fmoc- vs Boc-.
Autres groupes protecteurs
Benzyloxy-carbonyle
Le groupe (Z) est un autre groupe protecteur d'amine de type carbamate, découvert par Leonidas Zervas au début des années 1930 et généralement ajouté par réaction avec le chloroformiate de benzyle .
Il est éliminé dans des conditions difficiles à l'aide de HBr dans de l'acide acétique ou dans des conditions plus douces d' hydrogénation catalytique .
Cette méthodologie a été utilisée pour la première fois dans la synthèse d'oligopeptides par Zervas et Max Bergmann en 1932. Par conséquent, elle est devenue connue sous le nom de synthèse Bergmann-Zervas, qui a été caractérisée par une « fabrication d'époque » et a contribué à établir la chimie synthétique des peptides comme un domaine distinct. Il s'agissait de la première méthode de laboratoire utile pour la synthèse peptidique contrôlée, permettant la synthèse de peptides auparavant inaccessibles avec des chaînes latérales réactives, tandis que les acides aminés protégés par Z sont également empêchés de subir une racémisation .
L'utilisation de la méthode Bergmann-Zervas est restée la pratique standard en chimie des peptides pendant deux décennies complètes après sa publication, remplacée par des méthodes plus récentes (telles que le groupe protecteur Boc) au début des années 1950. De nos jours, alors qu'il a été utilisé périodiquement pour la protection des -amines, il est beaucoup plus couramment utilisé pour la protection des chaînes latérales.
Alloc et groupes divers
Le groupe protecteur allyloxycarbonyle (alloc) est parfois utilisé pour protéger un groupe amino (ou un groupe acide carboxylique ou alcool) lorsqu'un schéma de déprotection orthogonal est requis. Il est également parfois utilisé lors de la formation de peptides cycliques sur résine, où le peptide est lié à la résine par un groupe fonctionnel de chaîne latérale. Le groupe Alloc peut être éliminé à l'aide de tétrakis(triphénylphosphine)palladium(0) .
Pour des applications spéciales telles que des étapes de synthèse impliquant des puces à protéines , des groupes protecteurs parfois appelés « lithographiques » sont utilisés, qui se prêtent à la photochimie à une longueur d'onde de lumière particulière, et qui peuvent donc être éliminés lors d'opérations de type lithographique .
Formation de liaisons disulfure régiosélectives
La formation de multiples disulfures natifs reste un défi pour la synthèse de peptides natifs par des méthodes en phase solide. La combinaison de chaînes aléatoires donne généralement plusieurs produits avec des liaisons disulfure non natives. La formation par étapes de liaisons disulfure est typiquement la méthode préférée, et réalisée avec des groupes protecteurs de thiol. Différents groupes protecteurs de thiol fournissent de multiples dimensions de protection orthogonale. Ces cystéines protégées orthogonalement sont incorporées lors de la synthèse en phase solide du peptide. L'élimination successive de ces groupes, pour permettre une exposition sélective des groupes thiol libres, conduit à la formation de disulfure par étapes. L'ordre de suppression des groupes doit être pris en compte de manière à ce qu'un seul groupe soit supprimé à la fois.
Les groupes protecteurs de thiol utilisés dans la synthèse peptidique nécessitant la formation ultérieure de liaisons disulfure régiosélectives doivent posséder de multiples caractéristiques. Premièrement, ils doivent être réversibles avec des conditions qui n'affectent pas les chaînes latérales non protégées. Deuxièmement, le groupe protecteur doit être capable de résister aux conditions de la synthèse en phase solide. Troisièmement, l'élimination du groupe protecteur de thiol doit être telle qu'elle laisse intacts les autres groupes de protection de thiol, si une protection orthogonale est souhaitée. C'est-à-dire que l'élimination du PG A ne devrait pas affecter le PG B. Certains des groupes protecteurs de thiol couramment utilisés comprennent l'acétamidométhyle (Acm), le tert-butyle (But), le 3-nitro-2-pyridine sulfényle (NPYS), le 2- les groupes pyridine-sulfényle (Pyr) et trityle (Trt). Il est important de noter que le groupe NPYS peut remplacer l'Acm PG pour produire un thiol activé.
En utilisant cette méthode, Kiso et ses collègues ont signalé la première synthèse totale d'insuline en 1993. Dans ce travail, la chaîne A de l'insuline a été préparée avec les groupes protecteurs suivants en place sur ses cystéines : CysA6 (But), CysA7 (Acm) et CysA11(Mais), laissant CysA20 sans protection.
Synthèse peptidique assistée par micro-ondes
La synthèse peptidique assistée par micro-ondes a été utilisée pour compléter de longues séquences peptidiques avec des degrés de rendement élevés et de faibles degrés de racémisation.
Synthétiser de longs peptides
L'élongation par étapes, dans laquelle les acides aminés sont connectés à tour de rôle, est idéale pour les petits peptides contenant entre 2 et 100 résidus d'acides aminés. Une autre méthode est la condensation de fragments , dans laquelle des fragments peptidiques sont couplés. Bien que le premier puisse allonger la chaîne peptidique sans racémisation , le rendement chute si seulement il est utilisé dans la création de peptides longs ou très polaires. La condensation de fragments est meilleure que l'allongement par étapes pour la synthèse de peptides longs sophistiqués, mais son utilisation doit être restreinte afin de se protéger contre la racémisation. La condensation du fragment est également indésirable car le fragment couplé doit être en excès grossier, ce qui peut être une limitation en fonction de la longueur du fragment.
Un nouveau développement pour produire des chaînes peptidiques plus longues est la ligature chimique : les chaînes peptidiques non protégées réagissent de manière chimiosélective en solution aqueuse. Un premier produit contrôlé cinétiquement se réarrange pour former la liaison amide. La forme la plus courante de ligature chimique native utilise un thioester peptidique qui réagit avec un résidu cystéine terminal.
D'autres méthodes applicables pour lier de manière covalente des polypeptides en solution aqueuse comprennent l'utilisation d' intéines divisées , la formation spontanée de liaisons isopeptidiques et la ligature de sortase .
Afin d'optimiser la synthèse des peptides longs , une méthode a été développée dans la Medicon Valley pour convertir les séquences peptidiques . La pré-séquence simple (par exemple Lysine (Lysn); Acide glutamique (Glun); (LysGlu)n) qui est incorporée à l' extrémité C-terminale du peptide pour induire une structure de type hélice alpha . Cela peut potentiellement augmenter la demi-vie biologique , améliorer la stabilité des peptides et inhiber la dégradation enzymatique sans altérer l'activité pharmacologique ou le profil d'action.
Peptides cycliques
Sur la cyclisation de la résine
Les peptides peuvent être cyclisés sur un support solide. Une variété de réactifs de cyclisation peuvent être utilisés tels que HBTU/HOBt/DIEA, PyBop/DIEA, PyClock/DIEA. Des peptides tête-bêche peuvent être réalisés sur le support solide. La déprotection de l'extrémité C-terminale à un certain point approprié permet une cyclisation sur résine par formation de liaison amide avec l'extrémité N-terminale déprotégée. Une fois la cyclisation effectuée, le peptide est clivé de la résine par acidolyse et purifié.
La stratégie pour la synthèse en phase solide de peptides cycliques n'est pas limitée à la fixation par les chaînes latérales Asp, Glu ou Lys. La cystéine a un groupe sulfhydryle très réactif sur sa chaîne latérale. Un pont disulfure est créé lorsqu'un atome de soufre d'une cystéine forme une seule liaison covalente avec un autre atome de soufre d'une seconde cystéine dans une partie différente de la protéine. Ces ponts aident à stabiliser les protéines, en particulier celles sécrétées par les cellules. Certains chercheurs utilisent des cystéines modifiées à l'aide de S-acétomidométhyle (Acm) pour bloquer la formation de la liaison disulfure tout en préservant la cystéine et la structure primaire d'origine de la protéine.
cyclisation hors résine
La cyclisation hors résine est une synthèse en phase solide d'intermédiaires clés, suivie de la cyclisation clé en phase solution, la déprotection finale de toutes les chaînes latérales masquées est également effectuée en phase solution. Cela présente les inconvénients que les efficacités de la synthèse en phase solide sont perdues dans les étapes de la phase en solution, que la purification des sous-produits, des réactifs et du matériel non converti est nécessaire, et que des oligomères indésirables peuvent être formés si la formation de macrocycle est impliquée.
L'utilisation d'esters de pentafluorophényle (FDPP, PFPOH) et de BOP-Cl est utile pour la cyclisation des peptides.
Voir également
Les références
Lectures complémentaires
- Stewart JM, Young JD (1984). Synthèse peptidique en phase solide (2e éd.). Rockford, Illinois : Pierce Chemical Company. p. 91. ISBN 978-0-935940-03-9.
- Kent, Stephen BH (1988). "Synthèse chimique de peptides et de protéines". Revue annuelle de biochimie . 57 . Palo Alto, Californie : Examens annuels. p. 957-989. doi : 10.1146/annurev.bi.57.070188.004521 . PMID 3052294 .
- Atherton E, Sheppard RC (1989). Synthèse peptidique en phase solide : une approche pratique . Oxford, Angleterre : IRL Press. ISBN 978-0-19-963067-7.
- Chan W, White P, éd. (2000). Synthèse peptidique en phase solide Fmoc : une approche pratique . Série Approche Pratique, Numéro 222. Oxford, Royaume-Uni : Oxford University Press. ISBN 0199637245. Consulté le 12 novembre 2016 .
- Fields GB (février 2002). "Introduction à la synthèse peptidique" . Protocoles actuels en science des protéines . Chapitre 18 : 18.1.1–18.1.9. doi : 10.1002/0471140864.ps1801s26 . ISBN 978-0-471-14086-3. PMC 3564544 . PMID 18429226 .
- Bodanszky, M. (2012). Principes de la synthèse peptidique . Réactivité et structure : concepts en chimie organique, volume 16. New York, NY : Springer Science & Business Media. ISBN 978-3642967634. Consulté le 12 novembre 2016 .
- Bodanszky M, Bodanszky A (2013). La pratique de la synthèse peptidique . Réactivité et structure : concepts en chimie organique, volume 21. New York, NY : Springer Science & Business Media. ISBN 978-3-642-96835-8. Consulté le 12 novembre 2016 .
- Benoiton NL (2016). Chimie de la synthèse peptidique . Boca Raton, Floride : CRC Press / Taylor & Frances. ISBN 978-1-4200-2769-3. Consulté le 12 novembre 2016 .
- Laconde G, Desroses M (2016). Réactifs de couplage de protocoles synthétiques dans la synthèse d'amides . Montpellier, France : Helixem. ISBN 978-1-4200-2769-3. Archivé de l'original (blog commercial) le 26 octobre 2013 . Consulté le 12 novembre 2016 .