Groupe phényle - Phenyl group
En chimie organique , le groupe phényle , ou cycle phényle , est un groupe cyclique d' atomes de formule C 6 H 5 . Les groupes phényle sont étroitement liés au benzène et peuvent être considérés comme un cycle benzénique, moins un hydrogène, qui peut être remplacé par un autre élément ou composé pour servir de groupe fonctionnel . Les groupes phényle ont six atomes de carbone liés ensemble dans un cycle plan hexagonal , dont cinq sont liés à des atomes d'hydrogène individuels, le carbone restant étant lié à un substituant . Les groupes phényle sont courants en chimie organique . Bien que souvent représentés avec des liaisons doubles et simples alternées, les groupes phényle sont chimiquement aromatiques et ont des longueurs de liaison égales entre les atomes de carbone dans le cycle.
Nomenclature
Habituellement, un "groupe phényle" est synonyme de C 6 H 5 - et est représenté par le symbole Ph ou, archaïquement, Φ . Le benzène est parfois appelé PhH. Les groupes phényle sont généralement attachés à d'autres atomes ou groupes. Par exemple, le triphénylméthane (Ph 3 CH) a trois groupes phényle attachés au même centre carboné. De nombreux ou même la plupart des composés phényles ne sont pas décrits avec le terme « phényle ». Par exemple, le dérivé chloré C 6 H 5 Cl est normalement appelé chlorobenzène , bien qu'il puisse être appelé chlorure de phényle. Dans des cas particuliers (et rares), des groupes phényle isolés sont détectés : l'anion phényle (C 6 H 5 − ), le cation phényle (C 6 H 5 + ), et le radical phényle (C 6 H 5 • ).
Bien que Ph et phényle désignent uniquement C 6 H 5 , les dérivés substitués sont également décrits en utilisant la terminologie phényle. Par exemple, O 2 NC 6 H 4 est un nitrophényle et F 5 C 6 est un pentafluorophényle. Les groupes phényle monosubstitués (c'est-à-dire les benzènes disubstitués) sont associés à des réactions de substitution aromatique électrophile et les produits suivent le schéma de substitution arène . Ainsi, un composé phényle substitué donné a trois isomères, ortho (1,2-disubstitution), méta (1,3-disubstitution) et para (1,4-disubstitution). Un composé phényle disubstitué (benzène trisubstitué) peut être, par exemple, 1,3,5-trisubstitué ou 1,2,3-trisubstitué. Des degrés de substitution plus élevés, dont le groupe pentafluorophényle est un exemple, existent et sont nommés selon la nomenclature IUPAC.
Étymologie
Le phényle est dérivé du mot français phényle , qui à son tour dérive du grec φαίνω ( phaino ), « brillant », car les premiers composés phényliques nommés étaient des sous-produits de la fabrication et du raffinage de divers gaz utilisés pour l'éclairage . Selon McMurry, "Le mot est dérivé du grec phéno ("Je porte la lumière"), commémorant la découverte du benzène par Michael Faraday en 1825 à partir des résidus huileux laissés par le gaz d'éclairage utilisé dans les réverbères de Londres.
Structure, collage et caractérisation
Les composés phényliques sont dérivés du benzène (C 6 H 6 ), au moins conceptuellement et souvent en termes de leur production. En termes de propriétés électroniques, le groupe phényle est lié à un groupe vinyle . Il est généralement considéré comme un groupe à retrait inductif (- I ), en raison de l'électronégativité plus élevée des atomes de carbone sp 2 , et un groupe donneur de résonance (+ M ), en raison de la capacité de son système à donner une densité électronique lorsque la conjugaison est possible . Le groupe phényle est hydrophobe . Les groupes phényle ont tendance à résister à l'oxydation et à la réduction. Les groupes phényle (comme tous les composés aromatiques) ont une stabilité améliorée par rapport à une liaison équivalente dans les groupes aliphatiques (non aromatiques). Cette stabilité accrue est due aux propriétés uniques des orbitales moléculaires aromatiques .
Les longueurs des liaisons entre les atomes de carbone dans un groupe phényle sont d' environ 1,4 Å .
En spectroscopie RMN 1 H , les protons d'un groupe phényle ont généralement des déplacements chimiques d' environ 7,27 ppm. Ces déplacements chimiques sont influencés par le courant du cycle aromatique et peuvent changer en fonction des substituants.
Préparation, occurrence et applications
Les groupes phényle sont généralement introduits à l'aide de réactifs qui se comportent comme des sources de l'anion phényle ou du cation phényle. Les réactifs représentatifs comprennent le phényllithium (C 6 H 5 Li) et le bromure de phénylmagnésium (C 6 H 5 MgBr). Les électrophiles attaquent le benzène pour donner des dérivés phénylés :
- C 6 H 6 + E + → C 6 H 5 E + H +
où E + (l'"électrophile") = Cl + , NO 2 + , SO 3 . Ces réactions sont appelées substitutions aromatiques électrophiles .
- Composés représentatifs contenant des groupes phényle
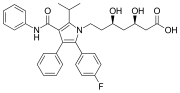
Atorvastatine (Lipitor) , un médicament vedette comportant deux groupes phényle et un groupe p- fluorophényle. Il est utilisé pour abaisser le cholestérol chez les personnes souffrant d' hypercholestérolémie .
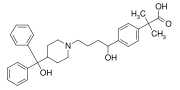
Fexofénadine (Allegra, Telfast) , un autre médicament à succès, qui comporte un groupe diphénylméthyle ainsi qu'un groupe p - phénylène (C 6 H 4 ). C'est un antihistaminique utilisé pour traiter les allergies .
Phénylalanine , un acide aminé commun.
Biphényle , constitué de deux groupes phényle. Les deux anneaux ont tendance à ne pas être coplanaires.
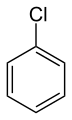
Chlorobenzène (ou chlorure de phényle), un solvant.
Les groupes phényle sont présents dans de nombreux composés organiques, à la fois naturels et synthétiques (voir figure). Le plus courant parmi les produits naturels est l' acide aminé phénylalanine , qui contient un groupe phényle. Un produit majeur de l' industrie pétrochimique est le " BTX " composé de benzène, de toluène et de xylène - qui sont tous des éléments constitutifs des composés phényliques. Le polymère polystyrène est dérivé d'un monomère contenant du phényle et doit ses propriétés à la rigidité et à l'hydrophobie des groupes phényle. De nombreux médicaments ainsi que de nombreux polluants contiennent des cycles phényle. L'un des composés contenant du phényle les plus simples est le phénol , C 6 H 5 OH. On dit souvent que la stabilité de résonance du phénol en fait un acide plus fort que celui des alcools aliphatiques tels que l' éthanol ( p K a = 10 vs 16-18). Cependant, une contribution significative est la plus grande électronégativité du carbone sp 2 alpha dans le phénol par rapport au carbone sp 3 alpha dans les alcools aliphatiques.
Les références
Liens externes
-
 Médias liés au groupe Phenyl sur Wikimedia Commons
Médias liés au groupe Phenyl sur Wikimedia Commons