Acide phosphatidique - Phosphatidic acid
Les acides phosphatidiques sont des phospholipides anioniques importants pour la signalisation cellulaire et l'activation directe des canaux ioniques lipidiques . L'hydrolyse de l'acide phosphatidique donne naissance à une molécule de glycérol et d'acide phosphorique et à deux molécules d'acides gras. Ils constituent environ 0,25% des phospholipides de la bicouche.
Structure
L'acide phosphatidique est constitué d'un squelette de glycérol , avec, en général, un acide gras saturé lié au carbone -1, un acide gras insaturé lié au carbone -2 et un groupe phosphate lié au carbone -3.
Formation et dégradation
Outre la synthèse de novo, PA peut être formé de trois manières :
- Par la phospholipase D (PLD), via l'hydrolyse de la liaison PO de la phosphatidylcholine (PC) pour produire du PA et de la choline .
- Par la phosphorylation du diacylglycérol (DAG) par la DAG kinase (DAGK)
- Par l'acylation de l' acide lysophosphatidique par la lysoPA-acyltransférase (LPAAT) ; c'est la voie la plus courante .
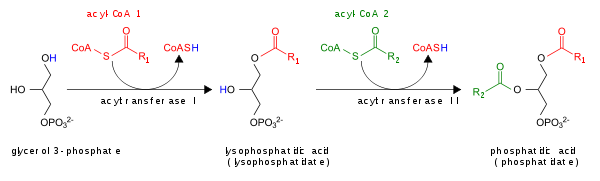
Le PA est dégradé par conversion en DAG par les lipides phosphate phosphohydrolases (LPP) ou en lyso-PA par la phospholipase A (PLA).
Rôles dans la cellule
Le rôle de l'AP dans la cellule peut être divisé en trois catégories :
- L'AP est le précurseur de la biosynthèse de nombreux autres lipides.
- Les propriétés physiques du PA influencent la courbure de la membrane.
- L'AP agit comme un lipide de signalisation, recrutant des protéines cytosoliques vers les membranes appropriées (par exemple, la sphingosine kinase 1 ).
- L'AP joue un rôle très important dans la phototransduction chez la drosophile
- L'AP est un ligand lipidique qui régule les canaux ioniques. Voir aussi les canaux ioniques lipidiques .
Les trois premiers rôles ne s'excluent pas mutuellement. Par exemple, le PA peut être impliqué dans la formation des vésicules en favorisant la courbure de la membrane et en recrutant les protéines pour effectuer la tâche beaucoup plus énergétiquement défavorable de la formation du cou et du pincement.
Rôles dans la biosynthèse
L'AP est un lipide cellulaire vital qui agit comme un précurseur biosynthétique pour la formation (directe ou indirecte) de tous les lipides acylglycérols dans la cellule.
Dans les cellules de mammifères et de levure , deux voies différentes sont connues pour la synthèse de novo de PA, la voie du glycérol 3-phosphate ou la voie du dihydroxyacétone phosphate. Chez les bactéries, seule la première voie est présente et les mutations qui bloquent cette voie sont mortelles, démontrant l'importance de l'AP. Dans les cellules de mammifères et de levure, où les enzymes de ces voies sont redondantes, la mutation d'une enzyme n'est pas mortelle. Cependant, il convient de noter qu'in vitro , les différentes acyltransférases présentent des spécificités de substrat différentes par rapport aux acyl-CoA qui sont incorporés dans le PA. Différentes acyltransférases ont également des distributions intracellulaires différentes, telles que le réticulum endoplasmique (RE), les mitochondries ou les peroxysomes, et des concentrations locales d'acides gras activés. Cela suggère que les diverses acyltransférases présentes dans les cellules de mammifères et de levure peuvent être responsables de la production de différents pools de PA.
La conversion du PA en diacylglycérol (DAG) par les LPP est l'étape d'engagement pour la production de phosphatidylcholine (PC), de phosphatidyléthanolamine (PE) et de phosphatidylsérine (PS). De plus, le DAG est également converti en CDP-DAG, qui est un précurseur du phosphatidylglycérol (PG), du phosphatidylinositol (PI) et des phosphoinositides (PIP, PIP 2 , PIP 3 ).
Les concentrations de PA sont maintenues à des niveaux extrêmement bas dans la cellule par l'activité de puissants LPP. Ceux-ci convertissent très rapidement le PA en DAG et, comme le DAG est le précurseur de tant d'autres lipides, il est également rapidement métabolisé en d'autres lipides membranaires. Cela signifie que toute régulation à la hausse de la production d'AP peut être associée, au fil du temps, à une régulation à la hausse correspondante des LPP et des enzymes métabolisant les DAG.
L'AP est donc essentiel pour la synthèse des lipides et la survie cellulaire, mais, dans des conditions normales, il est maintenu à des niveaux très bas dans la cellule.
Propriétés biophysiques
Le PA est un phospholipide unique en ce qu'il possède un petit groupe de tête hautement chargé qui est très proche du squelette du glycérol. L'AP est connu pour jouer des rôles à la fois dans la fission et la fusion des vésicules , et ces rôles peuvent être liés aux propriétés biophysiques de l'AP.
Aux sites de bourgeonnement ou de fusion membranaire, la membrane devient ou est fortement incurvée. Un événement majeur dans le bourgeonnement des vésicules, telles que les transporteurs de l'appareil de Golgi , est la création et le rétrécissement subséquent du col membranaire. Des études ont suggéré que ce processus pourrait être induit par les lipides et ont postulé un rôle central pour le DAG en raison de sa forme moléculaire unique. La présence de deux chaînes acyles mais pas de groupe de tête entraîne une grande courbure négative dans les membranes.
Le LPAAT BARS-50 a également été impliqué dans le bourgeonnement du Golgi. Cela suggère que la conversion du lysoPA en PA pourrait affecter la courbure de la membrane. L'activité LPAAT double le nombre de chaînes acyles, augmentant considérablement la section transversale du lipide qui se trouve «à l'intérieur» de la membrane tandis que le groupe de tête de surface reste inchangé. Cela peut entraîner une courbure de la membrane plus négative. Des chercheurs de l' Université d'Utrecht ont examiné l'effet du lysoPA par rapport au PA sur la courbure de la membrane en mesurant l'effet qu'ils ont sur la température de transition du PE des bicouches lipidiques aux phases non lamellaires à l'aide de la 31 P-RMN. La courbure induite par ces lipides s'est avérée dépendre non seulement de la structure du lysoPA par rapport au PA mais aussi de propriétés dynamiques, telles que l'hydratation des groupes de tête et les interactions inter- et intramoléculaires. Par exemple, Ca 2+ peut interagir avec deux PA pour former un complexe neutre mais fortement incurvé. La neutralisation des charges autrement répulsives des groupes de tête et l'absence de tout encombrement stérique permet de fortes interactions intermoléculaires entre les chaînes acyles, résultant en des microdomaines riches en PA. Ainsi, in vitro , les changements physiologiques du pH, de la température et des concentrations de cations ont de forts effets sur la courbure membranaire induite par le PA et le lysoPA. L'interconversion de lysoPA, PA et DAG - et les changements de pH et de concentration en cations - peuvent provoquer une flexion et une déstabilisation de la membrane, jouant un rôle direct dans la fission membranaire simplement en raison de leurs propriétés biophysiques. Cependant, bien qu'il ait été démontré que le PA et le lysoPA affectent la courbure de la membrane in vitro ; leur rôle in vivo n'est pas clair.
Les rôles de lysoPA, PA et DAG dans la promotion de la courbure membranaire n'excluent pas un rôle dans le recrutement de protéines à la membrane. Par exemple, l' exigence de Ca 2+ pour la fusion de liposomes complexes n'est pas grandement affectée par l'ajout d'annexine I, bien qu'elle soit réduite par la PLD. Cependant, avec l'annexine I et la PLD, l'étendue de la fusion est considérablement améliorée et le besoin en Ca 2+ est réduit de près de 1000 fois à des niveaux proches de la physiologie.
Ainsi, les rôles métaboliques, biophysiques, de recrutement et de signalisation de l'AP peuvent être interreliés.
Rôle dans la signalisation
L'AP est maintenu bas dans la masse de la membrane afin d'éclater transitoirement et de signaler localement à haute concentration. Par exemple, les canaux TREK-1 sont activés par association locale avec PLD et production de PA. La constante de dissociation du PA pour TREK-1 est d'environ 10 micromolaires. La liaison relativement faible combinée à une faible concentration de PA dans la membrane permet au canal de se désactiver. La concentration locale élevée pour l'activation suggère au moins certaines restrictions dans la diffusion locale des lipides. La faible concentration en masse de PA combinée à des salves locales élevées est à l'opposé de la signalisation PIP2. PIP2 est maintenu relativement haut dans la membrane puis hydrolysé de manière transitoire près d'une protéine afin de réduire de manière transitoire la signalisation PIP2. La signalisation PA reflète la signalisation PIP2 en ce que la concentration globale de lipide de signalisation n'a pas besoin de changer pour exercer un effet local puissant sur une protéine cible.
Comme décrit ci-dessus, le PLD hydrolyse le PC pour former du PA et de la choline . Parce que la choline est très abondante dans la cellule, l'activité PLD n'affecte pas de manière significative les niveaux de choline ; et la choline est peu susceptible de jouer un rôle dans la signalisation.
Le rôle de l'activation de la PLD dans de nombreux contextes de signalisation, combiné à l'absence de rôle pour la choline, suggère que l'AP est importante dans la signalisation. Cependant, le PA est rapidement converti en DAG, et le DAG est également connu pour être une molécule de signalisation. Cela soulève la question de savoir si l'AP a un rôle direct dans la signalisation ou s'il agit simplement comme un précurseur pour la production de DAG. S'il s'avère que le PA agit uniquement en tant que précurseur du DAG, on peut alors se demander pourquoi les cellules devraient produire du DAG en utilisant deux enzymes alors qu'elles contiennent le PLC qui pourrait produire du DAG en une seule étape.
Le PA produit par PLD ou par DAGK se distingue par l'ajout de [γ- 32 P]ATP. Cela montrera si le groupe phosphate est nouvellement dérivé de l'activité kinase ou s'il provient du PC.
Bien que PA et DAG soient interconvertibles, ils n'agissent pas dans les mêmes voies. Les stimuli qui activent la PLD n'activent pas les enzymes en aval de la DAG, et vice versa. Par exemple, il a été montré que l' ajout de PLD aux résultats des membranes dans la production de [ 32 P] et [PA marqué au 32 P] phosphoinositides marqués au . L'ajout d'inhibiteurs DAGK élimine la production de [ 32 P] PA mais pas marqué au la production stimulée PLD-de phosphoinositides.
Il est possible que, bien que PA et DAG soient interconvertibles, des pools séparés de lipides de signalisation et de non-signalisation puissent être maintenus. Des études ont suggéré que la signalisation DAG est médiée par le DAG polyinsaturé, alors que le PA dérivé du PLD est monoinsaturé ou saturé. Ainsi, le PA saturé/monoinsaturé fonctionnel peut être dégradé en l'hydrolysant pour former un DAG saturé/monoinsaturé non fonctionnel, tandis que le DAG polyinsaturé fonctionnel peut être dégradé en le convertissant en PA polyinsaturé non fonctionnel.
Ce modèle suggère que les effecteurs PA et DAG devraient être capables de distinguer les lipides avec les mêmes groupes de tête mais avec des chaînes acyles différentes. Bien que certaines protéines liant les lipides soient capables de s'insérer dans les membranes et pourraient hypothétiquement reconnaître le type de chaîne acyle ou les propriétés résultantes de la membrane, de nombreuses protéines liant les lipides sont cytosoliques et se localisent à la membrane en ne liant que les groupes de tête des lipides. Peut-être que les différentes chaînes acyles peuvent affecter l'angle du groupe de tête dans la membrane. Si tel est le cas, cela suggère qu'un domaine de liaison à PA doit non seulement être capable de lier spécifiquement PA, mais doit également être capable d'identifier les groupes de tête qui sont à l'angle correct. Quel que soit le mécanisme, une telle spécificité est possible. On le voit dans les testicules de porc DAGK qui est spécifique du DAG polyinsaturé et dans deux LPP d'hépatocytes de rat qui déphosphorylent différentes espèces de PA avec des activités différentes. De plus, il a été montré que la stimulation de l'activité SK1 par PS in vitro variait considérablement selon que les espèces dioléoyle (C18:1), distéaroyle (C18:0) ou 1-stéaroyle, 2-oléoyle de PS étaient utilisées. Ainsi, il semble que, bien que PA et DAG soient interconvertibles, les différentes espèces de lipides peuvent avoir des activités biologiques différentes ; et cela peut permettre aux deux lipides de maintenir des voies de signalisation séparées.
Mesure de la production de PA
Comme le PA est rapidement converti en DAG, sa durée de vie est très courte dans la cellule. Cela signifie qu'il est difficile de mesurer la production d'AP et donc d'étudier le rôle de l'AP dans la cellule. Cependant, l'activité PLD peut être mesurée par l'ajout d'alcools primaires à la cellule. PLD effectue alors une réaction de transphosphatidylation, au lieu d'hydrolyse, produisant des alcools phosphatidyliques à la place du PA. Les alcools phosphatidyliques sont des impasses métaboliques et peuvent être facilement extraits et mesurés. Ainsi, l'activité de PLD et la production de PA (sinon de PA lui-même) peuvent être mesurées et, en bloquant la formation de PA, l'implication de PA dans les processus cellulaires peut être déduite.

