Polyyne - Polyyne

En chimie , une polyyne ( / p ɒ l i aɪ n / ) est tout composé organique avec simple et triple alternance des liaisons ; c'est-à-dire une suite d' alcynes consécutifs , (−C≡C−)
mavec n supérieur à 1. Ces composés sont également appelés polyacétylènes , en particulier dans la littérature sur les produits naturels et l'écologie chimique, même si cette nomenclature fait plus précisément référence aux polymères d' acétylène composés de liaisons simples et doubles alternées (−CR=CR′−) . Ils sont aussi parfois appelés oligoynes , ou carbinoïdes après " carbyne " (−C≡C−)
??, l'allotrope hypothétique du carbone qui serait le membre ultime de la série. La synthèse de cette substance a été revendiquée à plusieurs reprises depuis les années 1960, mais ces rapports ont été contestés. En effet, les substances identifiées comme de courtes chaînes de "carbyne" dans de nombreuses premières tentatives de synthèse organique seraient aujourd'hui appelées polyynes.
Le polyyne le plus simple est le diacétylène ou le butadiyne, H−C≡C−C≡C−H. Avec les cumulènes , les polyynes se distinguent des autres chaînes organiques par leur rigidité et leur conductivité élevée, qui les rendent toutes deux prometteuses en nanotechnologie moléculaire . Des polyynes ont été détectés dans des nuages moléculaires interstellaires où l'hydrogène est rare.
Synthèse
La première synthèse rapportée d'un polyyne a été réalisée en 1869 par Carl Andreas Glaser , qui a observé que le phénylacétylure de cuivre (CuC 2 C 6 H 5 ) subit une dimérisation oxydative en présence d'air pour produire du diphénylbutadiyne (C 6 H 5 C 4 C 6 H 5 ).
L'intérêt pour ces composés a stimulé les recherches sur leur préparation par synthèse organique par plusieurs voies générales. En tant qu'outil synthétique principal, des réactions d'homocouplage d'acétylène telles que le couplage de Glaser ou ses protocoles associés d'Elinton et de Hay sont généralement utilisées. De plus, bon nombre de ces procédures impliquent un couplage Cadiot-Chodkiewicz ou des réactions similaires pour unir deux blocs de construction alcynes distincts ou par alkylation d'une unité polyyne préformée. En plus de cela, le réarrangement de Fritsch-Buttenberg-Wiechell a été utilisé comme étape cruciale lors de la synthèse du plus long polyyne connu (C 44 ). Une élimination des chlorovinylsilanes a été utilisée comme étape finale dans la synthèse des polyynes à terminaison phényle les plus longs connus.
Polyynes organiques et organosiliciés
Par diverses techniques, les polyynes H(−C≡C−)
mH avec n jusqu'à 4 ou 5 ont été synthétisés au cours des années 1950. Vers 1971, TR Johnson et DRM Walton ont développé l'utilisation d'embouts de la forme - SiR
3, où R était généralement un groupe éthyle , pour protéger la chaîne polyyne pendant la réaction de doublement de chaîne en utilisant le catalyseur de Hay (un complexe cuivre (I) - TMEDA ). Avec cette technique, ils ont pu obtenir des polyynes comme Et
3Si−(C≡C)
m−SiEt
3avec n jusqu'à 8 à l'état pur, et avec n jusqu'à 16 en solution. Plus tard, Tykwinski et ses collègues ont pu obtenir i Pr
3Si−(C≡C)
m−Si i Pr
3polyynes avec une longueur de chaîne jusqu'à C 20 .
Un composé polyyne à 10 unités acétyléniques (20 atomes), dont les extrémités sont coiffées par des polyéthers dendrimères aromatiques de type Fréchet , a été isolé et caractérisé en 2002. De plus, la synthèse de dicyanopolyynes comportant jusqu'à 8 unités acétyléniques a été rapportée. Les polyynes à terminaison phényle les plus longs ont été signalés par Cox et ses collègues en 2007. En 2010, le polyyne avec la chaîne la plus longue encore isolée avait 22 unités acétyléniques (44 atomes), coiffées de tris(3,5-di les groupes -t-butylphényl)méthyle .
Alcynes de formule H(−C≡C−)
mH et n de 2 à 6 peuvent être détectés dans les produits de décomposition de l' acétylure de cuivre(I) partiellement oxydé ( Cu+
)
2C2−
2(un dérivé de l'acétylène connu depuis 1856 ou avant) par l'acide chlorhydrique . Un résidu "carboné" laissé par la décomposition a également la signature spectrale de (−C≡C−)
m Chaînes.

Organométalliques
Les polyynes organométalliques coiffés de complexes métalliques sont bien caractérisés. Dès le milieu des années 2010, les recherches les plus intenses ont concerné le rhénium (ReC n Re, n = 6-20), le ruthénium (RuRuC n RuRu, n = 8-20), le fer (FeC 12 CFe), le platine (PtC n Complexes de Pt, n = 16–28), de palladium (ArC n Pd, n = 6–10) et de cobalt (Co 3 C n Co 3 , n = 14–26).

Stabilité
On dit que les longues chaînes de polyyne sont intrinsèquement instables en masse car elles peuvent se réticuler les unes avec les autres de manière exothermique. Les explosions sont un réel danger dans ce domaine de recherche. Ils peuvent être assez stables, même contre l'humidité et l' oxygène , si les atomes d'hydrogène terminaux sont remplacés par un groupe terminal convenablement inerte , tel que tert-butyle ou trifluorométhyle . Les groupes terminaux volumineux, qui peuvent séparer les chaînes, fonctionnent particulièrement bien pour stabiliser les polyynes. En 1995, la préparation de chaînes carbyne avec plus de 300 carbones a été signalée en utilisant cette technique. Cependant, le rapport a été contesté par une affirmation selon laquelle les molécules détectées étaient des structures de type fullerène plutôt que de longs polyynes.
Les chaînes polyynes ont également été stabilisées au chauffage par co-dépôt avec des nanoparticules d'argent et par complexation avec un acide de Lewis tridenté contenant du mercure pour former des adduits en couches. De longues chaînes polyynes encapsulées dans des nanotubes de carbone à double paroi se sont également avérées stables. Malgré une stabilité plutôt faible des polyynes plus longs, il existe quelques exemples de leur utilisation en tant que précurseurs synthétiques dans la synthèse organique et organométallique.
Structure
Polyynes synthétiques de la forme R−(−C≡C−)
m-R , avec n environ 8 ou plus, ont souvent un squelette légèrement incurvé ou hélicoïdal à l'état solide cristallin, probablement en raison d'effets de tassement cristallin. Par exemple, lorsque le capuchon R est du triisopropylsilyle et n est égal à 8, la cristallographie aux rayons X de la substance (un solide cristallin orange/jaune) montre l'épine dorsale courbée d'environ 25 à 30 degrés dans un large arc, de sorte que chaque C−C L'angle ≡C s'écarte de 3,1 degrés d'une ligne droite. Cette géométrie offre un garnissage plus dense, avec le capuchon volumineux d'une molécule adjacente niché dans le côté concave du squelette. En conséquence, la distance entre les squelettes des molécules voisines est réduite à environ 0,35 à 0,5 nm, près de la plage à laquelle on s'attend à une réticulation spontanée. Le composé est stable indéfiniment à basse température, mais se décompose avant de fondre. En revanche, les molécules homologues avec n = 4 ou n = 5 ont des squelettes presque droits qui restent distants d'au moins 0,5 à 0,7 nm et fondent sans se décomposer.
Occurrence naturelle
Origines biologiques
Un large éventail d'organismes synthétisent des polyynes. Ces produits chimiques ont diverses activités biologiques, notamment en tant qu'arômes et pigments, répulsifs chimiques et toxines, et peuvent être appliqués à la recherche biomédicale et aux produits pharmaceutiques. Chez les plantes, les polyynes se trouvent principalement dans le clade des Campanulidés , en particulier dans les familles du tournesol , de la carotte et du ginseng et de la campanule . Cependant, ils peuvent également être trouvés dans certains membres des familles de la tomate , de l' olax et du bois de santal . Le premier polyyne isolé était l'ester de déhydromatricaire (DME) en 1826; cependant, il n'a été complètement caractérisé que plus tard.
L'acide gras simple acide 8,10-octadécadiynoïque est isolé de l'écorce de racine de la légumineuse Paramacrolobium caeruleum de la famille des Caesalpiniaceae et a été étudié en tant qu'unité photopolymérisable dans les phospholipides synthétiques .
La thiarubrine B est le plus répandu parmi plusieurs pigments photosensibles apparentés qui ont été isolés de l' ambroisie géante ( Ambrosia trifida ), une plante utilisée en phytothérapie. Les thiarubrines ont une activité antibiotique, antivirale et nématocide , et une activité contre le VIH-1 qui est médiée par l'exposition à la lumière.
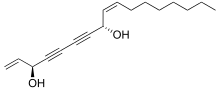
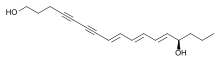
Des polyynes tels que le falcarindiol peuvent être trouvés dans les légumes Apiacées comme la carotte , le céleri , le fenouil , le persil et le panais où ils montrent des activités cytotoxiques. Les polyynes aliphatiques en C 17 du type falcarinol ont été décrits pour agir en tant que modulateurs métaboliques et sont étudiés en tant que nutraceutiques potentiellement bénéfiques pour la santé . Le falcarindiol est le principal composé responsable de l'amertume des carottes et est le plus actif parmi plusieurs polyynes ayant une activité anticancéreuse potentielle trouvée dans la massue du diable ( Oplopanax horridus ). D'autres polyynes de plantes comprennent l' œnanthotoxine et la cicutoxine , qui sont des poisons trouvés dans l'hydroptère ( Oenanthe spp. ) et la cicutaire ( Cicuta spp. ).
Ichthyothéréol est un genre de plantes dontconstituant actif est un polyyne appelé ichthyothereol . Ce composé est hautement toxique pour les poissons et les mammifères . Les feuilles d' Ichthyothere terminalis ont traditionnellement été utilisées pour fabriquer des appâts empoisonnés par les peuples autochtones du bassin inférieur de l' Amazone .
L'acide dihydromatricaire est un polyyne produit et sécrété par les coléoptères soldats en tant que défense chimique.
Dans l'espace
Les radicaux octatétraynyle et les radicaux hexatriynyle ainsi que leurs ions sont détectés dans l'espace où l'hydrogène est rare. De plus, il y a eu des allégations selon lesquelles des polyynes ont été trouvés dans des sites d'impact astronomique sur Terre dans le cadre du minéral Chaoite , mais cette interprétation a été contestée. Voir Astrochimie .