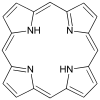
Porphyrine - Porphyrin
Les porphyrines ( / p ɔːr f ər ɪ n / POR -fər-in ) sont un groupe de hétérocyclique macrocycliques des composés organiques , composée de quatre modifiés pyrrole sous - unités reliées entre elles au niveau de leurs carbone alpha atomes via méthine ponts (= CH-). Le parent de la porphyrine est la porphine , un composé chimique rare d'intérêt exclusivement théorique. Les porphines substituées sont appelées porphyrines. Avec un total de 26 électrons , dont 18 électrons forment un cycle plan et continu, la structure cyclique de la porphyrine est souvent décrite comme aromatique . Un résultat du grand système conjugué est que les porphyrines absorbent généralement fortement dans la région visible du spectre électromagnétique, c'est-à-dire qu'elles sont profondément colorées. Le nom « porphyrine » dérive du mot grec πορφύρα ( porphyra ), signifiant violet .
Les complexes métalliques dérivés des porphyrines se produisent naturellement. L'une des familles les plus connues de complexes de porphyrine est l' hème , le pigment des globules rouges , un cofacteur de la protéine hémoglobine .
Complexes de porphyrines
- Porphyrines représentatives et dérivés
La porphine est la porphyrine la plus simple, un composé rare d'intérêt théorique.
Les dérivés de la protoporphyrine IX sont courants dans la nature, précurseurs des hèmes .
L'octaéthylporphyrine (H 2 OEP) est un analogue synthétique de la protoporphyrine IX. Contrairement aux ligands naturels de la porphyrine, l'OEP 2− est hautement symétrique.
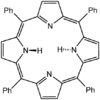
La tétraphénylporphyrine (H 2 TPP) est un autre analogue synthétique de la protoporphyrine IX. Contrairement aux ligands naturels de la porphyrine, le TPP 2− est hautement symétrique. Une autre différence est que ses centres méthyne sont occupés par des groupes phényle.
Vue simplifiée de l' hème , un complexe d'une protoporphyrine IX.
Les porphyrines sont les acides conjugués de ligands qui se lient aux métaux pour former des complexes . L' ion métallique a généralement une charge de 2+ ou 3+. Une équation schématique pour ces synthèses est montrée :
- H 2 porphyrine + [ML n ] 2+ → M(porphyrinate)L n−4 + 4 L + 2 H + , où M = ion métallique et L = un ligand
Une porphyrine sans ion métallique dans sa cavité est une base libre . Certaines porphyrines contenant du fer sont appelées hèmes. Les protéines contenant de l'hème , ou hémoprotéines , se trouvent abondamment dans la nature. L'hémoglobine et la myoglobine sont deux protéines de liaison à l' O 2 qui contiennent des porphyrines de fer. Divers cytochromes sont également des hémoprotéines.
Espèces apparentées
Une benzoporphyrine est une porphyrine avec un cycle benzénique fusionné à l'une des unités pyrrole. par exemple, la vertéporfine est un dérivé de la benzoporphyrine.
Plusieurs autres hétérocycles sont liés aux porphyrines. Ceux - ci comprennent corrines , chlorines , bactériochlorophylles et corphins . Les chlores (2,3-dihydroporphyrine) sont plus réduits, contiennent plus d'hydrogène que les porphyrines, c'est-à-dire qu'un pyrrole a été transformé en pyrroline . Cette structure se produit dans les chlorophylles . Le remplacement de deux des quatre sous-unités pyrroliques par des sous-unités pyrroliniques donne soit une bactériochlorine (telle que trouvée dans certaines bactéries photosynthétiques ) soit une isobactériochlorine, selon les positions relatives des anneaux réduits. Certains dérivés de porphyrine suivent la règle de Hückel , mais la plupart ne le font pas.
Formation naturelle
Une géoporphyrine, également appelée pétroporphyrine, est une porphyrine d'origine géologique. Ils peuvent se produire dans le pétrole brut , les schistes bitumineux , le charbon ou les roches sédimentaires. L'abelsonite est peut-être le seul minéral de géoporphyrine, car il est rare que les porphyrines soient isolées et forment des cristaux.
Synthèse
Biosynthèse
Chez les eucaryotes non photosynthétiques tels que les animaux, les insectes, les champignons et les protozoaires , ainsi que le groupe de bactéries -protéobactéries, l' étape engagée pour la biosynthèse de la porphyrine est la formation d' acide -aminolévulinique (δ-ALA, 5-ALA ou dALA) par la réaction de l' acide aminé glycine avec le succinyl-CoA du cycle de l'acide citrique . Chez les plantes , les algues , les bactéries (à l'exception du groupe des -protéobactéries) et les archées , il est produit à partir d'acide glutamique via le glutamyl-ARNt et le glutamate-1-sémialdéhyde . Les enzymes impliquées dans cette voie sont la glutamyl-ARNt synthétase , la glutamyl-ARNt réductase et la glutamate-1-semialdéhyde 2,1-aminomutase . Cette voie est connue sous le nom de voie C5 ou Beale.
Deux molécules de dALA sont ensuite combinées par la porphobilinogène synthase pour donner le porphobilinogène (PBG), qui contient un cycle pyrrole. Quatre PBG sont ensuite combinés par désamination en hydroxyméthyle bilane (HMB), qui est hydrolysé pour former le tétrapyrrole circulaire uroporphyrinogène III . Cette molécule subit un certain nombre de modifications supplémentaires. Les intermédiaires sont utilisés dans différentes espèces pour former des substances particulières, mais, chez l'homme, le principal produit final, la protoporphyrine IX, est combiné au fer pour former l'hème. Les pigments biliaires sont les produits de dégradation de l'hème.
Le schéma suivant résume la biosynthèse des porphyrines, avec des références par numéro CE et la base de données OMIM . La porphyrie associée au déficit de chaque enzyme est également montrée :
Synthèse en laboratoire

L'une des synthèses les plus courantes pour les porphyrines est la réaction de Rothemund , rapportée pour la première fois en 1936, qui est également la base de méthodes plus récentes décrites par Adler et Longo. Le schéma général est un processus de condensation et d' oxydation à partir du pyrrole et d'un aldéhyde .
Porphyrines isomères
Le premier isomère synthétique de la porphyrine a été rapporté par Emanual Vogel et ses collègues en 1986. Cet isomère [18]porphyrine-(2.0.2.0) est nommé porphycène et la cavité centrale N 4 forme un rectangle comme le montre la figure. Les porphycènes ont montré un comportement photophysique intéressant et ont trouvé un composé polyvalent vers la thérapie photodynamique . Cela a inspiré Vogel et Sessler à relever le défi de préparer la [18]porphyrine-(2.1.0.1) et l'a nommée Corrphycene ou Porphycerin . La troisième porphyrine qui est la [18]porphyrine-(2.1.1.0), a été rapportée par Callot et Vogel-Sessler. Vogel et ses collègues ont rapporté l'isolement réussi de [18]Porphyrin-(3.0.1.0) ou Isoporphycene . Le scientifique japonais Furuta et le scientifique polonais Latos-Grażyński ont presque simultanément signalé les porphyrines N-Confused . L'inversion de l'une des sous-unités pyrroliques dans le cycle macrocyclique a eu pour résultat de faire face à l'un des atomes d'azote à l'extérieur du noyau du macrocycle.
Applications
La thérapie photodynamique
Les porphyrines ont été évaluées dans le cadre de la thérapie photodynamique (PDT) car elles absorbent fortement la lumière, qui est ensuite convertie en énergie et chaleur dans les zones éclairées. Cette technique a été appliquée dans la dégénérescence maculaire à l' aide de vertéporfine .
La PDT est considérée comme un traitement anticancéreux non invasif, impliquant l'interaction entre la lumière d'une fréquence déterminée, un photosensibilisateur et l'oxygène. Cette interaction produit la formation d'espèces oxygénées hautement réactives (ROS), généralement de l'oxygène singulet, ainsi qu'un anion superoxyde, un radical hydroxyle libre ou du peroxyde d'hydrogène. Ces espèces d'oxygène hautement réactives réagissent avec des biomolécules organiques cellulaires sensibles telles que; des lipides, des acides aminés aromatiques et des bases hétérocycliques d'acides nucléiques, pour produire des radicaux oxydants qui endommagent la cellule, induisant éventuellement l'apoptose voire la nécrose.
Géochimie organique
Le domaine de la géochimie organique trouve son origine dans l'isolement des porphyrines du pétrole. Cette découverte a permis d'établir les origines biologiques du pétrole. Le pétrole est parfois "empreinte" par l'analyse de traces de nickel et de vanadyl porphyrines.
Toxicologie
La biosynthèse de l'hème est utilisée comme biomarqueur dans les études de toxicologie environnementale. Alors qu'une production excessive de porphyrines indique une exposition aux organochlorés , le plomb inhibe l' enzyme ALA déshydratase .
Applications potentielles
Catalyse biomimétique
Bien qu'ils ne soient pas commercialisés, les complexes de métalloporphyrine sont largement étudiés comme catalyseurs d'oxydation de composés organiques. Les complexes de méso - tétraphénylporphyrine et d' octaéthylporphyrine sont particulièrement appréciés pour de telles recherches en laboratoire . Les complexes avec Mn, Fe et Co catalysent une variété de réactions d'intérêt potentiel pour la synthèse organique . Certains complexes émulent l'action de diverses enzymes hémiques telles que le cytochrome P450 , la lignine peroxydase . Les métalloporphyrines sont également étudiées comme catalyseurs pour la séparation de l'eau, dans le but de générer de l'hydrogène moléculaire et de l'oxygène pour les piles à combustible.
Electronique moléculaire et capteurs
Les composés à base de porphyrine sont intéressants en tant que composants possibles de l'électronique moléculaire et de la photonique. Des colorants synthétiques de porphyrine ont été incorporés dans des prototypes de cellules solaires à colorant .
Les métalloporphyrines ont été étudiées en tant que capteurs.
Les phtalocyanines , qui sont structurellement apparentées aux porphyrines, sont utilisées dans le commerce comme colorants et catalyseurs, mais pas les porphyrines.
Chimie supramoléculaire


Les porphyrines sont souvent utilisées pour construire des structures en chimie supramoléculaire . Ces systèmes tirent parti de l'acidité de Lewis du métal, typiquement du zinc. Un exemple de complexe hôte-invité qui a été construit à partir d'un macrocycle composé de quatre porphyrines. Une porphyrine de base sans invité est liée au centre par coordination avec ses quatre substituants pyridine.
Intérêt théorique pour l'aromaticité
Les macrocycles porphyrinoïdes peuvent montrer une aromaticité variable. Une porphyrine aromatique de Hückel est le porphycène. des macrocycles porphyrinoïdes antiaromatiques , Mobius aromatiques et non aromatiques sont connus.
Voir également
- Une maladie liée à la porphyrine : la porphyrie
- Porphyrine coordonnée au fer : hème
- Un groupe d'enzymes contenant de l'hème : le cytochrome P450
- Porphyrine coordonnée au magnésium : chlorophylle
- Les analogues à un carbone plus court : les corroles , y compris la vitamine B 12 , qui est coordonné à un cobalt
- Corphins, la porphyrine hautement réduite coordonnée au nickel qui se lie au site actif du cofacteur F430 dans la méthyl coenzyme M réductase (MCR)
- Porphyrines substituées par l'azote : phtalocyanine
Galerie
Lecture UV-vis pour la méso- tétraphénylporphyrine