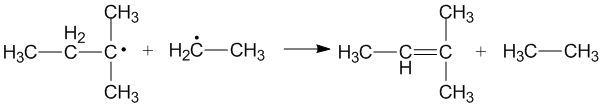Disproportion radicale - Radical disproportionation
La dismutation radicale englobe un groupe de réactions en chimie organique dans lesquelles deux radicaux réagissent pour former deux produits non radicaux différents. Les radicaux en chimie sont définis comme des atomes ou des molécules réactifs qui contiennent un ou des électrons non appariés dans une coquille ouverte. Les électrons non appariés peuvent rendre les radicaux instables et réactifs. Les réactions dans la chimie des radicaux peuvent générer à la fois radicaux et non radicaux produits . Des réactions de dismutation radicale peuvent se produire avec de nombreux radicaux en solution et en phase gazeuse . En raison de la nature réactive des molécules radicalaires, la dismutation se déroule rapidement et nécessite peu ou pas d' énergie d'activation . Les réactions de dismutation radicalaire les plus étudiées ont été menées avec des radicaux alkyle , mais de nombreuses molécules organiques peuvent présenter des réactions de dismutation plus complexes et à plusieurs étapes.
Mécanisme de disproportion radicale
Dans les réactions de dismutation radicale, une molécule agit comme un accepteur tandis que l'autre molécule agit comme un donneur. Dans les réactions de dismutation les plus courantes, un atome d'hydrogène est prélevé ou extrait par l'accepteur lorsque la molécule donneuse subit une réaction d'élimination pour former une double liaison . D'autres atomes tels que les halogènes peuvent également être soustraits lors d'une réaction de dismutation. L'abstraction se produit comme une réaction tête-à-queue avec l'atome en cours d'abstraction face à l'atome radical sur l'autre molécule.
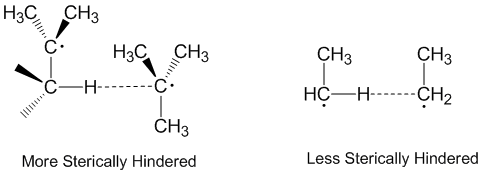
Disproportionnement et effets stériques
La disproportion radicale est souvent considérée comme se produisant de manière linéaire, le radical donneur, le radical accepteur et l'atome étant acceptés tout le long du même axe. En fait, la plupart des réactions de dismutation ne nécessitent pas d'orientations linéaires dans l'espace. Les molécules plus encombrées stériquement nécessitent des agencements plus linéaires, et réagissent donc plus lentement. Les effets stériques jouent un rôle important dans la dismutation avec les radicaux éthyle agissant comme des accepteurs plus efficaces que les radicaux tert-butyle . Les radicaux tert-butyle ont de nombreux hydrogènes sur les carbones adjacents à donner et les effets stériques empêchent souvent les radicaux tert-butyle de s'approcher de l'abstraction des hydrogènes.
Dismutation des radicaux alkyles
La dismutation des radicaux alkyles a été largement étudiée dans la littérature scientifique. Au cours de la dismutation des radicaux alkyles, un alcane et un alcène sont les produits finaux et l' ordre des liaisons des produits augmente de un par rapport aux réactifs. Ainsi, la réaction est exothermique (ΔH = 50 – 95 kcal/mol) et se déroule rapidement.
Dismutation croisée des radicaux alkyles
La dismutation croisée se produit lorsque deux radicaux alkyles différents se disproportionnent pour former deux nouveaux produits. Différents produits peuvent se former selon le radical alkyle qui joue le rôle de donneur et celui qui joue le rôle d'accepteur. L'efficacité des radicaux alkyles primaires et secondaires en tant que donneurs dépend des effets stériques et de la configuration des accepteurs de radicaux.
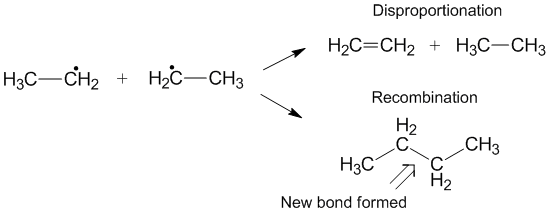
Compétition avec recombinaison
Une autre réaction qui peut parfois se produire au lieu de la dismutation est la recombinaison. Lors de la recombinaison, deux radicaux forment un nouveau produit non radical et une nouvelle liaison. Semblable à la dismutation, la réaction de recombinaison est exothermique et nécessite peu ou pas d'énergie d'activation. Le rapport des vitesses de dismutation sur recombinaison est appelé k D /k C et favorise souvent la recombinaison par rapport à la dismutation pour les radicaux alkyles. Au fur et à mesure que le nombre d'hydrogènes transférables augmente, la constante de vitesse pour la dismutation augmente par rapport à la constante de vitesse pour la recombinaison.
Effet isotopique cinétique sur la dismutation et la recombinaison
Lorsque les atomes d'hydrogène dans un radical alkyle sont déplacés avec du deutérium , la dismutation se déroule à une vitesse légèrement plus lente alors que la vitesse de recombinaison reste la même. Ainsi la dismutation est faiblement affectée par l' effet isotopique cinétique avec k H /k D = 1,20 ± 0,15 pour l'éthylène. Les hydrogènes et les deutérons ne sont pas impliqués dans les réactions de recombinaison. Cependant, l'abstraction de deutéron pendant la dismutation se produit plus lentement que l'abstraction d'hydrogène en raison de l'augmentation de la masse et de l'énergie vibratoire réduite du deutérium, bien que le k H /k D observé expérimentalement soit proche de un.
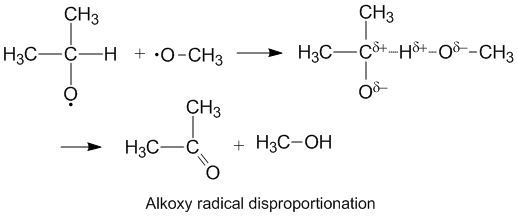
Effets polaires et dismutation des radicaux alcoxy
Les radicaux alcoxy qui contiennent des électrons non appariés sur un atome d'oxygène affichent un k D /k C plus élevé que les radicaux alkyle. L'oxygène a une charge négative partielle qui élimine la densité électronique de l'atome de carbone donneur, facilitant ainsi l'extraction d'hydrogène. Le taux de dismutation est également facilité par l' oxygène plus électronégatif sur la molécule acceptrice.
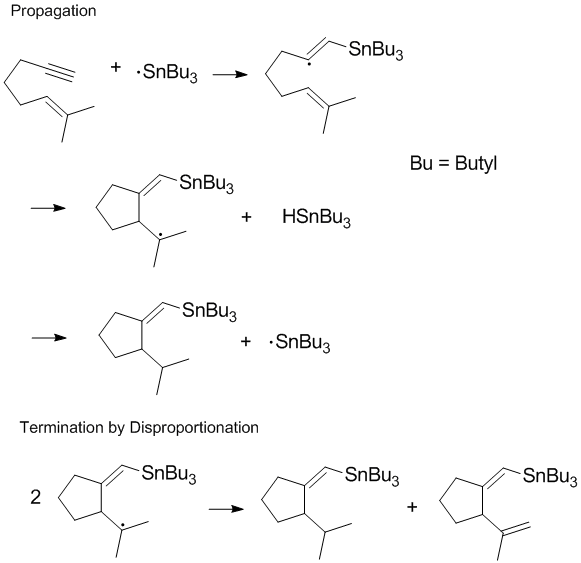
Terminaison des processus de la chaîne
De nombreux processus radicaux impliquent des réactions en chaîne ou une propagation en chaîne avec dismutation et recombinaison se produisant dans l'étape terminale de la réaction. La propagation de la chaîne de terminaison est souvent la plus importante pendant la polymérisation car la propagation de la chaîne souhaitée ne peut pas avoir lieu si des réactions de dismutation et de recombinaison se produisent facilement. Le contrôle des produits de terminaison et la régulation des réactions de dismutation et de recombinaison dans l'étape terminale sont des considérations importantes en chimie radicalaire et en polymérisation . Dans certaines réactions (comme celle illustrée ci-dessous), une ou les deux voies de terminaison peuvent être entravées par des effets stériques ou de solvant .
Réduction de la disproportion dans la polymérisation radicalaire vivante
De nombreux chimistes des polymères se préoccupent de limiter la vitesse de dismutation pendant la polymérisation. Bien que la dismutation entraîne la formation d'une nouvelle double liaison qui peut réagir avec la chaîne polymère, un hydrocarbure saturé est également formé, et ainsi la réaction en chaîne ne se déroule pas facilement. Au cours de la polymérisation radicalaire vivante , les voies de terminaison d'une chaîne polymère en croissance sont supprimées. Ceci peut être réalisé par plusieurs méthodes, dont l'une est la terminaison réversible avec des radicaux stables. Les radicaux nitroxyde et autres radicaux stables réduisent les taux de recombinaison et de dismutation et contrôlent la concentration des radicaux polymères.