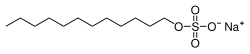
Dodécyl sulfate de sodium - Sodium dodecyl sulfate
|
|
|
|
| Noms | |
|---|---|
|
Nom IUPAC préféré
Dodécyl sulfate de sodium |
|
| Autres noms
monododécyl sulfate de sodium; Laurylsulfate de sodium; sulfate de monolauryle de sodium; dodécanesulfate de sodium; Coco-sulfate de sodium; alcool dodécylique, hydrogénosulfate, sel de sodium; n-dodécyl sulfate de sodium; Sel de sodium de l'ester monododécylique de l'acide sulfurique
|
|
| Identifiants | |
|
Modèle 3D ( JSmol )
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Banque de médicaments | |
| Carte d'information de l'ECHA |
100.005.263 |
| numéro E | E487 (épaississants, ...) |
|
CID PubChem
|
|
| UNII | |
|
Tableau de bord CompTox ( EPA )
|
|
|
|
|
|
| Propriétés | |
| C 12 H 25 NaSO 4 | |
| Masse molaire | 288.372 g/mol |
| Apparence | solide blanc ou crème |
| Odeur | inodore |
| Densité | 1,01 g / cm 3 |
| Point de fusion | 206 °C (403 °F; 479 K) |
| Tension superficielle: | |
| 8,2 mM à 25 °C | |
|
Indice de réfraction ( n D )
|
1.461 |
| Pharmacologie | |
| A06AG11 ( OMS ) | |
| Dangers | |
| Dose ou concentration létale (LD, LC) : | |
|
DL 50 ( dose médiane )
|
1288 mg/kg (rat, orale) |
| Composés apparentés | |
|
Autres anions
|
Sodium laureth sulfate Sodium myreth sulfate |
|
Autres cations
|
Laurylsulfate d'ammonium Laurylsulfate de potassium |
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Références de l'infobox | |
Le dodécylsulfate de sodium ( SDS ) ou le laurylsulfate de sodium ( SLS ), parfois écrit laurylsulfate de sodium , est un composé organique synthétique de formule C H 3 (CH 2 ) 11 SO 4 Na . C'est un tensioactif anionique utilisé dans de nombreux produits de nettoyage et d'hygiène. Cette molécule est un organosulfate et un sel. Il se compose d'une queue à 12 atomes de carbone attachée à un groupe sulfate , c'est-à-dire qu'il s'agit du sel de sodium de l' hydrogénosulfate de dodécyle, de l' ester de l' alcool dodécylique et de l'acide sulfurique . Sa queue hydrocarbonée associée à un « groupe de tête » polaire confère au composé des propriétés amphiphiles et le rend ainsi utile comme détergent . Également dérivé en tant que composant de mélanges produits à partir d' huiles de noix de coco et de palme bon marché , le SDS est un composant commun de nombreux produits de nettoyage domestique, d'hygiène personnelle et de produits cosmétiques, pharmaceutiques et alimentaires, ainsi que de produits de nettoyage et de formulations de produits industriels et commerciaux.
Structure et propriétés
Structure
Le SDS appartient à la famille des composés organosulfates et a pour formule C H 3 (CH 2 ) 11 SO 4 Na . Il se compose d'une queue à 12 carbones attachée à un groupe sulfate , c'est-à-dire qu'il s'agit du sel de sodium d'un alcool à 12 carbones qui a été estérifié en acide sulfurique. Une autre description est qu'il s'agit d'un groupe alkyle auquel est attaché un groupe sulfate terminal pendant . De par sa queue hydrocarbonée, et son « groupe de tête » anionique, il possède des propriétés amphiphiles qui lui permettent de former des micelles , et ainsi d'agir comme un détergent.
Propriétés physicochimiques

La concentration micellaire critique (CMC) dans l'eau pure à 25 °C est de 8,2 mM, et le nombre d'agrégation à cette concentration est généralement considéré comme étant d'environ 62. La fraction d'ionisation micellaire (α) est d'environ 0,3 (ou 30 %).
Production
Le SDS est synthétisé en traitant l' alcool laurylique avec du trioxyde de soufre gazeux, de l' oléum ou de l'acide chlorosulfurique pour produire du laurylsulfate d'hydrogène. Le produit résultant est ensuite neutralisé par addition d'hydroxyde de sodium ou de carbonate de sodium . L'alcool laurylique peut être utilisé sous forme pure ou peut être dérivé de l'huile de noix de coco ou de palmiste par hydrolyse (qui libère leurs acides gras), suivie d'une hydrogénation . Lorsqu'ils sont produits à partir de ces sources, les échantillons commerciaux de ces produits "SDS" ne sont en réalité pas du SDS pur, mais plutôt un mélange de divers sulfates d'alkyle de sodium, le SDS étant le composant principal. Par exemple, le SDS est un composant, avec d'autres amphiphiles de longueur de chaîne , lorsqu'il est produit à partir d'huile de noix de coco, et est connu sous le nom de sodium coco sulfate (SCS). Le SDS est disponible dans le commerce sous forme de poudre, de pastilles et d'autres formes (chacune ayant des vitesses de dissolution différentes), ainsi qu'en solutions aqueuses de concentrations variables.
Applications
Nettoyage et hygiène
Le SDS est principalement utilisé dans les détergents pour le linge avec de nombreuses applications de nettoyage. C'est un tensioactif très efficace et est utilisé dans toute tâche nécessitant l'élimination des taches et des résidus huileux. Par exemple, on le trouve en concentrations plus élevées dans les produits industriels, notamment les dégraissants pour moteurs, les nettoyants pour sols et les nettoyants extérieurs pour voitures.
À des concentrations plus faibles, on le trouve dans les savons pour les mains, les dentifrices, les shampooings, les crèmes à raser et les formulations de bains moussants , pour sa capacité à créer une mousse (mousse), pour ses propriétés tensioactives et en partie pour son effet épaississant.
Additif alimentaire
Le dodécyl sulfate de sodium, apparaissant comme son synonyme le lauryl sulfate de sodium (SLS), est considéré comme un ingrédient généralement reconnu comme sûr (GRAS) pour une utilisation alimentaire selon l' USFDA (21 CFR 172.822). Il est utilisé comme agent émulsifiant et aide au fouettage. En tant qu'émulsifiant dans ou avec les blancs d'œufs, le Code of Federal Regulations des États-Unis exige qu'il ne dépasse pas 1 000 parties par million (0,1 %) dans les blancs d'œufs solides ou 125 parties par million (0,0125%) dans les blancs d'œufs congelés ou liquides et comme agent à fouetter pour la préparation de guimauves il ne doit pas dépasser 0,5% du poids de gélatine. On rapporte que le SLS diminue temporairement la perception de la douceur.
Applications en laboratoire
Principales applications
Le laurylsulfate de sodium, appelé en science dodécyl sulfate de sodium (SDS), est utilisé dans les procédures de nettoyage et est couramment utilisé comme composant pour la lyse des cellules lors de l'extraction d'ARN et/ou d' ADN , et pour dénaturer les protéines en vue de l' électrophorèse dans la technique SDS-PAGE .
Dans le cas de la SDS-PAGE, le composé agit en perturbant les liaisons non covalentes dans les protéines, et ainsi en les dénaturant, c'est-à-dire en faisant perdre aux molécules protéiques leurs conformations et formes natives. En se liant aux protéines à raison d'une molécule SDS pour 2 résidus d'acides aminés, le détergent chargé négativement fournit à toutes les protéines une charge négative nette similaire et donc un rapport charge/masse similaire. De cette manière, la différence de mobilité des chaînes polypeptidiques dans le gel peut être attribuée uniquement à leur longueur par opposition à leur charge native et à leur forme. Il est possible de faire une séparation basée sur la taille de la chaîne polypeptidique pour simplifier l'analyse des molécules de protéines, ceci peut être réalisé en dénaturant les protéines avec le détergent SDS. L'association de molécules SDS avec des molécules protéiques confère une charge négative associée à l'agrégat moléculaire formé ; cette charge négative est significativement supérieure à la charge d'origine de cette protéine. La répulsion électrostatique créée par la liaison au SDS force les protéines à prendre une forme de bâtonnet, éliminant ainsi les différences de forme en tant que facteur de séparation électrophorétique dans les gels. Une molécule de sulfate de dodécyl a deux charges négatives à la valeur de pH utilisée pour l'électrophorèse, cela conduira la charge nette des chaînes polypeptidiques enrobées à être beaucoup plus négative que les chaînes non enrobées. Le rapport charge/masse est essentiellement identique pour différentes protéines car le revêtement SDS domine la charge.
Applications pharmaceutiques
Le laurylsulfate de sodium est largement utilisé dans le domaine pharmaceutique en tant que solubilisant et émulsifiant ionique qui convient aux applications dans les dispersions liquides, les solutions, les émulsions et les microémulsions, les comprimés, les mousses et les semi-solides tels que les crèmes, les lotions et les gels. De plus, le SLS contribue à la mouillabilité des comprimés, ainsi qu'à la lubrification pendant la fabrication. Les noms de marque de SLS de qualité pharmaceutique incluent Kolliphor SLS et Kolliphor SLS Fine.
Applications diverses
SLS est utilisé dans une technique améliorée pour préparer les tissus cérébraux pour l'étude par microscopie optique. La technique, qui a été baptisée CLARITY, a été l'œuvre de Karl Deisseroth et de ses collègues de l'Université de Stanford , et implique l'infusion de l'organe avec une solution d' acrylamide pour lier les macromolécules de l'organe ( protéines , acides nucléiques , etc.), suivie par polymérisation thermique pour former un «hydrogel cerveau» (un maillage dispersé dans tout le tissu pour fixer les macromolécules et autres structures dans l'espace), puis par élimination des lipides à l'aide du SDS pour éliminer la diffusion de la lumière avec une perte de protéines minimale, rendant le tissu quasi- transparent.
Avec le dodécylbenzène sulfonate de sodium et le Triton X-100 , les solutions aqueuses de SDS sont populaires pour disperser ou suspendre les nanotubes, tels que les nanotubes de carbone .
Utilisations de niche
Le SLS a été proposé comme microbicide topique potentiellement efficace, à usage intravaginal, pour inhiber et éventuellement prévenir l'infection par divers virus enveloppés et non enveloppés tels que les virus de l' herpès simplex , le VIH et le virus de la forêt de Semliki .
Dans les expériences de formation d' hydrate de gaz , le SDS est utilisé comme promoteur de croissance d'hydrate de gaz. Les chercheurs visent les promotions des hydrates de gaz en tant que mise à l'échelle des applications industrielles des hydrates de gaz telles que le processus de dessalement , le stockage du gaz et les technologies de séparation des gaz.
Il a été démontré que les membranes liquides formées à partir de SDS dans l'eau fonctionnent comme des séparateurs de particules inhabituels. L'appareil agit comme un filtre inversé, permettant aux grosses particules de passer tout en capturant les petites particules.
Toxicologie
Cancérogénicité
Le SDS n'est pas cancérigène lorsqu'il est consommé ou appliqué directement, même à des quantités et des concentrations qui dépassent les quantités utilisées dans les produits commerciaux standard. L'examen antérieur du groupe d'experts du programme Cosmetic Ingredient Review (CIR) en 1983 a signalé que le SDS (ici, en abrégé SLS, pour le laurylsulfate de sodium) à des concentrations allant jusqu'à 2 %, dans une étude diététique orale d'un an chez le chien, n'a donné aucun résultat. preuve de tumorigénicité ou de cancérogénicité, et qu'aucun excès d'aberrations chromosomiques ou d'effets clastogènes n'a été observé chez les rats nourris jusqu'à 1,13 % de laurylsulfate de sodium dans leur régime pendant 90 jours, par rapport à ceux recevant un régime témoin. L'examen de 2005 par le même groupe a indiqué que d'autres données disponibles manquaient de toute suggestion disponible que le SDS ou le sel d'ammonium apparenté du même amphiphile pourrait être cancérigène, déclarant que « Malgré les affirmations contraires sur Internet, la cancérogénicité de ces ingrédients n'est que une rumeur;" les deux études concluent que le SDS semble "être sans danger dans les formulations conçues pour une utilisation brève et discontinue suivie d'un rinçage abondant de la surface de la peau. Dans les produits destinés à un contact prolongé avec la peau, les concentrations ne doivent pas dépasser 1%".
Sensibilité
Comme tous les détergents , le laurylsulfate de sodium élimine les huiles de la peau et peut provoquer une irritation de la peau et des yeux. Il a été démontré qu'il irrite la peau du visage, en cas d'exposition prolongée et constante (plus d'une heure) chez les jeunes adultes. Le SDS peut aggraver les problèmes de peau chez les personnes souffrant d'hypersensibilité cutanée chronique , certaines personnes étant plus touchées que d'autres.
Préoccupations orales
Le faible coût du SDS, son absence d'impact sur le goût, son impact potentiel sur les composés soufrés volatils (CSV), qui contribuent à l'haleine malodorante, et son action souhaitable en tant qu'agent moussant ont conduit à l'utilisation du SDS dans les formulations de dentifrices. . Une série de petites études croisées (25 à 34 patients) ont soutenu l'efficacité du SLS dans la réduction des CSV et son impact positif sur la mauvaise haleine, bien que ces études aient généralement été notées pour refléter les défis techniques dans le contrôle de la conception de l'étude. variables. Alors que les sources primaires du groupe d'Irma Rantanen à l'Université de Turku, en Finlande, concluent à un impact sur la sécheresse buccale ( xérostomie ) des pâtes contenant du SLS, une revue Cochrane 2011 de ces études, et du domaine plus général, conclut qu'il « existe aucune preuve solide... qu'un traitement topique est efficace pour soulager le symptôme de la bouche sèche." Un problème de sécurité a été soulevé sur la base de plusieurs études concernant l'effet du dentifrice SDS sur les ulcères aphteux , communément appelés aphtes ou aphtes. Un consensus concernant la pratique (ou le changement de pratique) n'est pas apparu à la suite des études. Comme le note Lippert, en 2013, « très peu de dentifrices commercialisés contiennent un tensioactif autre que le SLS [SDS] », et les principaux fabricants continuent de formuler leurs produits avec le SDS.
Interaction avec le fluorure
Certaines études ont suggéré que le SLS dans le dentifrice peut diminuer l'efficacité du fluorure dans la prévention des caries dentaires (caries). Cela peut être dû à l'interaction du SLS avec le dépôt de fluorure sur l'émail des dents .

