Tryptophane - Tryptophan

Formule squelettique du L- tryptophane
|
|||
|
|
|||
| Noms | |||
|---|---|---|---|
|
Nom IUPAC
Tryptophane ou acide (2 S )-2-amino-3-(1 H -indol-3-yl)propanoïque
|
|||
| Autres noms
Acide 2-amino-3-(1 H -indol-3-yl)propanoïque
|
|||
| Identifiants | |||
|
Modèle 3D ( JSmol )
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Banque de médicaments | |||
| Carte d'information de l'ECHA |
100.000.723 |
||
| KEGG | |||
|
CID PubChem
|
|||
| UNII | |||
|
Tableau de bord CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriétés | |||
| C 11 H 12 N 2 O 2 | |||
| Masse molaire | 204,229 g·mol -1 | ||
| Soluble : 0,23 g/L à 0 °C, 11,4 g/L à 25 °C, |
|||
| Solubilité | Soluble dans l'alcool chaud, les hydroxydes alcalins; insoluble dans le chloroforme . | ||
| Acidité (p K a ) | 2,38 (carboxyle), 9,39 (amino) | ||
| -132,0·10 -6 cm 3 /mol | |||
| Pharmacologie | |||
| N06AX02 ( OMS ) | |||
| Page de données supplémentaires | |||
|
Indice de réfraction ( n ), Constante diélectrique (ε r ), etc. |
|||
|
Données thermodynamiques |
Comportement des phases solide-liquide-gaz |
||
| UV , IR , RMN , MS | |||
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa). |
|||
|
|
|||
| Références de l'infobox | |||
Le tryptophane (symbole Trp ou W ) est un acide -aminé utilisé dans la biosynthèse des protéines . Le tryptophane contient un groupe -amino, un groupe acide -carboxylique et une chaîne latérale indole , ce qui en fait un acide aminé aromatique non polaire . Il est essentiel chez l'homme, c'est-à-dire que l'organisme ne peut pas le synthétiser et qu'il doit être obtenu par l'alimentation. Le tryptophane est également un précurseur du neurotransmetteur sérotonine , de l' hormone mélatonine et de la vitamine B3 . Il est codé par le codon UGG.
Comme les autres acides aminés, le tryptophane est un zwitterion à pH physiologique où le groupe aminé est protoné (– NH+
3; pK a = 9,39) et l'acide carboxylique est déprotoné ( -COO - ; pK a = 2,38).
Fonction
Les acides aminés, y compris le tryptophane, sont utilisés comme éléments constitutifs de la biosynthèse des protéines , et les protéines sont nécessaires au maintien de la vie. De nombreux animaux (dont l'homme) ne peuvent synthétiser le tryptophane : ils doivent l'obtenir par leur alimentation, ce qui en fait un acide aminé essentiel . Le tryptophane fait partie des acides aminés les moins courants trouvés dans les protéines, mais il joue des rôles structurels ou fonctionnels importants chaque fois qu'il se produit. Par exemple, les résidus tryptophane et tyrosine jouent un rôle particulier dans "l'ancrage" des protéines membranaires au sein de la membrane cellulaire . Le tryptophane, avec d'autres acides aminés aromatiques , est également important dans les interactions glycane-protéine . De plus, le tryptophane fonctionne comme un précurseur biochimique des composés suivants :
- La sérotonine (un neurotransmetteur ), synthétisée par la tryptophane hydroxylase .
- La mélatonine (une neurohormone ) est à son tour synthétisée à partir de la sérotonine, via les enzymes N-acétyltransférase et 5-hydroxyindole-O-méthyltransférase .
- La kynurénine , en laquelle le tryptophane est principalement (plus de 95 %) métabolisé. Deux enzymes, à savoir l'indoléamine 2,3-dioxygénase (IDO) dans le système immunitaire et le cerveau, et la tryptophane dioxygénase (TDO) dans le foie, sont responsables de la synthèse de la kynurénine à partir du tryptophane. La voie kynurénine du catabolisme du tryptophane est altérée dans plusieurs maladies, y compris les troubles psychiatriques tels que la schizophrénie, le trouble dépressif majeur et le trouble bipolaire.
- La niacine , aussi connu comme la vitamine B 3 , est synthétisée à partir du tryptophane via kynurénine et des acides quinolinique .
- Les auxines (une classe de phytohormones ) sont synthétisées à partir du tryptophane.
Le trouble de la malabsorption du fructose provoque une mauvaise absorption du tryptophane dans l'intestin, une réduction des taux de tryptophane dans le sang et une dépression.
Dans les bactéries qui synthétisent le tryptophane, des niveaux cellulaires élevés de cet acide aminé activent une protéine répresseur , qui se lie à l' opéron trp . La liaison de ce répresseur à l'opéron tryptophane empêche la transcription de l'ADN en aval qui code pour les enzymes impliquées dans la biosynthèse du tryptophane. Ainsi, des niveaux élevés de tryptophane empêchent la synthèse du tryptophane par une boucle de rétroaction négative , et lorsque les niveaux de tryptophane de la cellule diminuent à nouveau, la transcription de l'opéron trp reprend. Cela permet des réponses étroitement régulées et rapides aux changements dans les niveaux de tryptophane interne et externe de la cellule.
|
Métabolisme du tryptophane par le microbiote gastro-intestinal humain (
)
|
Apport alimentaire recommandé
En 2002, l'Institute of Medicine des États-Unis a fixé un apport nutritionnel recommandé (RDA) de 5 mg/kg de poids corporel/jour de tryptophane pour les adultes de 19 ans et plus.
Sources alimentaires
Le tryptophane est présent dans la plupart des aliments à base de protéines ou de protéines alimentaires. Il est particulièrement abondant dans le chocolat , l' avoine , les dattes séchées , le lait , le yaourt , le fromage blanc , la viande rouge , les œufs , le poisson , la volaille , le sésame , les pois chiches , les amandes , les graines de tournesol , les graines de citrouille , le sarrasin , la spiruline et les arachides . Contrairement à la croyance populaire selon laquelle la dinde cuite contient une abondance de tryptophane, la teneur en tryptophane de la dinde est typique de la volaille.
| Nourriture | Tryptophane [g/100 g de nourriture] |
Protéines [g/100 g de nourriture] |
Tryptophane/protéine [%] |
|---|---|---|---|
| Blanc d'oeuf séché | 1,00 | 81.10 | 1.23 |
| Spiruline séchée | 0,92 | 57,47 | 1,62 |
| Cabillaud de l'Atlantique séché | 0,70 | 62,82 | 1.11 |
| Soja , cru | 0,59 | 36,49 | 1,62 |
| Fromage, Parmesan | 0,56 | 37,90 | 1,47 |
| graines de chia séchées | 0,436 | 16,5 | 2,64 |
| graine de sésame | 0,37 | 17h00 | 2.17 |
| Fromage, Cheddar | 0,32 | 24,90 | 1,29 |
| Graines de tournesol | 0,30 | 17.20 | 1,74 |
| Côtelette de porc | 0,25 | 19.27 | 1,27 |
| Turquie | 0,24 | 21.89 | 1.11 |
| Poulet | 0,24 | 20.85 | 1.14 |
| Du bœuf | 0,23 | 20.13 | 1.12 |
| Avoine | 0,23 | 16,89 | 1,39 |
| Saumon | 0,22 | 19,84 | 1.12 |
| Côtelette d'agneau | 0,21 | 18.33 | 1.17 |
| Perche, Atlantique | 0,21 | 18,62 | 1.12 |
| Pois chiches , crus | 0,19 | 19h30 | 0,96 |
| Œuf | 0,17 | 12.58 | 1.33 |
| Farine de blé, blanche | 0,13 | 10.33 | 1.23 |
| Chocolat à cuire , non sucré | 0,13 | 12.9 | 1.23 |
| Du lait | 0,08 | 3.22 | 2.34 |
| Riz, blanc, grain moyen, cuit | 0,028 | 2,38 | 1.18 |
| Quinoa , non cuit | 0,167 | 14.12 | 1.2 |
| Quinoa, cuit | 0,052 | 4.40 | 1.1 |
| Pommes de terre, rousse | 0,02 | 2.14 | 0,84 |
| Tamarin | 0,018 | 2,80 | 0,64 |
| Banane | 0,01 | 1.03 | 0,87 |
Utiliser comme antidépresseur
Étant donné que le tryptophane est converti en 5-hydroxytryptophane (5-HTP) qui est ensuite converti en neurotransmetteur sérotonine, il a été proposé que la consommation de tryptophane ou de 5-HTP puisse améliorer les symptômes de la dépression en augmentant le niveau de sérotonine dans le cerveau. Le tryptophane est vendu sur le comptoir aux États-Unis (après avoir été interdit à des degrés divers entre 1989 et 2005 ) et le Royaume-Uni en tant que complément alimentaire pour être utilisé comme antidépresseur , anxiolytique et aide au sommeil . Il est également commercialisé comme médicament d'ordonnance dans certains pays européens pour le traitement de la dépression majeure . Il existe des preuves qu'il est peu probable que les niveaux de tryptophane dans le sang soient modifiés en changeant le régime alimentaire, mais la consommation de tryptophane purifié augmente le niveau de sérotonine dans le cerveau, contrairement à la consommation d'aliments contenant du tryptophane. En effet, le système de transport qui amène le tryptophane à travers la barrière hémato-encéphalique transporte également d'autres acides aminés contenus dans les sources alimentaires de protéines . Des taux plasmatiques élevés d'autres gros acides aminés neutres empêchent la concentration plasmatique de tryptophane d'augmenter les taux de concentration cérébrale.
En 2001, une revue Cochrane de l'effet du 5-HTP et du tryptophane sur la dépression a été publiée. Les auteurs n'ont inclus que des études d'une grande rigueur et ont inclus à la fois le 5-HTP et le tryptophane dans leur revue en raison des données limitées sur l'un ou l'autre. Sur 108 études sur le 5-HTP et le tryptophane sur la dépression publiées entre 1966 et 2000, seules deux répondaient aux normes de qualité des auteurs pour l'inclusion, totalisant 64 participants à l'étude. Les substances étaient plus efficaces que le placebo dans les deux études incluses mais les auteurs déclarent que "les preuves étaient de qualité insuffisante pour être concluantes" et notent que "parce qu'il existe des antidépresseurs alternatifs qui se sont avérés efficaces et sûrs, l'utilité clinique de Le 5-HTP et le tryptophane sont actuellement limités". L'utilisation du tryptophane comme traitement d'appoint en plus du traitement standard des troubles de l'humeur et de l'anxiété n'est pas étayée par les preuves scientifiques.
Effets secondaires
Les effets secondaires potentiels de la supplémentation en tryptophane incluent nausées , diarrhée , somnolence , étourdissements , maux de tête , bouche sèche , vision trouble , sédation , euphorie et nystagmus (mouvements oculaires involontaires).
Interactions
Le tryptophane pris comme complément alimentaire (comme sous forme de comprimés) a le potentiel de provoquer un syndrome sérotoninergique lorsqu'il est combiné avec des antidépresseurs de la classe IMAO ou ISRS ou d'autres médicaments fortement sérotoninergiques. Parce que la supplémentation en tryptophane n'a pas été étudiée en profondeur dans un cadre clinique, ses interactions avec d'autres médicaments ne sont pas bien connues.
Isolation
L'isolement du tryptophane a été signalé pour la première fois par Frederick Hopkins en 1901. Hopkins a récupéré du tryptophane à partir de caséine hydrolysée , en récupérant 4 à 8 g de tryptophane à partir de 600 g de caséine brute.
Biosynthèse et production industrielle
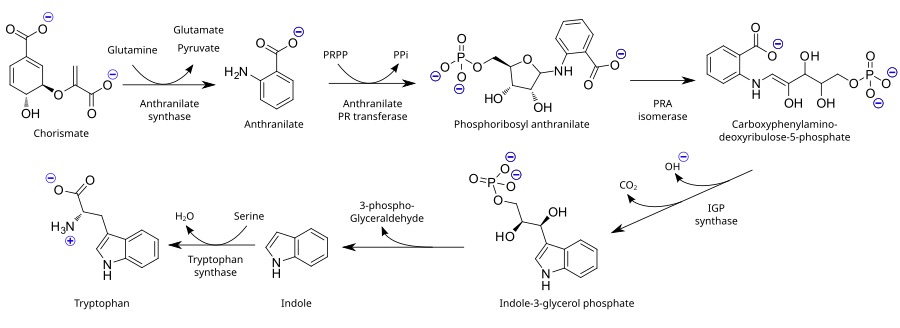
En tant qu'acide aminé essentiel, le tryptophane n'est pas synthétisé à partir de substances plus simples chez l'homme et d'autres animaux, il doit donc être présent dans l'alimentation sous forme de protéines contenant du tryptophane. Les plantes et les micro - organismes synthétisent couramment le tryptophane à partir d' acide shikimique ou d' anthranilate : l'anthranilate se condense avec le phosphoribosylpyrophosphate (PRPP), générant du pyrophosphate comme sous-produit. Le cycle de la fraction ribose est ouvert et soumis à une décarboxylation réductrice , produisant du phosphate d'indole-3-glycérol ; celui-ci, à son tour, se transforme en indole . Dans la dernière étape, la tryptophane synthase catalyse la formation de tryptophane à partir de l'indole et de l'acide aminé sérine .
La production industrielle de tryptophane est également biosynthétique et repose sur la fermentation de sérine et d' indole à l' aide de bactéries de type sauvage ou génétiquement modifiées telles que B. amyloliquefaciens , B. subtilis , C. glutamicum ou E. coli . Ces souches portent des mutations qui empêchent la recapture des acides aminés aromatiques ou des opérons trp multiples/surexprimés . La conversion est catalysée par l'enzyme tryptophane synthase .
Société et culture
Syndrome d'éosinophilie-myalgie
Il y a eu une grande épidémie de syndrome d' éosinophilie-myalgie (EMS) aux États-Unis en 1989, avec plus de 1 500 cas signalés au CDC et au moins 37 décès. Après qu'une enquête préliminaire ait révélé que l'épidémie était liée à la consommation de tryptophane, la Food and Drug Administration (FDA) des États-Unis a rappelé les suppléments de tryptophane en 1989 et interdit la plupart des ventes publiques en 1990, avec d'autres pays emboîtant le pas.
Des études ultérieures ont suggéré que l'EMS était lié à des lots spécifiques de L-tryptophane fournis par un seul grand fabricant japonais, Showa Denko . Il est finalement devenu évident que des lots récents de L-tryptophane de Showa Denko étaient contaminés par des traces d'impuretés, qui ont par la suite été considérées comme responsables de l'épidémie d'EMS de 1989. Cependant, d'autres preuves suggèrent que le tryptophane lui-même peut être un facteur contributif potentiellement majeur dans l'EMS.
La FDA a assoupli ses restrictions sur les ventes et la commercialisation du tryptophane en février 2001, mais a continué à limiter l'importation de tryptophane non destiné à un usage exempté jusqu'en 2005.
Le fait que l'installation de Showa Denko ait utilisé des bactéries génétiquement modifiées pour produire les lots contaminés de L-tryptophane dont on a découvert plus tard qu'ils avaient provoqué l'épidémie du syndrome d'éosinophilie-myalgie a été cité comme preuve de la nécessité d'une « surveillance étroite de la pureté chimique de la biotechnologie -produits dérivés". Ceux qui réclament un contrôle de la pureté ont, à leur tour, été critiqués en tant qu'activistes anti- OGM qui négligent les causes possibles de contamination non-OGM et menacent le développement de la biotechnologie.
Viande de dinde et somnolence
Une affirmation courante aux États-Unis est qu'une forte consommation de viande de dinde entraîne une somnolence , en raison des niveaux élevés de tryptophane contenus dans la dinde. Cependant, la quantité de tryptophane dans la dinde est comparable à celle contenue dans d'autres viandes. La somnolence après avoir mangé peut être causée par d'autres aliments consommés avec la dinde, en particulier les glucides . L'ingestion d'un repas riche en glucides déclenche la libération d' insuline . L'insuline stimule à son tour l'absorption de gros acides aminés neutres à chaîne ramifiée (BCAA), mais pas de tryptophane, dans le muscle, augmentant le rapport tryptophane/BCAA dans la circulation sanguine. L'augmentation du rapport tryptophane qui en résulte réduit la compétition au niveau du grand transporteur d'acides aminés neutres (qui transporte à la fois les BCAA et les acides aminés aromatiques), entraînant une plus grande absorption de tryptophane à travers la barrière hémato-encéphalique dans le liquide céphalo-rachidien (LCR). Une fois dans le LCR, le tryptophane est converti en sérotonine dans les noyaux du raphé par la voie enzymatique normale. La sérotonine résultante est ensuite métabolisée en mélatonine par la glande pinéale . Par conséquent, ces données suggèrent que la « somnolence induite par les festins » – ou somnolence postprandiale – peut être le résultat d'un repas copieux riche en glucides, ce qui augmente indirectement la production de mélatonine dans le cerveau et favorise ainsi le sommeil.
Recherche
En 1912, Felix Ehrlich démontra que la levure métabolise les acides aminés naturels essentiellement en séparant le dioxyde de carbone et en remplaçant le groupe amino par un groupe hydroxyle . Par cette réaction , le tryptophane donne naissance au tryptophol .
Le tryptophane affecte la synthèse de la sérotonine cérébrale lorsqu'il est administré par voie orale sous une forme purifiée et est utilisé pour modifier les niveaux de sérotonine pour la recherche. Un faible niveau de sérotonine dans le cerveau est induit par l'administration de protéines pauvres en tryptophane dans une technique appelée déplétion aiguë en tryptophane . Des études utilisant cette méthode ont évalué l'effet de la sérotonine sur l'humeur et le comportement social, concluant que la sérotonine réduit l'agressivité et augmente l'agréabilité.
Fluorescence
Le tryptophane est une importante sonde fluorescente intrinsèque (acide aminé), qui peut être utilisée pour estimer la nature du microenvironnement autour du résidu tryptophane. La plupart des émissions de fluorescence intrinsèques d'une protéine repliée sont dues à l'excitation de résidus tryptophane.
Voir également
- 5-hydroxytryptophane (5-HTP)
- Réaction d'Acree-Rosenheim
- Réaction d'Adamkiewicz
- Atténuateur (génétique)
- N , N -Diméthyltryptamine
- Réaction de Hopkins-Cole
- Sérotonine
- Tryptamine
Les références
Lectures complémentaires
- Wood RM, Rilling JK, Sanfey AG, Bhagwagar Z, Rogers RD (mai 2006). « Effets de l'épuisement du tryptophane sur la performance d'un jeu itéré du dilemme du prisonnier chez des adultes en bonne santé » . Neuropsychopharmacologie . 31 (5) : 1075-1084. doi : 10.1038/sj.npp.1300932 . PMID 16407905 .
Liens externes
- " CHEMIN KEGG : Métabolisme du tryptophane - Homo sapiens " . KEGG : Encyclopédie de Kyoto des gènes et des génomes. 23 août 2006 . Récupéré le 20 avril 2008 .
- GP Moss. " Catabolisme du tryptophane (stades précoces) " . Comité de nomenclature de l'Union internationale de biochimie et de biologie moléculaire (NC-IUBMB). Archivé de l' original le 13 septembre 2003 . Récupéré le 20 avril 2008 .
- GP Moss. " Catabolisme du tryptophane (stades ultérieurs) " . Comité de nomenclature de l'Union internationale de biochimie et de biologie moléculaire (NC-IUBMB). Archivé de l' original le 13 septembre 2003 . Récupéré le 20 avril 2008 .
- B. Mikkelson ; DP Mikkelson (22 novembre 2007). "La Turquie provoque la somnolence" . Pages de référence des légendes urbaines . Snopes.com . Récupéré le 20 avril 2008 .