Uranium -Uranium
 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Uranium | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Prononciation |
/ j ʊ ˈ r eɪ n je ə m / ( yuu- RAY -nee-əm ) |
|||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | gris argenté métallisé; se corrode en une couche d'oxyde noir écaillé dans l' air | |||||||||||||||||||||||||||||||||||||||||||||||||
| Masse atomique standard A r, std (U) | 238.028 91 (3) | |||||||||||||||||||||||||||||||||||||||||||||||||
| L'uranium dans le tableau périodique | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro atomique ( Z ) | 92 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Grouper | groupe n/a | |||||||||||||||||||||||||||||||||||||||||||||||||
| Point final | période 7 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Bloquer | bloc f | |||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Rn ] 5f 3 6d 1 7s 2 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Électrons par coquille | 2, 8, 18, 32, 21, 9, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase à STP | solide | |||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 1405,3 K (1132,2 °C, 2070 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 4404 K (4131 °C, 7468 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (près de rt ) | 19,1 g/ cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||
| lorsqu'il est liquide (à mp ) | 17,3 g/cm 3 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Température de fusion | 9,14 kJ/mole | |||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 417,1 kJ/mole | |||||||||||||||||||||||||||||||||||||||||||||||||
| Capacité calorifique molaire | 27,665 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||
La pression de vapeur
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | ||||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | +1, +2, +3, +4 , +5, +6 (un oxyde amphotère ) | |||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | Échelle de Paul : 1,38 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Énergies d'ionisation | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | empirique : 156 h | |||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalent | 196±19h | |||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 186h | |||||||||||||||||||||||||||||||||||||||||||||||||
| Raies spectrales de l'uranium | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Autres propriétés | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Occurrence naturelle | primordial | |||||||||||||||||||||||||||||||||||||||||||||||||
| Structure en cristal | orthorhombique | |||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son tige mince | 3155 m/s (à 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | 13,9 µm/(m⋅K) (à 25 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 27,5 W/(m⋅K) | |||||||||||||||||||||||||||||||||||||||||||||||||
| Résistivité électrique | 0,280 µΩ⋅m (à 0 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||
| Commande magnétique | paramagnétique | |||||||||||||||||||||||||||||||||||||||||||||||||
| Module d'Young | 208 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 111 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||
| Module de masse | 100 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,23 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Vickers | 1960–2500 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Brinell | 2350–3850 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||
| Numero CAS | 7440-61-1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Appellation | d'après la planète Uranus , elle-même nommée d'après le dieu grec du ciel Uranus | |||||||||||||||||||||||||||||||||||||||||||||||||
| Découverte | Martin Henri Klaproth (1789) | |||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | Eugène-Melchior Péligot (1841) | |||||||||||||||||||||||||||||||||||||||||||||||||
| Principaux isotopes de l'uranium | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
L'uranium est un élément chimique avec le symbole U et le numéro atomique 92. C'est un métal gris argenté de la série des actinides du tableau périodique . Un atome d'uranium possède 92 protons et 92 électrons , dont 6 sont des électrons de valence . L'uranium est faiblement radioactif car tous les isotopes de l'uranium sont instables ; les demi-vies de ses isotopes naturels varient entre 159 200 ans et 4,5 milliards d'années. Les isotopes les plus courants de l'uranium naturel sont l'uranium 238 (qui possède 146 neutrons et représente plus de 99 % de l'uranium sur Terre) et l'uranium 235 (qui possède 143 neutrons). L'uranium a le poids atomique le plus élevé des éléments primordiaux . Sa densité est environ 70 % supérieure à celle du plomb , et légèrement inférieure à celle de l'or ou du tungstène . Il se produit naturellement à de faibles concentrations de quelques parties par million dans le sol, la roche et l'eau, et est commercialement extrait de minéraux uranifères tels que l' uraninite .
Dans la nature, l'uranium se trouve sous forme d'uranium-238 (99,2739–99,2752%), d'uranium-235 (0,7198–0,7202%) et d'une très petite quantité d' uranium-234 (0,0050–0,0059%). L'uranium se désintègre lentement en émettant une particule alpha . La demi-vie de l'uranium-238 est d'environ 4,47 milliards d'années et celle de l'uranium-235 est de 704 millions d' années, ce qui les rend utiles pour dater l' âge de la Terre .
De nombreuses utilisations contemporaines de l'uranium exploitent ses propriétés nucléaires uniques . L'uranium-235 est le seul isotope fissile naturel , ce qui le rend largement utilisé dans les centrales nucléaires et les armes nucléaires . Cependant, en raison des quantités infimes trouvées dans la nature, l'uranium doit subir un enrichissement afin que suffisamment d'uranium 235 soit présent. L'uranium-238 est fissile par les neutrons rapides et est fertile , ce qui signifie qu'il peut être transmuté en plutonium-239 fissile dans un réacteur nucléaire . Un autre isotope fissile, l'uranium-233 , peut être produit à partir du thorium naturel et est étudié pour une utilisation industrielle future dans la technologie nucléaire. L'uranium 238 a une faible probabilité de fission spontanée ou même de fission induite avec des neutrons rapides ; l'uranium-235 et dans une moindre mesure l'uranium-233 ont une section efficace de fission beaucoup plus élevée pour les neutrons lents. En concentration suffisante, ces isotopes maintiennent une réaction nucléaire en chaîne soutenue . Cela génère de la chaleur dans les réacteurs nucléaires et produit la matière fissile pour les armes nucléaires. L'uranium appauvri ( 238 U) est utilisé dans les pénétrateurs à énergie cinétique et les blindages . L'uranium est utilisé comme colorant dans le verre d'uranium , produisant des couleurs jaune citron à vert. Le verre d'uranium émet une fluorescence verte dans la lumière ultraviolette. Il a également été utilisé pour teinter et ombrager au début de la photographie .
La découverte en 1789 d'uranium dans la pechblende minérale est attribuée à Martin Heinrich Klaproth , qui a nommé le nouvel élément d'après la planète Uranus récemment découverte . Eugène-Melchior Péligot fut le premier à isoler le métal et ses propriétés radioactives furent découvertes en 1896 par Henri Becquerel . Les recherches d' Otto Hahn , Lise Meitner , Enrico Fermi et d'autres, tels que J. Robert Oppenheimer à partir de 1934, ont conduit à son utilisation comme combustible dans l' industrie de l'énergie nucléaire et dans Little Boy , la première arme nucléaire utilisée en temps de guerre . Une course aux armements qui a suivi pendant la guerre froide entre les États-Unis et l' Union soviétique a produit des dizaines de milliers d'armes nucléaires qui utilisaient de l'uranium métal et du plutonium-239 dérivé de l'uranium . La sécurité de ces armes est étroitement surveillée. Depuis environ 2000, le plutonium obtenu par le démantèlement des bombes de la guerre froide est utilisé comme combustible pour les réacteurs nucléaires. Le développement et le déploiement de ces réacteurs nucléaires se poursuivent à l'échelle mondiale car ils constituent de puissantes sources d' énergie sans CO 2 .
Les caractéristiques
Une fois raffiné , l'uranium est un métal blanc argenté, faiblement radioactif . Il a une dureté Mohs de 6, suffisante pour rayer le verre et approximativement égale à celle du titane , du rhodium , du manganèse et du niobium . Il est malléable , ductile , légèrement paramagnétique , fortement électropositif et mauvais conducteur électrique . L'uranium métal a une densité très élevée de 19,1 g/cm 3 , plus dense que le plomb (11,3 g/cm 3 ), mais légèrement moins dense que le tungstène et l' or (19,3 g/cm 3 ).
L'uranium métal réagit avec presque tous les éléments non métalliques (à l'exception des gaz rares ) et leurs composés , la réactivité augmentant avec la température. Les acides chlorhydrique et nitrique dissolvent l'uranium, mais les acides non oxydants autres que l'acide chlorhydrique attaquent l'élément très lentement. Lorsqu'il est finement divisé, il peut réagir avec l'eau froide; dans l'air, l'uranium métal se recouvre d'une couche sombre d' oxyde d'uranium . L'uranium contenu dans les minerais est extrait chimiquement et transformé en dioxyde d'uranium ou en d'autres formes chimiques utilisables dans l'industrie.
L'uranium-235 a été le premier isotope fissile . D'autres isotopes naturels sont fissiles, mais non fissiles. Lors d'un bombardement avec des neutrons lents, son isotope d'uranium 235 se divisera la plupart du temps en deux noyaux plus petits , libérant de l' énergie de liaison nucléaire et davantage de neutrons. Si un trop grand nombre de ces neutrons sont absorbés par d'autres noyaux d'uranium 235, une réaction nucléaire en chaîne se produit qui se traduit par une bouffée de chaleur ou (dans des circonstances particulières) une explosion. Dans un réacteur nucléaire, une telle réaction en chaîne est ralentie et contrôlée par un poison neutronique , absorbant une partie des neutrons libres. Ces matériaux absorbant les neutrons font souvent partie des barres de contrôle des réacteurs (voir la physique des réacteurs nucléaires pour une description de ce processus de contrôle des réacteurs).
Aussi peu que 6,8 kg (15 lb) d'uranium 235 peuvent être utilisés pour fabriquer une bombe atomique. L'arme nucléaire qui a explosé au-dessus d'Hiroshima , appelée Little Boy , reposait sur la fission de l'uranium. Cependant, la première bombe nucléaire (le gadget utilisé à Trinity ) et la bombe qui a explosé au-dessus de Nagasaki ( Fat Man ) étaient toutes deux des bombes au plutonium.
L'uranium métal a trois formes allotropiques :
- α ( orthorhombique ) stable jusqu'à 668 ° C (1 234 ° F). Orthorhombique, groupe d'espace n° 63, Cmcm , paramètres de réseau a = 285,4 pm, b = 587 pm, c = 495,5 pm.
- β ( tétragonal ) stable de 668 à 775 ° C (1 234 à 1 427 ° F). Tétragonal, groupe d'espace P 4 2 / mnm , P 4 2 nm , ou P 4 n 2 , paramètres de réseau a = 565,6 pm, b = c = 1075,9 pm.
- γ ( corps cubique centré ) de 775 ° C (1 427 ° F) au point de fusion - c'est l'état le plus malléable et ductile. Cubique centré sur le corps, paramètre de réseau a = 352,4 pm.
Applications
Militaire

La principale application de l'uranium dans le secteur militaire concerne les pénétrateurs à haute densité. Ces munitions sont constituées d' uranium appauvri (UA) allié à 1 à 2 % d'autres éléments, tels que le titane ou le molybdène . À haute vitesse d'impact, la densité, la dureté et la pyrophoricité du projectile permettent la destruction de cibles lourdement blindées. Les blindages de chars et autres blindages de véhicules amovibles peuvent également être renforcés avec des plaques d'uranium appauvri. L'utilisation d'uranium appauvri est devenue politiquement et écologiquement controversée après que l'utilisation de telles munitions par les États-Unis, le Royaume-Uni et d'autres pays pendant les guerres dans le golfe Persique et les Balkans a soulevé des questions concernant les composés d'uranium laissés dans le sol (voir le syndrome de la guerre du Golfe ).
L'uranium appauvri est également utilisé comme matériau de blindage dans certains conteneurs utilisés pour stocker et transporter des matières radioactives. Bien que le métal lui-même soit radioactif, sa haute densité le rend plus efficace que le plomb pour arrêter le rayonnement provenant de sources puissantes telles que le radium . D'autres utilisations de l'uranium appauvri comprennent les contrepoids pour les surfaces de contrôle des avions, comme lest pour les véhicules de rentrée de missiles et comme matériau de blindage. Du fait de sa forte densité, ce matériau se retrouve dans les systèmes de guidage inertiel et dans les compas gyroscopiques . L'uranium appauvri est préféré aux métaux de densité similaire en raison de sa capacité à être facilement usiné et coulé ainsi que de son coût relativement faible. Le principal risque d'exposition à l'uranium appauvri est l'empoisonnement chimique par l'oxyde d'uranium plutôt que la radioactivité (l'uranium n'étant qu'un faible émetteur alpha ).
Au cours des dernières étapes de la Seconde Guerre mondiale , de toute la guerre froide et, dans une moindre mesure, par la suite, l'uranium 235 a été utilisé comme matière explosive fissile pour produire des armes nucléaires. Initialement, deux grands types de bombes à fission ont été construits : un dispositif relativement simple qui utilise de l'uranium-235 et un mécanisme plus compliqué qui utilise du plutonium-239 dérivé de l'uranium-238. Plus tard, un type beaucoup plus compliqué et beaucoup plus puissant de bombe à fission/fusion ( arme thermonucléaire ) a été construit, qui utilise un dispositif à base de plutonium pour provoquer la fusion nucléaire d'un mélange de tritium et de deutérium . Ces bombes sont enveloppées dans un boîtier en uranium non fissile (non enrichi) et tirent plus de la moitié de leur puissance de la fission de ce matériau par les neutrons rapides du processus de fusion nucléaire.
Civil

La principale utilisation de l'uranium dans le secteur civil est l'alimentation des centrales nucléaires . Un kilogramme d'uranium 235 peut théoriquement produire environ 20 térajoules d'énergie (2 × 1013 joules ), en supposant une fission complète ; autant d' énergie que 1,5 million de kilogrammes (1 500 tonnes ) de charbon .
Les centrales nucléaires commerciales utilisent du combustible généralement enrichi à environ 3 % d'uranium-235. Les conceptions CANDU et Magnox sont les seuls réacteurs commerciaux capables d'utiliser du combustible à l'uranium non enrichi. Le combustible utilisé pour les réacteurs de la marine américaine est généralement fortement enrichi en uranium 235 (les valeurs exactes sont classées ). Dans un réacteur surgénérateur , l'uranium 238 peut également être converti en plutonium par la réaction suivante :

Avant (et parfois après) la découverte de la radioactivité, l'uranium était principalement utilisé en petites quantités pour le verre jaune et les émaux de poterie, tels que le verre d'uranium et dans Fiestaware .
La découverte et l'isolement du radium dans le minerai d'uranium (pitchblende) par Marie Curie ont déclenché le développement de l'extraction de l'uranium pour extraire le radium, qui a été utilisé pour fabriquer des peintures phosphorescentes pour les cadrans d'horloge et d'avion. Cela a laissé une quantité prodigieuse d'uranium comme déchet, puisqu'il faut trois tonnes d'uranium pour extraire un gramme de radium. Ce déchet a été détourné vers l'industrie du vitrage, rendant les émaux d'uranium très bon marché et abondants. Outre les glaçures de poterie, les glaçures de carreaux d'uranium représentaient l'essentiel de l'utilisation, y compris les carreaux de salle de bain et de cuisine courants qui peuvent être produits en vert, jaune, mauve , noir, bleu, rouge et autres couleurs.


L'uranium était également utilisé dans les produits chimiques photographiques (en particulier le nitrate d'uranium comme toner ), dans les filaments de lampe pour les ampoules d' éclairage de scène , pour améliorer l'apparence des prothèses dentaires , et dans les industries du cuir et du bois pour les teintures et les teintures. Les sels d'uranium sont des mordants de soie ou de laine. L'acétate d'uranyle et le formiate d'uranyle sont utilisés comme "colorants" denses aux électrons en microscopie électronique à transmission , pour augmenter le contraste des échantillons biologiques dans les coupes ultrafines et dans la coloration négative des virus , des organites cellulaires isolés et des macromolécules .
La découverte de la radioactivité de l'uranium a inauguré des utilisations scientifiques et pratiques supplémentaires de l'élément. La longue demi-vie de l'isotope uranium-238 (4,47 × 109 ans) le rend bien adapté pour une utilisation dans l'estimation de l'âge des premières roches ignées et pour d'autres types de datation radiométrique , y compris la datation uranium-thorium , la datation uranium-plomb et la datation uranium-uranium . L'uranium métal est utilisé pour les cibles de rayons X dans la fabrication de rayons X à haute énergie.
Histoire
Utilisation pré-découverte

L'utilisation de l'uranium sous sa forme d' oxyde naturel remonte au moins à l'an 79 de notre ère , lorsqu'il était utilisé dans l' Empire romain pour ajouter une couleur jaune aux émaux céramiques . Du verre jaune contenant 1% d'oxyde d'uranium a été trouvé dans une villa romaine du cap Posillipo dans la baie de Naples , en Italie, par RT Gunther de l' Université d'Oxford en 1912. À partir de la fin du Moyen Âge , la pechblende a été extraite des mines d'argent des Habsbourg . à Joachimsthal , en Bohême (aujourd'hui Jáchymov en République tchèque), et était utilisé comme colorant dans l' industrie verrière locale . Au début du XIXe siècle, les seules sources connues de minerai d'uranium au monde étaient ces mines. L'extraction d'uranium dans les monts Métallifères a cessé du côté allemand après la fin de la guerre froide et la fermeture du SDAG Wismut . Du côté tchèque, il y a eu des tentatives pendant la bulle des prix de l'uranium de 2007 pour redémarrer l'exploitation minière, mais celles-ci ont été rapidement abandonnées suite à une chute des prix de l'uranium.
Découverte

La découverte de l'élément est attribuée au chimiste allemand Martin Heinrich Klaproth . Alors qu'il travaillait dans son laboratoire expérimental à Berlin en 1789, Klaproth a pu précipiter un composé jaune (probablement du diuranate de sodium ) en dissolvant de la pechblende dans de l'acide nitrique et en neutralisant la solution avec de l'hydroxyde de sodium . Klaproth a supposé que la substance jaune était l'oxyde d'un élément encore inconnu et l'a chauffée avec du charbon de bois pour obtenir une poudre noire, qu'il pensait être le métal nouvellement découvert lui-même (en fait, cette poudre était un oxyde d'uranium). Il a nommé l'élément nouvellement découvert d'après la planète Uranus (du nom du dieu grec primordial du ciel ), qui avait été découverte huit ans plus tôt par William Herschel .
En 1841, Eugène-Melchior Péligot , professeur de chimie analytique au Conservatoire national des arts et métiers de Paris , isole le premier échantillon d'uranium métal en chauffant du tétrachlorure d'uranium avec du potassium .
Henri Becquerel a découvert la radioactivité en utilisant l'uranium en 1896. Becquerel a fait la découverte à Paris en laissant un échantillon d'un sel d'uranium, K 2 UO 2 (SO 4 ) 2 (sulfate d'uranyle de potassium), au-dessus d'une plaque photographique non exposée dans un tiroir et notant que la plaque était devenue "buée". Il a déterminé qu'une forme de lumière invisible ou de rayons émis par l'uranium avait exposé la plaque.
Pendant la Première Guerre mondiale, lorsque les puissances centrales ont souffert d'une pénurie de molybdène pour fabriquer des canons de canons d'artillerie et des aciers à outils à grande vitesse, elles ont régulièrement remplacé les alliages de ferrouranium qui présentent bon nombre des mêmes caractéristiques physiques. Lorsque cette pratique est devenue connue en 1916, le gouvernement américain a demandé à plusieurs universités de premier plan de rechercher ces utilisations de l'uranium et les outils fabriqués avec ces formules sont restés en usage pendant plusieurs décennies, ne se terminant que lorsque le projet Manhattan et la guerre froide ont imposé une forte demande d'uranium pour la fission. recherche et développement d'armes.
Recherche sur les fissions
Une équipe dirigée par Enrico Fermi en 1934 a observé que le bombardement de l'uranium avec des neutrons produit l'émission de rayons bêta ( électrons ou positrons issus des éléments produits ; voir particule bêta ). Les produits de fission ont d'abord été confondus avec de nouveaux éléments de numéros atomiques 93 et 94, que le doyen de la faculté de Rome, Orso Mario Corbino, a respectivement baptisés ausonium et hesperium . Les expériences menant à la découverte de la capacité de l'uranium à se fissionner (se décomposer) en éléments plus légers et à libérer de l'énergie de liaison ont été menées par Otto Hahn et Fritz Strassmann dans le laboratoire de Hahn à Berlin. Lise Meitner et son neveu, le physicien Otto Robert Frisch , publient l'explication physique en février 1939 et nomment le processus « fission nucléaire ». Peu de temps après, Fermi a émis l'hypothèse que la fission de l'uranium pourrait libérer suffisamment de neutrons pour entretenir une réaction de fission. La confirmation de cette hypothèse est venue en 1939, et des travaux ultérieurs ont révélé qu'en moyenne environ 2,5 neutrons sont libérés par chaque fission de l'isotope rare de l'uranium, l'uranium-235. Fermi a exhorté Alfred OC Nier à séparer les isotopes de l'uranium pour la détermination du composant fissile, et le 29 février 1940, Nier a utilisé un instrument qu'il a construit à l'Université du Minnesota pour séparer le premier échantillon d'uranium 235 au monde dans le laboratoire Tate. Après avoir été envoyé par courrier au cyclotron de l'Université de Columbia , John Dunning a confirmé que l'échantillon était la matière fissile isolée le 1er mars. D'autres travaux ont montré que l'isotope beaucoup plus courant de l'uranium-238 peut être transmuté en plutonium, qui, comme l'uranium-235, est également fissile par les neutrons thermiques. Ces découvertes ont conduit de nombreux pays à commencer à travailler sur le développement des armes nucléaires et de l'énergie nucléaire . Bien que la fission ait été découverte en Allemagne, le projet allemand de recherche sur l'énergie nucléaire et/ou les armes de l' Uranverein ("club de l'uranium") en temps de guerre a été entravé par des ressources limitées, des luttes intestines, l'exil ou la non-implication de plusieurs scientifiques éminents dans le domaine et plusieurs des erreurs cruciales telles que le fait de ne pas tenir compte des impuretés dans les échantillons de graphite disponibles, ce qui l'a fait apparaître moins approprié comme modérateur de neutrons qu'il ne l'est en réalité. Les tentatives de l'Allemagne de construire un réacteur à uranium naturel / eau lourde n'étaient pas près d'atteindre la criticité au moment où les Américains ont atteint Haigerloch , le site de la dernière expérience de réacteur de guerre allemande.
Le 2 décembre 1942, dans le cadre du projet Manhattan , une autre équipe dirigée par Enrico Fermi a pu initier la première réaction nucléaire en chaîne artificielle auto-entretenue , Chicago Pile-1 . Un premier projet utilisant de l'uranium 235 enrichi a été abandonné car il n'était pas encore disponible en quantité suffisante. Travaillant dans un laboratoire sous les stands de Stagg Field à l' Université de Chicago , l'équipe a créé les conditions nécessaires à une telle réaction en empilant 400 tonnes courtes (360 tonnes métriques ) de graphite , 58 tonnes courtes (53 tonnes métriques) d' uranium , et six tonnes courtes (5,5 tonnes métriques) d'uranium métal, dont la majorité a été fournie par Westinghouse Lamp Plant dans le cadre d'un processus de production de fortune.
Armement nucléaire

Deux grands types de bombes atomiques ont été développés par les États-Unis pendant la Seconde Guerre mondiale : un engin à base d'uranium (nom de code « Little Boy ») dont la matière fissile était de l'uranium hautement enrichi , et un engin à base de plutonium (voir test Trinity et « Fat Man ") dont le plutonium était dérivé de l'uranium-238. Le dispositif Little Boy à base d'uranium est devenu la première arme nucléaire utilisée pendant la guerre lorsqu'il a explosé au-dessus de la ville japonaise d' Hiroshima le 6 août 1945. Explosant avec un rendement équivalent à 12 500 tonnes de TNT , l'explosion et l'onde thermique de la bombe ont détruit près de 50 000 bâtiments et tué environ 75 000 personnes (voir Bombardements atomiques d'Hiroshima et de Nagasaki ). Au départ, on pensait que l'uranium était relativement rare et que la prolifération nucléaire pouvait être évitée en rachetant simplement tous les stocks d'uranium connus, mais en une décennie, d'importants gisements ont été découverts dans de nombreux endroits du monde.
Réacteurs

Le réacteur en graphite X-10 du laboratoire national d'Oak Ridge (ORNL) à Oak Ridge, Tennessee, anciennement connu sous le nom de Clinton Pile et X-10 Pile, était le deuxième réacteur nucléaire artificiel au monde (après le Chicago Pile d'Enrico Fermi) et le premier réacteur conçu et construit pour un fonctionnement continu. L'Argonne National Laboratory 's Experimental Breeder Reactor I , situé à la station nationale d'essais des réacteurs de la Commission de l'énergie atomique près d' Arco, Idaho , est devenu le premier réacteur nucléaire à produire de l'électricité le 20 décembre 1951. Initialement, quatre ampoules de 150 watts étaient allumées par le réacteur, mais des améliorations lui ont finalement permis d'alimenter l'ensemble de l'installation (plus tard, la ville d'Arco est devenue la première au monde à voir toute son électricité provenir de l'énergie nucléaire générée par BORAX-III , un autre réacteur conçu et exploité par le Laboratoire national d'Argonne ) . La première centrale nucléaire à échelle commerciale au monde, Obninsk en Union soviétique , a commencé la production avec son réacteur AM-1 le 27 juin 1954. Les autres premières centrales nucléaires étaient Calder Hall en Angleterre , qui a commencé la production le 17 octobre 1956, et le Shippingport Atomic Power Station en Pennsylvanie , qui a débuté le 26 mai 1958. L'énergie nucléaire a été utilisée pour la première fois pour la propulsion par un sous- marin , l' USS Nautilus , en 1954.
Fission naturelle préhistorique
En 1972, le physicien français Francis Perrin a découvert quinze réacteurs à fission nucléaire naturels anciens et plus actifs dans trois gisements de minerai distincts à la mine d'Oklo au Gabon , en Afrique de l'Ouest , collectivement connus sous le nom de réacteurs fossiles d'Oklo . Le gisement de minerai a 1,7 milliard d'années; puis, l'uranium-235 constituait environ 3% de l'uranium total sur Terre. Ceci est suffisamment élevé pour permettre à une réaction en chaîne de fission nucléaire soutenue de se produire, à condition que d'autres conditions de soutien existent. La capacité des sédiments environnants à contenir les déchets nucléaires a été citée par le gouvernement fédéral américain comme preuve à l'appui de la faisabilité du stockage du combustible nucléaire usé dans le dépôt de déchets nucléaires de Yucca Mountain .
Contamination et héritage de la guerre froide
Les essais nucléaires en surface effectués par l'Union soviétique et les États-Unis dans les années 1950 et au début des années 1960 et par la France dans les années 1970 et 1980 ont répandu une quantité importante de retombées des isotopes de filiation de l'uranium dans le monde entier. Des retombées et une pollution supplémentaires se sont produites à la suite de plusieurs accidents nucléaires .
Les mineurs d'uranium ont une incidence plus élevée de cancer . Un excès de risque de cancer du poumon chez les mineurs d'uranium Navajo , par exemple, a été documenté et lié à leur profession. La Radiation Exposure Compensation Act , une loi de 1990 aux États-Unis, exigeait 100 000 $ en « paiements de compassion » pour les mineurs d'uranium diagnostiqués avec un cancer ou d'autres affections respiratoires.
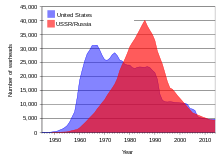
Pendant la guerre froide entre l'Union soviétique et les États-Unis, d'énormes stocks d'uranium ont été amassés et des dizaines de milliers d'armes nucléaires ont été créées à partir d'uranium enrichi et de plutonium à base d'uranium. Depuis l' éclatement de l'Union soviétique en 1991, on estime que 600 tonnes courtes (540 tonnes métriques) d'uranium de qualité militaire hautement enrichi (assez pour fabriquer 40 000 ogives nucléaires) ont été stockées dans des installations souvent insuffisamment gardées en Fédération de Russie et dans plusieurs d'autres anciens États soviétiques. La police en Asie , en Europe et en Amérique du Sud à au moins 16 reprises entre 1993 et 2005 a intercepté des expéditions d'uranium ou de plutonium de qualité bombe de contrebande, dont la plupart provenaient de sources ex-soviétiques. De 1993 à 2005, le programme de protection, de contrôle et de comptabilité des matériaux, géré par le gouvernement fédéral des États-Unis , a dépensé environ 550 millions de dollars américains pour aider à protéger les stocks d'uranium et de plutonium en Russie. Cet argent a été utilisé pour des améliorations et des améliorations de la sécurité dans les installations de recherche et de stockage. Scientific American a rapporté en février 2006 que dans certaines des installations, la sécurité consistait en des clôtures à mailles losangées qui étaient dans un état de délabrement sévère. Selon une interview de l'article, une installation stockait des échantillons d'uranium enrichi (de qualité militaire) dans un placard à balais avant le projet d'amélioration ; un autre suivait son stock d'ogives nucléaires à l'aide de fiches conservées dans une boîte à chaussures.
Occurrence
Origine
Comme tous les éléments ayant des poids atomiques supérieurs à celui du fer , l'uranium ne se forme naturellement que par le processus r (capture rapide de neutrons) dans les fusions de supernovae et d'étoiles à neutrons . Le thorium et l'uranium primordiaux ne sont produits que dans le processus r, car le processus s (capture lente des neutrons) est trop lent et ne peut pas passer l'écart d'instabilité après le bismuth. Outre les deux isotopes primordiaux de l'uranium existants, 235 U et 238 U, le processus r a également produit des quantités importantes de 236 U , qui a une demi-vie plus courte et est donc un radionucléide éteint , s'étant depuis longtemps complètement désintégré en 232 Th. L'uranium-236 a lui-même été enrichi par la désintégration du 244 Pu , ce qui explique l'abondance de thorium plus élevée que prévu et l'abondance d'uranium plus faible que prévu. Alors que l'abondance naturelle de l'uranium a été complétée par la désintégration du 242 Pu (demi-vie de 0,375 million d'années) et du 247 Cm (demi-vie de 16 millions d'années), produisant respectivement 238 U et 235 U, cela s'est produit à un niveau presque négligeable. En raison des demi-vies plus courtes de ces parents et de leur production inférieure à 236 U et 244 Pu, les parents du thorium : le rapport 247 Cm : 235 U à la formation du Système solaire était(7,0 ± 1,6) × 10 -5 .
Biotique et abiotique

L'uranium est un élément naturel que l'on peut trouver à de faibles niveaux dans toutes les roches, le sol et l'eau. L'uranium est le 51e élément par ordre d' abondance dans la croûte terrestre. L'uranium est également l'élément le plus élevé que l'on trouve naturellement en quantités importantes sur Terre et se trouve presque toujours combiné avec d'autres éléments. On pense que la désintégration de l'uranium, du thorium et du potassium 40 dans le manteau terrestre est la principale source de chaleur qui maintient le noyau externe de la Terre à l'état liquide et entraîne la convection du manteau , qui à son tour entraîne la tectonique des plaques .
La concentration moyenne d'uranium dans la croûte terrestre est (selon la référence) de 2 à 4 parties par million, soit environ 40 fois plus abondante que l'argent . La croûte terrestre de la surface à 25 km (15 mi) vers le bas est calculée pour contenir 10 17 kg (2 × 1017 lb) d'uranium alors que les océans peuvent en contenir 10 13 kg (2 × 1013 livres). La concentration d'uranium dans le sol varie de 0,7 à 11 parties par million (jusqu'à 15 parties par million dans le sol des terres agricoles en raison de l'utilisation d' engrais phosphatés ) et sa concentration dans l'eau de mer est de 3 parties par milliard.
L'uranium est plus abondant que l'antimoine , l' étain , le cadmium , le mercure ou l'argent, et il est à peu près aussi abondant que l'arsenic ou le molybdène . L'uranium se trouve dans des centaines de minéraux, dont l'uraninite (le minerai d'uranium le plus courant ), la carnotite , l' autunite , l' uranophane , la torbernite et la coffinite . Des concentrations importantes d'uranium se produisent dans certaines substances telles que les gisements de roches phosphatées et des minéraux tels que le lignite et les sables de monazite dans les minerais riches en uranium (il est récupéré commercialement à partir de sources contenant aussi peu que 0,1% d'uranium).

Certaines bactéries, telles que Shewanella putrefaciens , Geobacter metallireducens et certaines souches de Burkholderia fungorum , utilisent l'uranium pour leur croissance et convertissent l'U(VI) en U(IV). Des recherches récentes suggèrent que cette voie comprend la réduction de l'U(VI) soluble via un état pentavalent U(V) intermédiaire.
D'autres organismes, comme le lichen Trapelia involuta ou des micro -organismes comme la bactérie Citrobacter , peuvent absorber des concentrations d'uranium jusqu'à 300 fois supérieures au niveau de leur environnement. Les espèces de Citrobacter absorbent les ions uranyle lorsqu'elles reçoivent du phosphate de glycérol (ou d'autres phosphates organiques similaires). Au bout d'une journée, un gramme de bactéries peut s'incruster de neuf grammes de cristaux de phosphate d'uranyle ; cela crée la possibilité que ces organismes puissent être utilisés dans la bioremédiation pour décontaminer l'eau polluée par l'uranium. Il a également été démontré que la protéobactérie Geobacter biorestaure l'uranium dans les eaux souterraines. Le champignon mycorhizien Glomus intraradices augmente la teneur en uranium des racines de sa plante symbiotique.
Dans la nature, l'uranium(VI) forme des complexes carbonatés très solubles à pH alcalin. Cela conduit à une augmentation de la mobilité et de la disponibilité de l'uranium dans les eaux souterraines et le sol provenant des déchets nucléaires, ce qui entraîne des risques pour la santé. Cependant, il est difficile de précipiter l'uranium sous forme de phosphate en présence d'un excès de carbonate à pH alcalin. Un Sphingomonas sp. la souche BSAR-1 s'est avérée exprimer une phosphatase alcaline à haute activité (PhoK) qui a été appliquée pour la bioprécipitation de l'uranium en tant qu'espèce de phosphate d'uranyle à partir de solutions alcalines. La capacité de précipitation a été améliorée par la surexpression de la protéine PhoK dans E. coli .
Les plantes absorbent une partie de l'uranium du sol. Les concentrations en poids sec d'uranium dans les usines varient de 5 à 60 parties par milliard, et les cendres de bois brûlé peuvent avoir des concentrations allant jusqu'à 4 parties par million. Les concentrations en poids sec d'uranium dans les usines alimentaires sont généralement plus faibles avec un à deux microgrammes par jour ingérés par les aliments que les gens mangent.
Production et exploitation minière
La production mondiale d'U 3 O 8 (yellowcake) en 2013 s'est élevée à 70 015 tonnes , dont 22 451 t (32 %) ont été extraites au Kazakhstan . Les autres grands pays producteurs d'uranium sont le Canada (9 331 t), l'Australie (6 350 t), le Niger (4 518 t), la Namibie (4 323 t) et la Russie (3 135 t).
Le minerai d'uranium est extrait de plusieurs manières : à ciel ouvert , souterrain , par lixiviation in situ et par forage (voir extraction d'uranium ). Le minerai d'uranium à faible teneur extrait contient généralement de 0,01 à 0,25 % d'oxydes d'uranium. Des mesures extensives doivent être employées pour extraire le métal de son minerai. Les minerais à haute teneur trouvés dans les gisements du bassin d'Athabasca en Saskatchewan , au Canada, peuvent contenir jusqu'à 23 % d'oxydes d'uranium en moyenne. Le minerai d'uranium est broyé et transformé en une poudre fine, puis lessivé avec un acide ou un alcali . Le lixiviat est soumis à l'une des nombreuses séquences de précipitation, d'extraction par solvant et d'échange d'ions. Le mélange obtenu, appelé yellowcake , contient au moins 75 % d'oxydes d'uranium U 3 O 8 . Yellowcake est ensuite calciné pour éliminer les impuretés du processus de broyage avant le raffinage et la conversion.
L'uranium de qualité commerciale peut être produit par la réduction d' halogénures d'uranium avec des métaux alcalins ou alcalino-terreux . L'uranium métal peut également être préparé par électrolyse de KUF
5ou
UF
4, dissous dans du chlorure de calcium fondu ( Ca Cl
2) et une solution de chlorure de sodium ( NaCl ). L'uranium très pur est produit par la décomposition thermique d'halogénures d'uranium sur un filament chaud.
Le Yellowcake est un mélange concentré d'oxydes d'uranium qui est encore raffiné pour extraire l'uranium pur.
Ressources et réserves
On estime qu'il existe 5,5 millions de tonnes d'uranium dans des réserves de minerai économiquement viables à 59 dollars américains par livre d'uranium, tandis que 35 millions de tonnes sont classées comme ressources minérales (perspectives raisonnables d'extraction économique éventuelle). Les prix sont passés d'environ 10 $/lb en mai 2003 à 138 $/lb en juillet 2007. Cela a entraîné une forte augmentation des dépenses d'exploration, avec 200 millions de dollars américains dépensés dans le monde en 2005, soit une augmentation de 54 % par rapport à l'année précédente. Cette tendance s'est poursuivie jusqu'en 2006, lorsque les dépenses d'exploration ont grimpé à plus de 774 millions de dollars, soit une augmentation de plus de 250 % par rapport à 2004. L' Agence pour l'énergie nucléaire de l' OCDE a déclaré que les chiffres d'exploration pour 2007 correspondraient probablement à ceux de 2006.
L'Australie possède 31% des réserves mondiales connues de minerai d'uranium et le plus grand gisement d'uranium au monde, situé à la mine Olympic Dam en Australie-Méridionale . Il existe une importante réserve d'uranium à Bakouma , une sous-préfecture de la préfecture du Mbomou en République centrafricaine .
Une partie du combustible nucléaire provient d'armes nucléaires en cours de démantèlement, comme le programme Megatons to Megawatts .
On estime que 4,6 milliards de tonnes supplémentaires d'uranium se trouvent dans l'eau de mer ( des scientifiques japonais dans les années 1980 ont montré que l'extraction de l'uranium de l'eau de mer à l'aide d'échangeurs d'ions était techniquement faisable). Il y a eu des expériences pour extraire l'uranium de l'eau de mer, mais le rendement a été faible en raison du carbonate présent dans l'eau. En 2012, les chercheurs de l' ORNL ont annoncé le développement réussi d'un nouveau matériau absorbant appelé HiCap qui retient en surface les molécules solides ou gazeuses, les atomes ou les ions et élimine également efficacement les métaux toxiques de l'eau, selon les résultats vérifiés par les chercheurs du Pacific Northwest National Laboratory.
Fournitures

En 2005, dix-sept pays produisaient des oxydes d'uranium concentrés : Canada (27,9 % de la production mondiale), Australie (22,8 %), Kazakhstan (10,5 %), Russie (8,0 %), Namibie (7,5 %), Niger (7,4 %), Ouzbékistan (5,5%), les États-Unis (2,5%), l'Argentine (2,1%), l'Ukraine (1,9%) et la Chine (1,7%). En 2008, on prévoyait que le Kazakhstan augmenterait sa production et pourrait devenir le plus grand producteur mondial d'uranium d'ici 2009 avec une production prévue de 12 826 tonnes, contre le Canada avec 11 100 t et l'Australie avec 9 430 t. Les prédictions se sont réalisées. En 2019, le Kazakhstan produit la plus grande part d'uranium à partir de mines 42% de l'approvisionnement mondial, suivi du Canada (13%) et de l'Australie (12%), de la Namibie (10%), de l'Ouzbékistan (6%), du Niger (5%), de la Russie (5 %), Chine (3 %), Ukraine (1,5 %), États-Unis (0,12 %), Inde (0,6 %), Iran (0,13 %), avec une production mondiale totale de 54 752 tonnes provenant des mines. Cependant, il convient de mentionner qu'en 2019, l'uranium a été extrait non seulement par l'extraction souterraine conventionnelle de minerais 43% de la production (54752 tonnes), où la roche minéralisée est retirée du sol, la fragmentant et la traitant pour éliminer les minéraux recherchés mais aussi par lixiviation in situ (LIS) 57 % de la production mondiale (64 566 tonnes).
À la fin des années 1960, les géologues de l'ONU ont également découvert d'importants gisements d'uranium et d'autres réserves minérales rares en Somalie . La découverte était la plus importante du genre, les experts de l'industrie estimant les gisements à plus de 25% des réserves mondiales d'uranium alors connues de 800 000 tonnes.
On pense que l'offre ultime disponible sera suffisante pour au moins les 85 prochaines années, bien que certaines études indiquent qu'un sous-investissement à la fin du XXe siècle pourrait entraîner des problèmes d'approvisionnement au XXIe siècle. Les gisements d'uranium semblent avoir une distribution log-normale. Il y a une augmentation de 300 fois de la quantité d'uranium récupérable pour chaque décuplement de la teneur du minerai. En d'autres termes, il y a peu de minerai à haute teneur et proportionnellement beaucoup plus de minerai à faible teneur disponible.
Composés
États d'oxydation et oxydes
Oxydes
Le gâteau jaune d'uranium calciné, tel qu'il est produit dans de nombreuses grandes usines, contient une distribution d'espèces d'oxydation de l'uranium sous diverses formes allant de la plus oxydée à la moins oxydée. Les particules avec des temps de séjour courts dans un calcinateur seront généralement moins oxydées que celles avec des temps de rétention longs ou que les particules récupérées dans l'épurateur de cheminée. La teneur en uranium est généralement référencée à U
3O
8, qui remonte à l'époque du projet Manhattan quand U
3O
8a été utilisé comme norme de rapport de chimie analytique.
Les relations de phase dans le système uranium-oxygène sont complexes. Les états d'oxydation les plus importants de l'uranium sont l'uranium (IV) et l'uranium (VI), et leurs deux oxydes correspondants sont, respectivement, le dioxyde d'uranium ( UO
2) et le trioxyde d'uranium ( UO
3). D'autres oxydes d'uranium tels que le monoxyde d'uranium (UO), le pentoxyde de diuranium ( U
2O
5), et le peroxyde d'uranium ( UO
4·2H
2O ) existent également.
Les formes les plus courantes d'oxyde d'uranium sont l'octoxyde de triuranium ( U
3O
8) et UO
2. Les deux formes d'oxyde sont des solides qui ont une faible solubilité dans l'eau et sont relativement stables dans une large gamme de conditions environnementales. L'octoxyde de triuranium est (selon les conditions) le composé d'uranium le plus stable et la forme la plus couramment trouvée dans la nature. Le dioxyde d'uranium est la forme sous laquelle l'uranium est le plus couramment utilisé comme combustible de réacteur nucléaire. A température ambiante, UO
2se convertira progressivement en U
3O
8. En raison de leur stabilité, les oxydes d'uranium sont généralement considérés comme la forme chimique préférée pour le stockage ou l'élimination.
Chimie aqueuse
Les sels de nombreux états d'oxydation de l'uranium sont solubles dans l'eau et peuvent être étudiés dans des solutions aqueuses . Les formes ioniques les plus courantes sont U3+
(marron-rouge), U4+
(vert), UO+
2(instable), et UO2+
2(jaune), pour U(III), U(IV), U(V) et U(VI), respectivement. Quelques composés solides et semi-métalliques tels que UO et US existent pour l'état d'oxydation formel de l'uranium (II), mais aucun ion simple n'est connu pour exister en solution pour cet état. Ions d' U3+
libèrent de l' hydrogène de l'eau et sont donc considérés comme très instables. L' UO2+
2représente l'état uranium(VI) et est connu pour former des composés tels que le carbonate d'uranyle , le chlorure d' uranyle et le sulfate d'uranyle . UO2+
2forme également des complexes avec divers agents chélatants organiques , dont le plus couramment rencontré est l'acétate d'uranyle .
Contrairement aux sels d'uranyle de l'uranium et des formes cationiques d'oxyde d'uranium à ion polyatomique , les uranates , sels contenant un anion oxyde d'uranium polyatomique, ne sont généralement pas hydrosolubles.
Carbonates
Les interactions des anions carbonate avec l'uranium (VI) provoquent une modification importante du diagramme de Pourbaix lorsque le milieu passe de l'eau à une solution contenant du carbonate. Alors que la grande majorité des carbonates sont insolubles dans l'eau (on enseigne souvent aux élèves que tous les carbonates autres que ceux des métaux alcalins sont insolubles dans l'eau), les carbonates d'uranium sont souvent solubles dans l'eau. En effet, un cation U(VI) est capable de lier deux oxydes terminaux et trois carbonates ou plus pour former des complexes anioniques.
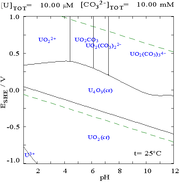
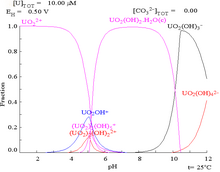
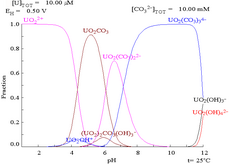
| Uranium en milieu aqueux non complexant (par exemple acide perchlorique /hydroxyde de sodium). | Uranium en solution carbonatée |
| Concentrations relatives des différentes formes chimiques de l'uranium dans un milieu aqueux non complexant (par exemple acide perchlorique /hydroxyde de sodium). | Concentrations relatives des différentes formes chimiques de l'uranium dans une solution aqueuse de carbonate. |
Effets du pH
Les diagrammes de fraction d'uranium en présence de carbonate l'illustrent davantage : lorsque le pH d'une solution d'uranium (VI) augmente, l'uranium est converti en un hydroxyde d'oxyde d'uranium hydraté et à des pH élevés, il devient un complexe d'hydroxyde anionique.
Lorsque le carbonate est ajouté, l'uranium est converti en une série de complexes de carbonate si le pH est augmenté. L'un des effets de ces réactions est l'augmentation de la solubilité de l'uranium dans la plage de pH de 6 à 8, un fait qui a une incidence directe sur la stabilité à long terme des combustibles nucléaires usés à base de dioxyde d'uranium.
Hydrures, carbures et nitrures
L'uranium métal chauffé à 250 à 300 °C (482 à 572 °F) réagit avec l'hydrogène pour former de l'hydrure d'uranium . Des températures encore plus élevées élimineront de manière réversible l'hydrogène. Cette propriété fait des hydrures d'uranium des matériaux de départ pratiques pour créer de la poudre d'uranium réactive avec divers composés de carbure , de nitrure et d'halogénure d'uranium . Deux modifications cristallines de l'hydrure d'uranium existent : une forme α qui est obtenue à basse température et une forme β qui est créée lorsque la température de formation est supérieure à 250 °C.
Les carbures d'uranium et les nitrures d'uranium sont tous deux des composés semi- métalliques relativement inertes qui sont peu solubles dans les acides , réagissent avec l'eau et peuvent s'enflammer dans l'air pour former U
3O
8. Les carbures d'uranium comprennent le monocarbure d'uranium (U C ), le dicarbure d'uranium ( UC
2), et le tricarbure de diuranium ( U
2C
3). UC et UC
2se forment en ajoutant du carbone à l'uranium fondu ou en exposant le métal au monoxyde de carbone à des températures élevées. Stable en dessous de 1800 °C, U
2C
3est préparé en soumettant un mélange chauffé d'UC et d' UC
2aux contraintes mécaniques. Les nitrures d'uranium obtenus par exposition directe du métal à l'azote comprennent le mononitrure d'uranium (UN), le dinitrure d'uranium ( UN
2), et le trinitrure de diuranium ( U
2N
3).
Halogénures

Tous les fluorures d'uranium sont créés à l'aide de tétrafluorure d'uranium ( UF
4); UF
4lui-même est préparé par hydrofluoration du dioxyde d'uranium. Réduction de l'UF
4avec de l'hydrogène à 1000 °C produit du trifluorure d'uranium ( UF
3). Dans les bonnes conditions de température et de pression, la réaction de l' UF solide
4avec de l'hexafluorure d'uranium gazeux ( UF
6) peut former les fluorures intermédiaires de U
2F
9, U
4F
17, et UF
5.
A température ambiante, UF
6a une pression de vapeur élevée , ce qui le rend utile dans le processus de diffusion gazeuse pour séparer l'uranium-235 rare de l'isotope commun de l'uranium-238. Ce composé peut être préparé à partir de dioxyde d'uranium et d'hydrure d'uranium par le procédé suivant :
-
UO
2+ 4 HF → UF
4+ 2H
2O (500 °C, endothermique) -
UF
4+ F
2→ UF
6(350 °C, endothermique)
L' UF résultant
6, un solide blanc, est hautement réactif (par fluoration), se sublime facilement (en émettant une vapeur qui se comporte comme un gaz presque parfait ) et est le composé d'uranium le plus volatil connu.
Une méthode de préparation du tétrachlorure d'uranium ( UCl
4) consiste à combiner directement le chlore avec soit de l'uranium métal, soit de l'hydrure d'uranium. La réduction de l'UCl
4par l'hydrogène produit du trichlorure d'uranium ( UCl
3) tandis que les chlorures supérieurs d'uranium sont préparés par réaction avec du chlore supplémentaire. Tous les chlorures d'uranium réagissent avec l'eau et l'air.
Les bromures et les iodures d'uranium sont formés par réaction directe, respectivement, du brome et de l' iode avec l'uranium ou par addition d' UH
3aux acides de ces éléments. Les exemples connus incluent : UBr
3, UBr
4, interface utilisateur
3, et interface utilisateur
4. interface utilisateur
5n'a jamais été préparé. Les oxyhalogénures d'uranium sont solubles dans l'eau et comprennent UO
2F
2, UOCl
2, UO
2CL
2, et UO
2BR
2. La stabilité des oxyhalogénures diminue à mesure que le poids atomique de l'halogénure composant augmente.
Isotopes
Concentrations naturelles
L'uranium naturel se compose de trois isotopes principaux : l'uranium-238 (abondance naturelle de 99,28 %), l'uranium-235 (0,71 %) et l'uranium-234 (0,0054 %). Tous les trois sont radioactifs , émettant des particules alpha , à l'exception du fait que ces trois isotopes ont de faibles probabilités de subir une fission spontanée . Il existe également quatre autres isotopes traces : l'uranium 239, qui se forme lorsque 238 U subit une fission spontanée, libérant des neutrons qui sont capturés par un autre atome de 238 U ; l'uranium-237, qui se forme lorsque l' 238U capture un neutron mais en émet deux autres, qui se désintègre ensuite en neptunium-237 ; l'uranium-236 , présent en quantités infimes en raison de la capture de neutrons sur l' 235U et en tant que produit de désintégration du plutonium-244 ; et enfin, l'uranium-233, qui se forme dans la chaîne de désintégration du neptunium-237. On s'attend également à ce que le thorium-232 puisse subir une double désintégration bêta , ce qui produirait de l'uranium-232, mais cela n'a pas encore été observé expérimentalement. Le seul écart significatif par rapport au rapport U-235 à U-238 dans tous les échantillons naturels connus se produit à Oklo , au Gabon , où les réacteurs à fission nucléaire naturelle ont consommé une partie de l'U-235 il y a environ deux milliards d'années lorsque le rapport U-235 à U -238 était plus proche de celui de l'uranium faiblement enrichi permettant à l'eau ordinaire ("légère") d'agir comme un modérateur de neutrons semblable au processus dans les réacteurs à eau légère fabriqués par l'homme . L'existence de tels réacteurs à fission naturelle qui avaient été théoriquement prédits a été prouvée puisque de légers écarts de concentration en U-235 par rapport aux valeurs attendues ont été découverts lors de l'enrichissement d'uranium en France. Des enquêtes ultérieures pour exclure toute action humaine néfaste (comme le vol d'U-235) ont confirmé la théorie en trouvant des rapports isotopiques de produits de fission communs (ou plutôt leurs nucléides filles stables) conformes aux valeurs attendues pour la fission mais s'écartant des valeurs attendu pour les échantillons non issus de la fission de ces éléments.
L'uranium-238 est l'isotope le plus stable de l'uranium, avec une demi-vie d'environ 4,468 × 109 ans, à peu près l' âge de la Terre . L'uranium-235 a une demi-vie d'environ 7,13 × 108 ans, et l'uranium-234 a une demi-vie d'environ 2,48 × 105 ans. Environ 49 % des particules alpha de l'uranium naturel sont émises par 238 U, 49 % sont émises par 234 U (puisque ce dernier est formé à partir du premier), et environ 2 % par 235 U. Lorsque la Terre était jeune, probablement environ un -cinquième de son uranium était l'uranium-235, mais le pourcentage de 234 U était probablement beaucoup plus faible que cela.
L'uranium-238 est généralement un émetteur alpha (parfois, il subit une fission spontanée), se désintégrant à travers la série de l'uranium , qui compte 18 membres, en plomb-206 , par une variété de voies de désintégration différentes.
La chaîne de désintégration de 235 U, appelée la série de l'actinium , compte 15 membres et finit par se désintégrer en plomb-207. Les taux constants de décroissance dans ces séries de décroissance rendent la comparaison des rapports d' éléments parent à fille utile dans la datation radiométrique.
L'uranium-234, qui fait partie de la série de l'uranium (la chaîne de désintégration de l'uranium-238), se désintègre en plomb-206 à travers une série d'isotopes à durée de vie relativement courte.
L'uranium-233 est fabriqué à partir de thorium-232 par bombardement de neutrons, généralement dans un réacteur nucléaire, et l' 233U est également fissile. Sa chaîne de désintégration fait partie de la série du neptunium et se termine au bismuth-209 et au thallium -205.
L'uranium-235 est important à la fois pour les réacteurs nucléaires et les armes nucléaires , car c'est le seul isotope de l'uranium existant dans la nature sur Terre en quantité significative qui soit fissile. Cela signifie qu'il peut être scindé en deux ou trois fragments ( produits de fission ) par les neutrons thermiques.
L'uranium-238 n'est pas fissile, mais c'est un isotope fertile, car après activation neutronique , il peut être converti en plutonium-239, un autre isotope fissile. En effet, le noyau 238U peut absorber un neutron pour produire l'isotope radioactif uranium-239 . 239 U se désintègre par émission bêta en neptunium -239, également un émetteur bêta, qui se désintègre à son tour, en quelques jours, en plutonium-239. Le 239 Pu a été utilisé comme matière fissile dans la première bombe atomique qui a explosé lors du "test Trinity" le 15 juillet 1945 au Nouveau-Mexique .
Enrichissement

Dans la nature, l'uranium se trouve sous forme d'uranium-238 (99,2742 %) et d'uranium-235 (0,7204 %). La séparation isotopique concentre (enrichit) l'uranium 235 fissile pour les armes nucléaires et la plupart des centrales nucléaires, à l'exception des réacteurs refroidis au gaz et des réacteurs à eau lourde sous pression . La plupart des neutrons libérés par un atome d'uranium 235 en fission doivent avoir un impact sur d'autres atomes d'uranium 235 pour entretenir la réaction nucléaire en chaîne . La concentration et la quantité d'uranium 235 nécessaires pour y parvenir sont appelées « masse critique ».
Pour être considérée comme « enrichie », la fraction d'uranium 235 doit être comprise entre 3 % et 5 %. Ce processus produit d'énormes quantités d'uranium qui est appauvri en uranium 235 et avec une fraction proportionnellement accrue d'uranium 238, appelé uranium appauvri ou « UA ». Pour être considérée comme « appauvrie », la concentration en isotopes de l'uranium 235 ne doit pas dépasser 0,3 %. Le prix de l'uranium a augmenté depuis 2001, de sorte que les résidus d'enrichissement contenant plus de 0,35 % d'uranium 235 sont envisagés pour le réenrichissement, faisant passer le prix de l'hexafluorure d'uranium appauvri au-dessus de 130 dollars le kilogramme en juillet 2007 contre 5 dollars en 2001.
Le processus de centrifugation gazeuse , où l'hexafluorure d'uranium gazeux ( UF
6) est séparé par la différence de poids moléculaire entre 235 UF 6 et 238 UF 6 à l'aide de centrifugeuses à grande vitesse , est le procédé d'enrichissement le moins cher et le plus performant. Le processus de diffusion gazeuse avait été la principale méthode d'enrichissement et a été utilisé dans le projet Manhattan . Dans ce processus, l'hexafluorure d'uranium est diffusé à plusieurs reprises à travers une membrane argent - zinc , et les différents isotopes de l'uranium sont séparés par la vitesse de diffusion (puisque l'uranium-238 est plus lourd, il diffuse légèrement plus lentement que l'uranium-235). La méthode de séparation isotopique au laser moléculaire utilise un faisceau laser d'une énergie précise pour rompre la liaison entre l'uranium 235 et le fluor. Cela laisse l'uranium-238 lié au fluor et permet à l'uranium-235 métallique de précipiter de la solution. Une autre méthode d'enrichissement au laser est connue sous le nom de séparation isotopique par laser à vapeur atomique (AVLIS) et utilise des lasers accordables visibles tels que des lasers à colorant . Une autre méthode utilisée est la diffusion thermique liquide.
Exposition humaine
Une personne peut être exposée à l'uranium (ou à ses produits de filiation radioactifs , comme le radon ) en inhalant de la poussière dans l'air ou en ingérant de l'eau et des aliments contaminés. La quantité d'uranium dans l'air est généralement très faible ; cependant, les personnes qui travaillent dans des usines qui traitent des engrais phosphatés , vivent à proximité d'installations gouvernementales qui ont fabriqué ou testé des armes nucléaires, vivent ou travaillent à proximité d'un champ de bataille moderne où des armes à l'uranium appauvri ont été utilisées, ou vivent ou travaillent à proximité d'une centrale électrique au charbon, les installations qui extraient ou traitent du minerai d'uranium, ou enrichissent de l'uranium pour le combustible d'un réacteur, peuvent avoir une exposition accrue à l'uranium. Les maisons ou les structures qui se trouvent au-dessus de dépôts d'uranium (soit des dépôts de scories naturelles ou artificielles) peuvent avoir une incidence accrue d'exposition au gaz radon. L' Occupational Safety and Health Administration (OSHA) a fixé la limite d'exposition admissible à l'uranium sur le lieu de travail à 0,25 mg/m 3 sur une journée de travail de 8 heures. Le National Institute for Occupational Safety and Health (NIOSH) a établi une limite d'exposition recommandée (REL) de 0,2 mg/m 3 sur une journée de travail de 8 heures et une limite à court terme de 0,6 mg/m 3 . A des niveaux de 10 mg/m 3 , l'uranium est immédiatement dangereux pour la vie et la santé .
La plupart de l'uranium ingéré est excrété lors de la digestion . Seulement 0,5 % est absorbé lorsque des formes insolubles d'uranium, telles que son oxyde, sont ingérées, alors que l'absorption de l' ion uranyle plus soluble peut atteindre 5 %. Cependant, les composés d'uranium solubles ont tendance à traverser rapidement le corps, tandis que les composés d'uranium insolubles, en particulier lorsqu'ils sont inhalés sous forme de poussière dans les poumons , présentent un risque d'exposition plus grave. Après être entré dans la circulation sanguine, l'uranium absorbé a tendance à se bioaccumuler et à rester pendant de nombreuses années dans le tissu osseux en raison de l'affinité de l'uranium pour les phosphates. L'uranium n'est pas absorbé par la peau et les particules alpha libérées par l'uranium ne peuvent pas pénétrer la peau.
L'uranium incorporé devient des ions uranyle , qui s'accumulent dans les os, le foie, les reins et les tissus reproducteurs. L'uranium peut être décontaminé des surfaces en acier et des aquifères .
Effets et précautions
Le fonctionnement normal des reins , du cerveau , du foie , du cœur et d'autres systèmes peut être affecté par l'exposition à l'uranium, car, en plus d'être faiblement radioactif, l'uranium est un métal toxique . L'uranium est également un toxique pour la reproduction. Les effets radiologiques sont généralement locaux car le rayonnement alpha, la principale forme de désintégration de 238 U, a une très courte portée et ne pénètre pas la peau. Il a été démontré que le rayonnement alpha de l'uranium inhalé provoque le cancer du poumon chez les travailleurs du nucléaire exposés. Uranyle ( UO2+
2), comme ceux du trioxyde d'uranium ou du nitrate d'uranyle et d'autres composés d'uranium hexavalent, il a été démontré qu'ils provoquent des malformations congénitales et des dommages au système immunitaire chez les animaux de laboratoire. Alors que le CDC a publié une étude selon laquelle aucun cancer humain n'a été observé à la suite d'une exposition à l'uranium naturel ou appauvri, l'exposition à l'uranium et à ses produits de désintégration, en particulier le radon , est largement connue et constitue une menace importante pour la santé. L'exposition au strontium-90 , à l'iode-131 et à d'autres produits de fission n'est pas liée à l'exposition à l'uranium, mais peut résulter de procédures médicales ou d'une exposition au combustible usé d'un réacteur ou aux retombées d'armes nucléaires. Bien que l'exposition accidentelle par inhalation à une concentration élevée d' hexafluorure d'uranium ait entraîné des décès chez l'homme, ces décès ont été associés à la génération d'acide fluorhydrique et de fluorure d'uranyle hautement toxiques plutôt qu'à l'uranium lui-même. L'uranium métal finement divisé présente un risque d'incendie car l'uranium est pyrophorique ; les petits grains s'enflamment spontanément dans l'air à température ambiante.
L'uranium métal est généralement manipulé avec des gants par mesure de précaution suffisante. Le concentré d'uranium est manipulé et confiné de manière à ce que les personnes ne l'inhalent ni ne l'ingèrent.
| Système corporel | Études humaines | Études animales | In vitro |
|---|---|---|---|
| Rénal | Niveaux élevés d'excrétion de protéines, de catalase urinaire et de diurèse | Dommages aux tubules contournés proximaux, cellules nécrotiques moulées à partir de l'épithélium tubulaire, modifications glomérulaires ( insuffisance rénale ) | Pas d'études |
| Cerveau/SNC | Diminution des performances aux tests neurocognitifs | Toxicité cholinergique aiguë ; Accumulation dose-dépendante dans le cortex, le mésencéphale et le vermis ; Modifications électrophysiologiques de l'hippocampe | Pas d'études |
| ADN | Augmentation des signalements de cancers | Mutagénicité accrue (chez la souris) et induction de tumeurs | Cellules binucléées avec micronoyaux, Inhibition de la cinétique du cycle cellulaire et de la prolifération ; Induction des chromatides sœurs, phénotype tumorigène |
| Os/muscle | Pas d'études | Inhibition de la formation osseuse parodontale ; et cicatrisation alvéolaire | Pas d'études |
| Reproducteur | Les mineurs d'uranium ont plus de filles premières-nées | Atrophie tubulaire focale modérée à sévère ; vacuolisation des cellules de Leydig | Pas d'études |
| Poumons/respiratoire | Aucun effet néfaste sur la santé signalé | Congestion nasale sévère et hémorragie, lésions pulmonaires et fibrose, œdème et gonflement, cancer du poumon | Pas d'études |
| Gastro-intestinal | Vomissements, diarrhée, albuminurie | Pas d'études | Pas d'études |
| Foie | Aucun effet observé à la dose d'exposition | Foie gras, nécrose focale | Pas d'études |
| La peau | Aucune donnée d'évaluation de l'exposition disponible | Gonflement des cellules épidermiques vacuolées, dommages aux follicules pileux et aux glandes sébacées | Pas d'études |
| Tissus entourant les fragments d'UA intégrés | Concentrations élevées d'uranium dans l'urine | Concentrations urinaires élevées d'uranium, perturbations des tests biochimiques et neuropsychologiques | Pas d'études |
| Système immunitaire | Fatigue chronique, éruption cutanée, infections des oreilles et des yeux, perte de cheveux et de poids, toux. Peut être dû à une exposition chimique combinée plutôt qu'à l'uranium appauvri seul | Pas d'études | Pas d'études |
| Les yeux | Pas d'études | Conjonctivite, irritation, inflammation, œdème, ulcération des sacs conjonctivaux | Pas d'études |
| Sang | Pas d'études | Diminution du nombre de globules rouges et de la concentration d'hémoglobine | Pas d'études |
| Cardiovasculaire | Myocardite résultant de l'ingestion d'uranium, qui s'est terminée six mois après l'ingestion | Aucun effet | Pas d'études |
Voir également
- Résidus de K-65
- Liste des pays par production d'uranium
- Liste des pays par réserves d'uranium
- Liste des projets d'uranium
- Listes des catastrophes nucléaires et des incidents radioactifs
- Accidents et incidents nucléaires et radiologiques
- Ingénierie nucléaire
- Cycle du combustible nucléaire
- Physique nucléaire
- Cycle du combustible au thorium
- Audience mondiale sur l'uranium
Remarques
Les références
- Emsley, John (2001). "Uranium" . Les blocs de construction de la nature : un guide de A à Z sur les éléments . Oxford : Presse universitaire d'Oxford . pp. 476–482 . ISBN 978-0-19-850340-8.
- En ligneSeaborg, Glenn T. (1968). "Uranium". L'Encyclopédie des éléments chimiques . Skokie, Illinois : Reinhold Book Corporation. pp. 773–786. RCAC 68029938 .
Liens externes
- US EPA : Informations sur les rayonnements pour l'uranium
- « Qu'est-ce que l'uranium ? » de l'Association nucléaire mondiale
- Données et analyses sur le combustible nucléaire de l' Energy Information Administration des États-Unis
- Prix actuel du marché de l'uranium
- Cartes mondiales des gisements d'uranium
- Bibliographie annotée pour l'uranium de la bibliothèque numérique Alsos
- Banque de données sur les substances dangereuses de la NLM—Uranium, radioactif
- CDC - Guide de poche NIOSH sur les risques chimiques
- Extraction d'uranium à la mine Langer Heinrich en Namibie
- Actualité Nucléaire Mondiale
- Études de cas ATSDR en médecine environnementale : Toxicité de l'uranium US Department of Health and Human Services
- Uranium au tableau périodique des vidéos (Université de Nottingham)