Vinylogie - Vinylogy
La vinylogie est la transmission d' effets électroniques à travers un système de liaison organique conjuguée . Le concept a été introduit en 1926 par Ludwig Claisen pour expliquer les propriétés acides de la formylacétone et des cétoaldéhydes apparentés. Sa forme adjectivale, vinylogous , est utilisée pour décrire des groupes fonctionnels dans lesquels les fractions standard du groupe sont séparées par une double liaison carbone-carbone. Par exemple, un acide carboxylique avec une double liaison carbone-carbone (-HC = CH-, un fragment " vinyle "; en fait un groupe vinylène) entre un groupe carbonyle et un groupe hydroxyle est appelé acide carboxylique vinylogous .
En raison de la transmission d'informations électroniques par conjugaison, les groupes fonctionnels vinyliques possèdent souvent une réactivité ou des propriétés chimiques « analogues » par rapport au groupe fonctionnel parent. Par conséquent, la vinylogie est une heuristique utile pour la prédiction du comportement de systèmes qui sont structurellement similaires mais contiennent des liaisons C = C intermédiaires qui sont conjuguées aux groupes fonctionnels attachés. Par exemple, une propriété clé des acides carboxyliques est leur acidité Brønsted. L'acide carboxylique le plus simple, l'acide formique (HC (= O) –OH), est un acide organique moyennement fort avec un ap K a de 3,7. On s'attendrait à ce que les acides carboxyliques vinyliques aient une acidité similaire. En effet, le vinylog de l'acide formique, 2-formyl-1-éthén-1-ol, HC (= O) –CH = CH – OH a une acidité Brønsted importante, avec un p K a ~ 5–6 estimé . En particulier, les acides carboxyliques vinyliques sont des acides sensiblement plus forts que les énols typiques (p K a ~ 12). La vitamine C ( acide ascorbique , voir ci-dessous ) est un exemple biologiquement important d'un acide carboxylique vinylogous.
L'insertion d'un o- ou p -phénylène (c'est-à-dire un cycle benzénique dans l'orientation 1,2 ou 1,4) entraîne également certaines similitudes de réactivité (appelées «phénylogie»), bien que l'effet soit généralement plus faible, car la conjugaison à travers le cycle aryle nécessite la prise en compte des formes de résonance ou des intermédiaires dans lesquels l'aromaticité est interrompue.

Réactivité vinylogous
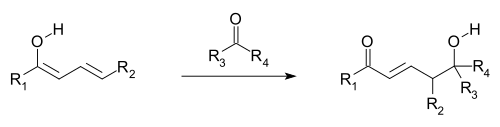
On pense que des réactions vinylogènes se produisent lorsque les orbitales des doubles liaisons du groupe vinyle et d'un groupe attracteur d'électrons attaché (EWG; les orbitales π) sont alignées et peuvent donc se chevaucher et se mélanger (c'est-à-dire sont conjuguées ). La délocalisation d' électrons permet à l'EWG de recevoir la densité électronique grâce à la participation du système conjugué. Les réactions vinylogènes comprennent également des additions conjuguées , où un nucléophile réagit à l'extrémité vinylique, ainsi qu'une variation vinylogous de la réaction aldolique , où un électrophile est attaqué par un énolate vinylogous nucléophile (voir la première image et la suivante). L'énolate de vinyle réagit à la position terminale du système de double liaison (le y-carbone), plutôt que le carbone a immédiatement adjacent au carbonyle, comme le ferait un simple énolate. Les électrophiles allyliques réagissent souvent par attaque vinylique d'un nucléophile plutôt que par addition directe.
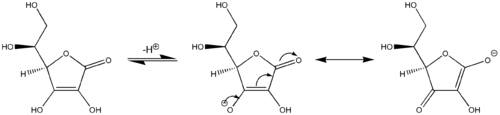
Un autre exemple de réactivité vinylogous: l'acide ascorbique (vitamine C) se comporte comme un acide carboxylique vinylogous par l'implication de son fragment carbonyle, un groupe vinyle dans le cycle et la paire isolée sur le groupe hydroxyle agissant comme le système conjugué . L'acidité du proton hydroxyle à l'extrémité du groupe vinyle dans l'acide ascorbique est plus comparable à un acide carboxylique typique qu'à un alcool car deux structures de résonance majeures stabilisent la charge négative sur la base conjuguée de l'acide ascorbique (structures centrale et droite dans la dernière image ), analogues aux deux structures de résonance qui stabilisent la charge négative sur l'anion résultant de l'élimination d'un proton d'un simple acide carboxylique (cf. première image). De manière analogue, les dérivés d' acide sorbique , prolongés par un autre groupement "vinyle", présentent également un comportement vinylogène.
Lectures complémentaires
- Lisboa, Marilda P .; Hoang, Tung T .; Dudley, Gregory B. (2011). "Addition Nucléophile Tandem / Fragmentation des Triflates Acyle Vinylogous: 2-Méthyl-2- (1-Oxo-5-Heptynyl) -1,3-Dithiane" . Synthèses organiques . 88 : 353. doi : 10.15227 / orgsyn.088.0353 .