Xylème - Xylem
Xylème est l' un des deux types de transport du tissu dans les plantes vasculaires , l'autre étant le phloème . La fonction de base du xylème est de transporter l' eau des racines aux tiges et aux feuilles, mais il transporte également les nutriments . Le mot « xylème » est dérivé du mot grec ξύλον ( xylon ), signifiant « bois » ; le tissu du xylème le plus connu est le bois , bien qu'on le trouve partout dans une plante. Le terme a été introduit par Carl Nägeli en 1858.
Structure
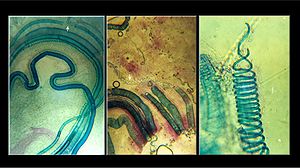
Les cellules du xylème les plus distinctives sont les longs éléments de la trachée qui transportent l'eau. Les trachéides et les éléments vasculaires se distinguent par leur forme ; les éléments des vaisseaux sont plus courts et sont reliés entre eux dans de longs tubes appelés vaisseaux .
Xylem contient également deux autres types cellulaires : le parenchyme et les fibres .
Xylem peut être trouvé :
- dans les faisceaux vasculaires , présents dans les plantes non ligneuses et les parties non ligneuses des plantes ligneuses
- dans le xylème secondaire, déposé par un méristème appelé cambium vasculaire chez les plantes ligneuses
- dans le cadre d'un arrangement stellaire non divisé en faisceaux, comme dans de nombreuses fougères .
Aux stades de transition des plantes à croissance secondaire , les deux premières catégories ne s'excluent pas mutuellement, bien qu'habituellement un faisceau vasculaire ne contienne que du xylème primaire .
Le motif de ramification présenté par le xylème suit la loi de Murray .
Xylème primaire et secondaire
Le xylème primaire est formé pendant la croissance primaire à partir du procambium . Il comprend le protoxylème et le métaxylème. Le métaxylème se développe après le protoxylème mais avant le xylème secondaire. Le métaxylème a des vaisseaux et des trachéides plus larges que le protoxylème.
Le xylème secondaire est formé pendant la croissance secondaire à partir du cambium vasculaire . Bien que le xylème secondaire se trouve également chez les membres des groupes gymnospermes Gnetophyta et Ginkgophyta et dans une moindre mesure chez les membres des Cycadophyta , les deux principaux groupes dans lesquels le xylème secondaire peut être trouvé sont :
- conifères ( Coniferae ) : il existe environ 600 espèces connues de conifères. Toutes les espèces ont un xylème secondaire, dont la structure est relativement uniforme dans tout ce groupe. De nombreux conifères deviennent de grands arbres : le xylème secondaire de ces arbres est utilisé et commercialisé comme résineux .
- les angiospermes ( Angiospermae ) : il existe environ 250 000 espèces connues d'angiospermes. Au sein de ce groupe, le xylème secondaire est rare chez les monocotylédones . De nombreux angiospermes non monocotylédones deviennent des arbres, et le xylème secondaire de ceux-ci est utilisé et commercialisé comme bois dur .
Fonction principale – transport d'eau vers le haut
Le xylème, les vaisseaux et les trachéides des racines, des tiges et des feuilles sont interconnectés pour former un système continu de canaux conducteurs d'eau atteignant toutes les parties des plantes. Le système transporte l'eau et les nutriments minéraux solubles des racines dans toute la plante. Il est également utilisé pour remplacer l'eau perdue lors de la transpiration et de la photosynthèse. La sève du xylème se compose principalement d'eau et d'ions inorganiques, bien qu'elle puisse également contenir un certain nombre de produits chimiques organiques. Le transport est passif, non alimenté par l'énergie dépensée par les éléments de la trachée eux-mêmes, qui sont morts à maturité et n'ont plus de contenu vivant. Le transport de la sève vers le haut devient plus difficile à mesure que la hauteur d'une plante augmente et le transport vers le haut de l'eau par le xylème est considéré comme limitant la hauteur maximale des arbres. Trois phénomènes font couler la sève du xylème :
- Hypothèse du flux de pression : les sucres produits dans les feuilles et autres tissus verts sont conservés dans le système du phloème, créant unedifférence de pression du soluté par rapport au système du xylème transportant une charge beaucoup plus faible de solutés - eau et minéraux. La pression du phloème peut atteindre plusieurs MPa, bien au-dessus de la pression atmosphérique. L'interconnexion sélective entre ces systèmes permet à cette concentration élevée de soluté dans le phloème d'attirer le fluide du xylème vers le haut par pression négative.
- Transpiration traction :même, l' évaporation de l' eau à partir des surfaces de mésophylle cellules à l'atmosphère crée également une dépression dans lasupérieure d'une plante. Cela provoque la formation de millions de minuscules ménisques dans la paroi cellulaire du mésophylle. La tension superficielle qui en résulteprovoque une pression négative ou une tension dans le xylème qui tire l'eau des racines et du sol.
- Pression racinaire : Si le potentiel hydrique des cellules racinaires est plus négatif que celui du sol , généralement en raison de fortes concentrations de soluté , l'eau peut se déplacer par osmose dans la racine depuis le sol. Cela provoque une pression positive qui force la sève du xylème vers les feuilles. Dans certaines circonstances, la sève sera forcée de la feuille à travers une hydathode dans un phénomène connu sous le nom de guttation . La pression racinaire est la plus élevée le matin avant que les stomates ne s'ouvrent et permettent à la transpiration de commencer. Différentes espèces végétales peuvent avoir des pressions racinaires différentes même dans un environnement similaire ; les exemples incluent jusqu'à 145 kPa dans Vitis riparia mais autour de zéro dans Celastrus orbiculatus .
La force principale qui crée le mouvement d' action capillaire de l'eau vers le haut dans les plantes est l'adhérence entre l'eau et la surface des conduits du xylème. L'action capillaire fournit la force qui établit une configuration d'équilibre, équilibrant la gravité. Lorsque la transpiration élimine l'eau en haut, le débit est nécessaire pour revenir à l'équilibre.
L'attraction transpirationnelle résulte de l'évaporation de l'eau à la surface des cellules des feuilles . Cette évaporation fait que la surface de l'eau s'enfonce dans les pores de la paroi cellulaire . Par capillarité , l'eau forme des ménisques concaves à l'intérieur des pores. La tension superficielle élevée de l'eau tire la concavité vers l'extérieur, générant suffisamment de force pour soulever l'eau jusqu'à une centaine de mètres du niveau du sol aux branches les plus hautes d'un arbre .
La traction transpiration nécessite que les vaisseaux transportant l'eau soient de très petit diamètre; sinon, la cavitation briserait la colonne d'eau. Et à mesure que l'eau s'évapore des feuilles, davantage d' eau est aspirée à travers la plante pour la remplacer. Lorsque la pression de l'eau dans le xylème atteint des niveaux extrêmes en raison d'un faible apport d'eau des racines (si, par exemple, le sol est sec), les gaz sortent de la solution et forment une bulle - une embolie se forme, qui se propagera rapidement à d'autres cellules adjacentes, à moins que des fosses bordées ne soient présentes (celles-ci ont une structure en forme de bouchon appelée tore, qui ferme l'ouverture entre les cellules adjacentes et empêche l'embolie de se propager). Même après une embolie, les plantes sont capables de remplir le xylème et de restaurer la fonctionnalité.
Théorie de la cohésion-tension
La théorie de la cohésion-tension est une théorie de l' attraction intermoléculaire qui explique le processus d' écoulement de l' eau vers le haut (contre la force de gravité ) à travers le xylème des plantes . Il a été proposé en 1894 par John Joly et Henry Horatio Dixon . Malgré de nombreuses objections, c'est la théorie la plus largement acceptée pour le transport de l'eau à travers le système vasculaire d'une plante basée sur les recherches classiques de Dixon-Joly (1894), Eugen Askenasy (1845-1903) (1895) et Dixon (1914, 1924).
L'eau est une molécule polaire . Lorsque deux molécules d'eau se rapprochent, l' atome d' oxygène légèrement chargé négativement de l'une forme une liaison hydrogène avec un atome d' hydrogène légèrement chargé positivement dans l'autre. Cette force d'attraction, avec d'autres forces intermoléculaires , est l'un des principaux facteurs responsables de l'apparition de la tension superficielle dans l'eau liquide. Il permet également aux plantes de puiser l'eau de la racine à travers le xylème jusqu'à la feuille.
L'eau est constamment perdue par la transpiration de la feuille. Lorsqu'une molécule d'eau est perdue, une autre est entraînée par les processus de cohésion et de tension. L'attraction de la transpiration, utilisant l'action capillaire et la tension superficielle inhérente de l'eau, est le mécanisme principal du mouvement de l'eau chez les plantes. Cependant, ce n'est pas le seul mécanisme impliqué. Toute utilisation d'eau dans les feuilles force l'eau à pénétrer dans celles-ci.
La transpiration dans les feuilles crée une tension (pression différentielle) dans les parois cellulaires des cellules du mésophylle . En raison de cette tension, l'eau est extraite des racines vers les feuilles, aidée par la cohésion (l'attraction entre les molécules d'eau individuelles, en raison des liaisons hydrogène ) et l' adhésion (l'adhérence entre les molécules d'eau et les parois cellulaires hydrophiles des plantes). Ce mécanisme d'écoulement de l'eau fonctionne en raison du potentiel de l' eau (l'eau s'écoule du haut vers le bas potentiel) et des règles de diffusion simple .
Au cours du siècle dernier, de nombreuses recherches ont été menées sur le mécanisme de transport de la sève du xylème ; aujourd'hui, la plupart des scientifiques des plantes continuent de convenir que la théorie de la cohésion-tension explique le mieux ce processus, mais des théories multiforces qui émettent l'hypothèse de plusieurs mécanismes alternatifs ont été suggérées, y compris les gradients de pression osmotiques cellulaires et xylèmes longitudinaux , les gradients de potentiel axiaux dans les vaisseaux et gel- et les gradients interfaciaux soutenus par des bulles de gaz.
Mesure de la pression

Jusqu'à récemment, la pression différentielle (aspiration) de la traction transpirationnelle ne pouvait être mesurée qu'indirectement, en appliquant une pression externe avec une bombe à pression pour la contrer. Lorsque la technologie permettant d'effectuer des mesures directes avec une sonde de pression a été développée, il y avait initialement un doute quant à savoir si la théorie classique était correcte, car certains travailleurs étaient incapables de démontrer des pressions négatives. Des mesures plus récentes tendent à valider la théorie classique, pour la plupart. Le transport du xylème est entraîné par une combinaison d'attraction transpirationnelle d'en haut et de pression de racine d'en bas, ce qui rend l'interprétation des mesures plus compliquée.
Évolution
Xylem est apparu tôt dans l'histoire de la vie végétale terrestre. Des plantes fossiles au xylème anatomiquement préservé sont connues depuis le Silurien (il y a plus de 400 millions d'années), et des traces de fossiles ressemblant à des cellules de xylème individuelles peuvent être trouvées dans les roches de l' Ordovicien antérieur . Le premier xylème vrai et reconnaissable se compose de trachéides avec une couche de renforcement hélicoïdale-annulaire ajoutée à la paroi cellulaire . C'est le seul type de xylème trouvé dans les premières plantes vasculaires, et ce type de cellule continue d'être trouvé dans le protoxylème (xylème formé en premier) de tous les groupes vivants de plantes vasculaires. Plusieurs groupes de plantes plus tard développés dénoyautées cellules tracheid indépendamment par l' évolution convergente . Chez les plantes vivantes, les trachéides dénoyautées n'apparaissent en développement qu'à la maturation du métaxylème (suivant le protoxylème ).
Dans la plupart des plantes, les trachéides piquées fonctionnent comme les cellules de transport primaires. L'autre type d'élément vasculaire, trouvé dans les angiospermes, est l' élément vasculaire . Les éléments de récipient sont joints bout à bout pour former des récipients dans lesquels l'eau s'écoule sans entrave, comme dans un tuyau. La présence de vaisseaux du xylème (également appelés trachées ) est considérée comme l'une des innovations clés qui ont conduit au succès des angiospermes . Cependant, la présence d'éléments vasculaires n'est pas limitée aux angiospermes, et ils sont absents dans certaines lignées archaïques ou "basales" des angiospermes : (par exemple, Amborellaceae , Tetracentraceae , Trochodendraceae et Winteraceae ), et leur xylème secondaire est décrit par Arthur Cronquist comme "primitivement sans vaisseau". Cronquist considérait les vaisseaux de Gnetum comme convergents avec ceux des angiospermes. Que l'absence de vaisseaux dans les angiospermes basales soit une condition primitive est contestée, l'hypothèse alternative stipule que les éléments des vaisseaux proviennent d'un précurseur des angiospermes et ont ensuite été perdus.
Pour effectuer la photosynthèse, les plantes doivent absorber du CO
2de l'atmosphère. Cependant, cela a un prix : alors que les stomates sont ouverts pour permettre au CO
2pour entrer, l'eau peut s'évaporer. L'eau se perd beaucoup plus vite que le CO
2est absorbée, les plantes doivent donc la remplacer et ont développé des systèmes pour transporter l'eau du sol humide vers le site de la photosynthèse. Les premières plantes aspiraient l'eau entre les parois de leurs cellules, puis ont développé la capacité de contrôler la perte d'eau (et le CO
2acquisition) grâce à l'utilisation des stomates. Des tissus spécialisés de transport d'eau ont rapidement évolué sous forme d'hydroïdes, de trachéides, puis de xylème secondaire, suivis d'un endoderme et finalement de vaisseaux.
Le CO élevé
2Les niveaux de l'époque silurienne-dévonienne, lorsque les plantes colonisaient la terre pour la première fois, signifiaient que le besoin en eau était relativement faible. En tant que CO
2a été retiré de l'atmosphère par les plantes, plus d'eau a été perdue dans sa capture et des mécanismes de transport plus élégants ont évolué. À mesure que les mécanismes de transport de l'eau et les cuticules imperméables évoluaient, les plantes pouvaient survivre sans être continuellement recouvertes d'un film d'eau. Ce passage de la poïkilohydrie à l' homohydrie a ouvert un nouveau potentiel de colonisation. Les plantes avaient alors besoin d'une structure interne robuste qui contenait de longs canaux étroits pour transporter l'eau du sol vers toutes les différentes parties de la plante au-dessus du sol, en particulier vers les parties où la photosynthèse s'est produite.
Au Silurien, CO
2était facilement disponible, il fallait donc peu d'eau pour l'acquérir. À la fin du Carbonifère, lorsque le CO
2les niveaux avaient baissé à quelque chose d'approchant d'aujourd'hui, environ 17 fois plus d'eau a été perdue par unité de CO
2prise. Cependant, même en ces premiers jours « faciles », l'eau était rare et devait être transportée vers certaines parties de la plante depuis le sol humide pour éviter la dessiccation . Ce transport précoce de l'eau a profité du mécanisme de cohésion-tension inhérent à l'eau. L'eau a tendance à se diffuser vers les zones plus sèches, et ce processus est accéléré lorsque l'eau peut être évacuée le long d'un tissu avec de petits espaces. Dans les petits passages, comme celui entre les parois cellulaires végétales (ou dans les trachéides), une colonne d'eau se comporte comme du caoutchouc - lorsque les molécules s'évaporent d'une extrémité, elles tirent les molécules derrière elles le long des canaux. Par conséquent, la transpiration à elle seule a fourni la force motrice du transport de l'eau dans les premières plantes. Cependant, sans récipients de transport dédiés, le mécanisme de cohésion-tension ne peut pas transporter l'eau à plus de 2 cm environ, ce qui limite fortement la taille des premières plantes. Ce processus exige un approvisionnement régulier en eau d'un côté, pour maintenir les chaînes ; pour éviter de l'épuiser, les plantes ont développé une cuticule imperméable . Les premières cuticules n'avaient peut-être pas de pores mais ne couvraient pas toute la surface de la plante, de sorte que les échanges gazeux pouvaient se poursuivre. Cependant, la déshydratation était parfois inévitable; les premières plantes font face à cela en stockant beaucoup d'eau entre leurs parois cellulaires, et quand il s'agit de survivre aux temps difficiles en mettant la vie "en attente" jusqu'à ce que plus d'eau soit fournie.

Pour s'affranchir des contraintes de petite taille et d'humidité constante que le système de transport parenchymatique infligeait, les plantes avaient besoin d'un système de transport d'eau plus efficace. Au début du Silurien , ils développèrent des cellules spécialisées, qui étaient lignifiées (ou portaient des composés chimiques similaires) pour éviter l'implosion ; ce processus coïncidait avec la mort cellulaire, permettant à leurs entrailles de se vider et à l'eau de les traverser. Ces cellules vides, mortes et plus larges étaient un million de fois plus conductrices que la méthode intercellulaire, offrant un potentiel de transport sur de plus longues distances et un CO plus élevé.
2 taux de diffusion.
Les premiers macrofossiles à porter des tubes de transport d'eau sont des plantes siluriennes du genre Cooksonia . Les prétrachéophytes du Dévonien inférieur Aglaophyton et Horneophyton ont des structures très similaires aux hydroïdes des mousses modernes. Les plantes ont continué à innover de nouvelles façons de réduire la résistance à l'écoulement dans leurs cellules, augmentant ainsi l'efficacité de leur transport d'eau. Les bandes sur les parois des tubes, en fait apparentes dès le début du Silurien, sont une improvisation précoce pour faciliter l'écoulement de l'eau. Les tubes bagués, ainsi que les tubes avec ornementation piquée sur leurs parois, ont été lignifiés et, lorsqu'ils forment des conduits unicellulaires, sont considérés comme des trachéides . Ceux-ci, la « nouvelle génération » de conception de cellules de transport, ont une structure plus rigide que les hydroïdes, ce qui leur permet de faire face à des niveaux de pression d'eau plus élevés. Les trachéides peuvent avoir une origine évolutive unique, peut-être au sein des hornworts, unissant tous les trachéophytes (mais ils peuvent avoir évolué plus d'une fois).
Le transport de l'eau nécessite une régulation et le contrôle dynamique est assuré par les stomates . En ajustant la quantité d'échange gazeux, ils peuvent limiter la quantité d'eau perdue par la transpiration. C'est un rôle important lorsque l'approvisionnement en eau n'est pas constant, et en effet les stomates semblent avoir évolué avant les trachéides, étant présents dans les hornworts non vasculaires.
Un endoderme a probablement évolué au cours du Silu-Dévonien, mais la première preuve fossile d'une telle structure est carbonifère. Cette structure dans les racines recouvre le tissu de transport d'eau et régule l'échange d'ions (et empêche les agents pathogènes indésirables, etc. d'entrer dans le système de transport d'eau). L'endoderme peut également fournir une pression vers le haut, forçant l'eau à sortir des racines lorsque la transpiration n'est pas un moteur suffisant.
Une fois que les plantes ont développé ce niveau de transport d'eau contrôlé, elles étaient vraiment homoiohydriques, capables d'extraire l'eau de leur environnement par le biais d'organes ressemblant à des racines plutôt que de dépendre d'un film d'humidité de surface, leur permettant de croître jusqu'à une taille beaucoup plus grande. En raison de leur indépendance vis-à-vis de leur environnement, ils ont perdu leur capacité à survivre à la dessiccation - un trait coûteux à conserver.
Au Dévonien, le diamètre maximum du xylème a augmenté avec le temps, le diamètre minimum restant assez constant. Au Dévonien moyen, le diamètre des trachéides de certaines lignées végétales ( Zosterophyllophytes ) avait atteint un plateau. Des trachéides plus larges permettent à l'eau d'être transportée plus rapidement, mais le taux de transport global dépend également de la section transversale globale du faisceau de xylème lui-même. L'augmentation de l'épaisseur du faisceau vasculaire semble en outre être en corrélation avec la largeur des axes des plantes et la hauteur des plantes ; elle est également étroitement liée à l'apparition des feuilles et à l'augmentation de la densité stomatique, qui toutes deux augmenteraient la demande en eau.
Alors que des trachéides plus larges avec des parois robustes permettent d'atteindre des pressions de transport d'eau plus élevées, cela augmente le problème de cavitation. La cavitation se produit lorsqu'une bulle d'air se forme à l'intérieur d'un récipient, brisant les liaisons entre les chaînes de molécules d'eau et les empêchant de tirer plus d'eau avec leur tension de cohésion. Une trachéide, une fois cavitaire, ne peut pas retirer son embolie et reprendre du service (sauf chez quelques angiospermes avancés qui ont développé un mécanisme pour le faire). Par conséquent, il vaut mieux que les plantes évitent la cavitation. Pour cette raison, les fosses dans les parois trachéides ont de très petits diamètres, pour empêcher l'air d'entrer et permettre aux bulles de nucléer. Les cycles de gel-dégel sont une cause majeure de cavitation. Les dommages à la paroi d'une trachéide entraînent presque inévitablement des fuites d'air et de la cavitation, d'où l'importance de travailler en parallèle de nombreuses trachéides.
La cavitation est difficile à éviter, mais une fois qu'elle s'est produite, les plantes disposent d'une gamme de mécanismes pour contenir les dommages. De petites fosses relient les conduits adjacents pour permettre au fluide de s'écouler entre eux, mais pas à l'air - bien qu'ironiquement, ces fosses, qui empêchent la propagation des embolies, en soient également une cause majeure. Ces surfaces piquées réduisent encore le débit d'eau à travers le xylème jusqu'à 30 %. Les conifères, dès le Jurassique, ont développé une amélioration ingénieuse, utilisant des structures en forme de valve pour isoler les éléments cavitaires. Ces structures torus-margo ont une goutte flottant au milieu d'un beignet ; lorsqu'un côté se dépressurise, la goutte est aspirée dans le tore et bloque l'écoulement ultérieur. D'autres plantes acceptent simplement la cavitation ; par exemple, les chênes forment un anneau de larges vaisseaux au début de chaque printemps, dont aucun ne survit aux gelées hivernales. Les érables utilisent la pression des racines chaque printemps pour forcer la sève vers le haut à partir des racines, en éliminant les bulles d'air.
La croissance en hauteur utilisait également un autre trait des trachéides - le support offert par leurs parois lignifiées. Les trachéides défuntes ont été retenues pour former une tige solide et ligneuse, produite dans la plupart des cas par un xylème secondaire. Cependant, chez les premières plantes, les trachéides étaient trop vulnérables mécaniquement et conservaient une position centrale, avec une couche de sclérenchyme dur sur le bord extérieur des tiges. Même lorsque les trachéides jouent un rôle structurel, elles sont soutenues par du tissu sclérenchymatique.
Les trachéides se terminent par des murs qui imposent une grande résistance à l'écoulement ; les éléments du récipient ont des parois d'extrémité perforées et sont disposés en série pour fonctionner comme s'ils étaient un seul récipient continu. La fonction des parois d'extrémité, qui étaient l'état par défaut au Dévonien, était probablement d'éviter les embolies . Une embolie est l'endroit où une bulle d'air est créée dans une trachéide. Cela peut se produire en raison du gel ou de la dissolution des gaz de la solution. Une fois qu'une embolie est formée, elle ne peut généralement pas être retirée (mais voir plus tard); la cellule affectée ne peut pas tirer l'eau vers le haut et est rendue inutile.
Murs d'extrémité exclus, les trachéides des plantes prévasculaires ont pu opérer sous la même conductivité hydraulique que celles de la première plante vasculaire, Cooksonia .
La taille des trachéides est limitée car elles ne comportent qu'une seule cellule ; ceci limite leur longueur, qui à son tour limite leur diamètre utile maximum à 80 µm. La conductivité augmente avec la quatrième puissance du diamètre, donc un diamètre accru a d'énormes récompenses ; les éléments de récipient , constitués d'un certain nombre d'alvéoles réunies à leurs extrémités, ont dépassé cette limite et ont permis la formation de tubes plus gros, atteignant des diamètres allant jusqu'à 500 m et des longueurs allant jusqu'à 10 m.
Les navires ont évolué pour la première fois pendant la période sèche et faible en CO
2périodes de la fin du Permien, dans les prêles, les fougères et les Selaginellales indépendamment, et est apparu plus tard au milieu du Crétacé chez les angiospermes et les gnetophytes. Les navires permettent à la même surface transversale de bois de transporter environ cent fois plus d'eau que les trachéides ! Cela a permis aux plantes de remplir davantage leurs tiges de fibres structurelles et a également ouvert une nouvelle niche aux vignes , qui pouvaient transporter de l'eau sans être aussi épaisses que l'arbre sur lequel elles poussaient. Malgré ces avantages, le bois à base de trachéides est beaucoup plus léger, donc moins cher à fabriquer, car les vaisseaux doivent être beaucoup plus renforcés pour éviter la cavitation.
Développement
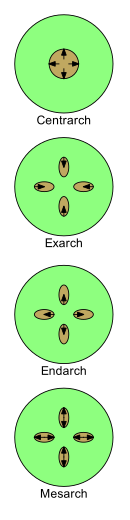
Le développement de Xylem peut être décrit par quatre termes : centrarch, exarch, endarch et mesarch . Au fur et à mesure qu'il se développe chez les jeunes plantes, sa nature change du protoxylème au métaxylème (c'est-à-dire du premier xylème à l' après xylème ). Les modèles dans lesquels le protoxylème et le métaxylème sont disposés sont importants dans l'étude de la morphologie des plantes.
Protoxylème et métaxylème
Lorsqu'une jeune plante vasculaire grandit, un ou plusieurs brins de xylème primaire se forment dans ses tiges et ses racines. Le premier xylème à se développer est appelé « protoxylème ». En apparence, le protoxylème se distingue généralement par des vaisseaux plus étroits formés de cellules plus petites. Certaines de ces cellules ont des parois qui contiennent des épaississements en forme d'anneaux ou d'hélices. Fonctionnellement, le protoxylème peut s'étendre : les cellules sont capables de grossir et de se développer pendant l'allongement d'une tige ou d'une racine. Plus tard, le « métaxylème » se développe dans les brins du xylème. Les vaisseaux et les cellules du métaxylème sont généralement plus gros ; les alvéoles ont des épaississements qui se présentent généralement sous la forme de barres transversales en forme d'échelle (scalariformes) ou de feuilles continues à l'exception des trous ou des piqûres (piqûres). Fonctionnellement, le métaxylème achève son développement après la fin de l'allongement lorsque les cellules n'ont plus besoin de grossir.
Modèles de protoxylème et de métaxylème
Il existe quatre modèles principaux pour l'arrangement du protoxylème et du métaxylème dans les tiges et les racines.
- Centrarch fait référence au cas dans lequel le xylème primaire forme un seul cylindre au centre de la tige et se développe du centre vers l'extérieur. Le protoxylème se trouve ainsi dans le noyau central et le métaxylème dans un cylindre qui l'entoure. Ce modèle était courant chez les premières plantes terrestres, telles que les " rhyniophytes ", mais n'est présent dans aucune plante vivante.
Les trois autres termes sont utilisés lorsqu'il y a plus d'un brin de xylème primaire.
- L'exarque est utilisé lorsqu'il y a plus d'un brin de xylème primaire dans une tige ou une racine et que le xylème se développe de l'extérieur vers le centre, c'est-à-dire de manière centripète. Le métaxylème est ainsi le plus proche du centre de la tige ou de la racine et le protoxylème le plus proche de la périphérie. Les racines des plantes vasculaires sont normalement considérées comme ayant un développement d'exarque.
- Endarch est utilisé lorsqu'il y a plus d'un brin de xylème primaire dans une tige ou une racine et que le xylème se développe de l'intérieur vers l'extérieur vers la périphérie, c'est-à-dire par centrifugation. Le protoxylème est ainsi le plus proche du centre de la tige ou de la racine et le métaxylème le plus proche de la périphérie. Les tiges des plantes à graines ont généralement un développement en endarque.
- Mesarch est utilisé lorsqu'il y a plus d'un brin de xylème primaire dans une tige ou une racine et que le xylème se développe à partir du milieu d'un brin dans les deux sens. Le métaxylème est donc à la fois sur les côtés périphérique et central du brin avec le protoxylème entre le métaxylème (éventuellement entouré par celui-ci). Les feuilles et les tiges de nombreuses fougères ont un développement en mésarque.
Histoire
Dans son livre De plantis libri XVI (Sur les plantes, en 16 livres) (1583), le médecin et botaniste italien Andrea Cesalpino a proposé que les plantes tirent l'eau du sol non par magnétisme ( ut magnes ferrum trahit , comme le fer magnétique attire) ni par aspiration ( vide ), mais par absorption, comme cela se produit dans le cas du linge, des éponges ou des poudres. Le biologiste italien Marcello Malpighi a été le premier à décrire et à illustrer les vaisseaux du xylème, ce qu'il a fait dans son livre Anatome plantarum ... (1675). Bien que Malpighi croyait que le xylème ne contenait que de l'air, le médecin et botaniste britannique Nehemiah Grew , qui était son contemporain, croyait que la sève montait à la fois à travers l'écorce et à travers le xylème. Cependant, selon Grew, l'action capillaire dans le xylème n'augmenterait la sève que de quelques centimètres ; afin d'élever la sève au sommet d'un arbre, Grew a proposé que les cellules parenchymateuses deviennent turgescentes et ainsi non seulement pressent la sève dans les trachéides, mais forcent un peu de sève du parenchyme dans les trachéides. En 1727, l'ecclésiastique et botaniste anglais Stephen Hales montra que la transpiration des feuilles d'une plante fait circuler l'eau dans son xylème. En 1891, le botaniste germano-polonais Eduard Strasburger avait montré que le transport de l'eau dans les plantes ne nécessitait pas que les cellules du xylème soient vivantes.
Voir également
- Phloème
- Continuum de l'atmosphère des plantes du sol
- Stèle
- Succion
- Tylose
- Faisceau vasculaire
- Tissu vasculaire
- Sève de xylème
Notes d'explication
Les références
Citations
Références générales
- C. Wei ; E. Steudle ; MT Tyree; PM Lintilhac (mai 2001). "L'essentiel de la mesure directe de la pression du xylème" . Plante, Cellule et Environnement . 24 (5) : 549-555. doi : 10.1046/j.1365-3040.2001.00697.x . S2CID 5039439 . est la principale source utilisée pour le paragraphe sur les recherches récentes.
- N. Michele Holbrook; Michael J. Burns ; Christopher B. Field (novembre 1995). « Pressions négatives du xylème dans les plantes : un test de la technique de pression d'équilibrage ». Sciences . 270 (5239) : 1193–4. Bibcode : 1995Sci ... 270.1193H . doi : 10.1126/science.270.5239.1193 . S2CID 97217181 . est le premier test indépendant publié montrant que la bombe Scholander mesure réellement la tension dans le xylème.
- Pockman, WT ; JS Sperry ; JW O'Leary (décembre 1995). « Pression d'eau négative soutenue et significative dans le xylème ». Nature . 378 (6558) : 715-6. Code Bib : 1995Natur.378..715P . doi : 10.1038/378715a0 . S2CID 31357329 . est le deuxième test indépendant publié montrant que la bombe Scholander mesure réellement la tension dans le xylème.
- Campbell, Neil A.; Jane B. Reece (2002). Biologie (6e éd.). Benjamin Cummings. ISBN 978-0-8053-6624-2.
- Kenrick, Paul; Grue, Peter R. (1997). L'origine et la diversification précoce des plantes terrestres : une étude cladistique . Washington, DC : Smithsonian Institution Press. ISBN 978-1-56098-730-7.
- Mohammed, AF; R. Sattler (1982). "Structure des vaisseaux de Gnetum et l'origine des angiospermes". Journal américain de botanique . 69 (6) : 1004–21. doi : 10.2307/2442898 . JSTOR 2442898 .
- Melvin T. Tyree ; Martin H. Zimmermann (2003). Structure Xylem et l'Ascension de Sap (2e éd.). Springer. ISBN 978-3-540-43354-5. mise à jour récente du livre classique sur le transport du xylème par feu Martin Zimmermann
Liens externes
-
 Médias liés à Xylem sur Wikimedia Commons
Médias liés à Xylem sur Wikimedia Commons