Culture cellulaire 3D - 3D cell culture
Une culture cellulaire 3D est un environnement créé artificiellement dans lequel les cellules biologiques sont autorisées à se développer ou à interagir avec leur environnement dans les trois dimensions. Contrairement aux environnements 2D (par exemple une boîte de Pétri ), une culture cellulaire 3D permet aux cellules in vitro de se développer dans toutes les directions, de la même manière qu'elles le feraient in vivo . Ces cultures tridimensionnelles sont généralement cultivées dans des bioréacteurs, de petites capsules dans lesquelles les cellules peuvent se développer en sphéroïdes ou des colonies de cellules 3D. Environ 300 sphéroïdes sont généralement cultivés par bioréacteur.
Fond
Les cultures cellulaires 3D sont utilisées dans la recherche depuis plusieurs décennies. L'une des premières approches enregistrées pour leur développement a eu lieu au début du 20e siècle, avec les efforts d' Alexis Carrel pour développer des méthodes de cultures tissulaires in vitro prolongées. Les premières études dans les années 80, dirigées par Mina Bissell du Lawrence Berkeley National Laboratory , ont souligné l'importance des techniques 3D pour créer des modèles de culture in vitro précis. Ce travail s'est concentré sur l'importance de la matrice extracellulaire et la capacité des cultures dans des matrices 3D artificielles à produire des structures multicellulaires physiologiquement pertinentes, telles que des structures acineuses dans des modèles de tissus mammaires sains et cancéreux. Ces techniques ont été appliquées à des modèles de maladie in vitro utilisés pour évaluer les réponses cellulaires à des composés pharmaceutiques.
Eric Simon, dans un rapport de subvention NIH SBIR de 1988, a montré que l' électrofilage pouvait être utilisé pour produire des tapis fibreux en polystyrène et en polycarbonate à l'échelle nanométrique et submicronique (maintenant connus sous le nom d'échafaudages) spécifiquement destinés à être utilisés comme substrats cellulaires in vitro. Cette utilisation précoce de réseaux fibreux électrofilés pour la culture cellulaire et l'ingénierie tissulaire a montré que divers types de cellules, notamment les fibroblastes du prépuce humain (HFF), le carcinome humain transformé (HEp-2) et l'épithélium pulmonaire du vison (MLE) adhèrent et prolifèrent sur les fibres. . Il a été noté que contrairement à la morphologie aplatie typiquement observée dans la culture 2D, les cellules cultivées sur les fibres électrofilées présentaient une morphologie tridimensionnelle arrondie plus histotypique généralement observée in vivo.
Propriétés
Dans les tissus vivants, les cellules existent dans des microenvironnements 3D avec des interactions complexes cellule-cellule et cellule-matrice et une dynamique de transport complexe pour les nutriments et les cellules. Les cultures cellulaires 2D standard, ou monocouches, sont des représentations inadéquates de cet environnement, ce qui en fait souvent des prédicteurs peu fiables de l'efficacité et de la toxicité des médicaments in vivo . Les sphéroïdes 3D ressemblent davantage aux tissus in vivo en termes de communication cellulaire et de développement de matrices extracellulaires . Ces matrices aident les cellules à se déplacer dans leur sphéroïde de la même manière que les cellules se déplaceraient dans les tissus vivants. Les sphéroïdes sont ainsi des modèles améliorés pour la migration cellulaire , la différenciation , la survie et la croissance. De plus, les cultures cellulaires 3D fournissent une représentation plus précise de la polarisation cellulaire, car en 2D, les cellules ne peuvent être que partiellement polarisées. De plus, les cellules cultivées en 3D présentent une expression génique différente de celles cultivées en 2D.
La troisième dimension de la croissance cellulaire fournit plus d'espace de contact pour les entrées mécaniques et pour l'adhésion cellulaire , ce qui est nécessaire pour la ligature des intégrines , la contraction cellulaire et même la signalisation intracellulaire. La diffusion normale du soluté et la liaison aux protéines effectrices (comme les facteurs de croissance et les enzymes ) dépendent également de la matrice cellulaire 3D, il est donc essentiel pour l'établissement de gradients de concentration de soluté à l'échelle tissulaire
Aux fins du dépistage toxicologique des médicaments , il est beaucoup plus utile de tester l'expression génique de cellules in vitro cultivées en 3D qu'en 2D, car l'expression génique des sphéroïdes 3D ressemblera davantage à l'expression génique in vivo. Enfin, les cultures cellulaires 3D ont une plus grande stabilité et des durées de vie plus longues que les cultures cellulaires en 2D. Cela signifie qu'ils sont plus adaptés aux études à long terme et à la démonstration des effets à long terme du médicament. Les environnements 3D permettent également aux cellules de se développer sans être dérangées. En 2D, les cellules doivent subir une trypsinisation régulière pour leur fournir suffisamment de nutriments pour une croissance cellulaire normale. Les sphéroïdes 3D ont été cultivés en laboratoire jusqu'à 302 jours tout en maintenant une croissance saine et non cancéreuse.
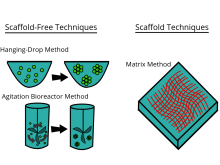
Classification des méthodes de culture 3D
Il existe un grand nombre d'outils de culture disponibles dans le commerce qui prétendent offrir les avantages de la culture cellulaire 3D. En général, les plates-formes peuvent être classées en deux types de méthodes de culture 3D : les techniques d' échafaudage et les techniques sans échafaudage .
Techniques d'échafaudage
Les techniques d'échafaudage comprennent l'utilisation d'échafaudages solides, d'hydrogels et d'autres matériaux. Dans une étude récente, le potentiel des cellules souches CD34+ humaines a été exploré en générant un modèle 3D de gel d'agarose in vitro pour comprendre le processus d'ossification osseuse.
Hydrogels
Comme la matrice extracellulaire naturelle (ECM) est importante dans la survie, la prolifération, la différenciation et la migration des cellules, différentes matrices d'hydrogel imitant la structure naturelle de l'ECM sont considérées comme des approches potentielles pour la culture cellulaire de type in vivo. Les hydrogels sont composés de pores interconnectés avec une rétention d'eau élevée, ce qui permet un transport efficace des nutriments et des gaz, par exemple. Plusieurs types d'hydrogels à partir de matériaux naturels et synthétiques sont disponibles pour la culture cellulaire 3D, notamment les hydrogels d'extraits d'ECM animale, les hydrogels de protéines, les hydrogels de peptides, les hydrogels polymères et les hydrogels de nanocellulose à base de bois .
Techniques sans échafaudage
Les techniques sans échafaudage emploient une autre approche indépendante de l'échafaudage d'utilisation. Les méthodes sans échafaudage incluent, par exemple, l'utilisation de plaques à faible adhérence, de plaques de chute suspendues, de surfaces à micromotifs et de bioréacteurs rotatifs , la lévitation magnétique et la bio-impression 3D magnétique .
Sphéroïdes
Les sphéroïdes sont un type de modélisation cellulaire tridimensionnelle qui simule mieux les conditions environnementales d'une cellule vivante par rapport à un modèle cellulaire bidimensionnel, en particulier avec les réactions entre les cellules et les réactions entre les cellules et la matrice. Les sphéroïdes sont utiles dans l'étude des caractéristiques physiologiques changeantes des cellules, de la différence dans la structure des cellules saines et des cellules tumorales, et des changements que subissent les cellules lors de la formation d'une tumeur. Des sphéroïdes co-cultivés avec des cellules tumorales et saines ont été utilisés pour simuler la façon dont les cellules cancéreuses interagissent avec les cellules normales. Les sphéroïdes peuvent être cultivés avec quelques méthodes différentes. Une méthode courante consiste à utiliser des plaques à faible adhérence cellulaire, généralement une plaque à 96 puits, pour produire en masse des cultures de sphéroïdes, où les agrégats se forment dans le fond arrondi des plaques cellulaires. Les sphéroïdes peuvent également être cultivés en utilisant la méthode de la goutte suspendue consistant à former des agrégats cellulaires en gouttes qui pendent de la surface d'une plaque cellulaire. D'autres méthodes à l'étude incluent l'utilisation de bioréacteurs à parois rotatives, qui font tourner et cultiver les cellules lorsqu'elles sont constamment en chute libre et forment des agrégats en couches. Récemment, certains protocoles ont été standardisés pour produire des sphéroïdes uniformes et fiables. Les chercheurs ont également exploré des méthodes standardisées, économiques et reproductibles pour la culture cellulaire en 3D.
Bioréacteurs
Les bioréacteurs utilisés pour les cultures cellulaires 3D sont de petites chambres cylindriques en plastique spécialement conçues pour la croissance de cellules en trois dimensions. Le bioréacteur utilise des matériaux synthétiques bioactifs tels que des membranes en polyéthylène téréphtalate pour entourer les cellules sphéroïdes dans un environnement qui maintient des niveaux élevés de nutriments. Ils sont faciles à ouvrir et à fermer, de sorte que les sphéroïdes cellulaires peuvent être retirés pour les tests, mais la chambre est capable de maintenir une humidité de 100 % partout. Cette humidité est importante pour obtenir une croissance et une fonction cellulaires maximales. La chambre du bioréacteur fait partie d'un dispositif plus grand qui tourne pour assurer une croissance cellulaire égale dans chaque direction sur trois dimensions.
MC2 Biotek a développé un bioréacteur pour incuber des proto-tissus qui utilise l'échange de gaz pour maintenir des niveaux élevés d'oxygène dans la chambre cellulaire. Il s'agit d'une amélioration par rapport aux bioréacteurs précédents, car les niveaux d'oxygène plus élevés aident la cellule à se développer et à subir une respiration cellulaire normale.
Microfluidique
Les différentes structures cellulaires du corps humain doivent être vascularisées pour recevoir les nutriments et les échanges gazeux dont elles ont besoin pour survivre. De même, les cultures cellulaires 3D in vitro nécessitent certains niveaux de circulation de fluide, ce qui peut être problématique pour les cultures 3D denses où les cellules peuvent ne pas toutes être suffisamment exposées aux nutriments. Ceci est particulièrement important dans les cultures d' hépatocytes car le foie est un organe hautement vascularisé. Une étude a cultivé des hépatocytes et des cellules vasculaires ensemble sur un échafaudage de gel de collagène entre des canaux microfluidiques , et comparé la croissance des cellules dans des environnements statiques et fluides, et a montré la nécessité de modèles avec des tissus et un réseau microvasculaire.
Criblage à haut débit
Le développement avancé de modèles 3D pour le criblage à haut débit dans des formats à haute densité a récemment été réalisable grâce aux réalisations technologiques liées à l'augmentation de la densité des microplaques . Ceux-ci peuvent être trouvés dans des formats de 384 et 1536 puits qui repoussent les cellules, sont rentables et se prêtent à des plates-formes de criblage entièrement automatisées. Deux options offrant des formats de 1536 puits sont disponibles auprès de Greiner Bio-One utilisant la bioimpression 3D magnétique m3D et Corning Life Sciences qui intègre un revêtement de surface à très faible attachement, ainsi qu'une géométrie de microcavité et une gravité pour créer des modèles 3D. En raison des méthodes et des technologies rapides et abordables qui ont été développées pour le criblage 3D, des approches parallèles de criblage à haut débit pour tester des paires isogéniques de mutants liés à l'oncogène par rapport au type sauvage ont été activées.
Pharmacologie et toxicologie
Un objectif principal de la croissance de cellules dans des échafaudages 3D et en tant que sphéroïdes cellulaires 3D in vitro est de tester les effets pharmacocinétiques et pharmacodynamiques des médicaments et des nanomatériaux dans des essais précliniques. Des études de toxicologie ont montré que les cultures cellulaires 3D étaient presque comparables aux études in vivo dans le but de tester la toxicité des composés médicamenteux. Lorsque l'on compare les valeurs de DL50 pour 6 médicaments courants : acétaminophène , amiodarone , diclofénac , metformine , phenformine et acide valproïque , les valeurs des sphéroïdes 3D sont directement corrélées avec celles des études in vivo. Bien que les cultures cellulaires 2D aient déjà été utilisées pour tester la toxicité ainsi que des études in vivo, les sphéroïdes 3D sont plus efficaces pour tester la toxicité d'une exposition chronique en raison de leur durée de vie plus longue. La matrice dans les sphéroïdes 3D amène les cellules à maintenir des filaments d'actine et est plus pertinente physiologiquement dans l'organisation du cytosquelette et la polarité cellulaire et la forme des cellules humaines. L'arrangement tridimensionnel permet aux cultures de fournir un modèle qui ressemble plus précisément au tissu humain in vivo sans utiliser de sujets d'expérimentation animale.
des reproches
Les méthodes 3D existantes ne sont pas sans limites, notamment l'évolutivité, la reproductibilité, la sensibilité et la compatibilité avec les instruments de criblage à haut débit (HTS). Le HTS cellulaire repose sur la détermination rapide de la réponse cellulaire à l'interaction médicamenteuse, telle que la viabilité cellulaire dose-dépendante, l'interaction cellule-cellule/cellule-matrice et/ou la migration cellulaire, mais les tests disponibles ne sont pas optimisés pour la culture cellulaire 3D. Un autre défi auquel est confrontée la culture cellulaire 3D est la quantité limitée de données et de publications qui traitent des mécanismes et des corrélations d'interaction médicamenteuse, de différenciation cellulaire et de signalisation cellulaire dans ces environnements 3D. Aucune des méthodes 3D n'a encore remplacé la culture 2D à grande échelle, y compris dans le processus de développement de médicaments ; bien que le nombre de publications sur la culture cellulaire 3D augmente rapidement, la caractérisation biochimique limitée actuelle des tissus 3D diminue l'adoption de nouvelles méthodes.
L'utilisation des sphéroïdes comme modèle de tissu cancéreux pose également des problèmes. Bien que bénéfiques pour la culture tissulaire 3D, les sphéroïdes tumoraux ont été critiqués pour être difficiles ou impossibles à "manipuler des gradients de molécules solubles dans des constructions [sphéroïdes 3D] et à caractériser les cellules dans ces gradients complexes", contrairement à la culture cellulaire 3D sur papier pour les bioessais tissulaires explorés par Ratmir et al. D'autres défis associés aux techniques complexes de culture cellulaire 3D comprennent : l'imagerie en raison de la grande taille des échafaudages et de l'incompatibilité avec de nombreux microscopes à fluorescence, la cytométrie en flux car elle nécessite la dissociation des sphéroïdes en une suspension unicellulaire et l'automatisation de la manipulation des liquides.
Voir également
- Culture de cellules
- Lignées cellulaires
- Test de culture cellulaire
- Hydrogel
- Lignée cellulaire Madin-Darby Canine Kidney
- Microphysiométrie