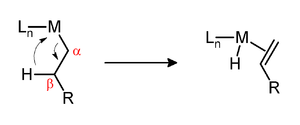
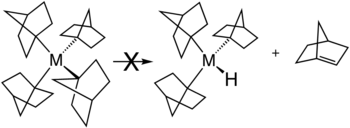Élimination du bêta-hydrure - beta-Hydride elimination
L'élimination du ß-hydrure est une réaction dans laquelle un groupe alkyle lié à un centre métallique est converti en l' hydrure lié au métal correspondant et un alcène . L'alkyle doit avoir des hydrogènes sur le carbone β. Par exemple, les groupes butyle peuvent subir cette réaction mais pas les groupes méthyle . Le complexe métallique doit avoir un site cis vide (ou vacant) par rapport au groupe alkyle pour que cette réaction se produise.
L'élimination du β-hydrure peut être soit une étape vitale dans une réaction, soit une réaction secondaire improductive . Le procédé Shell pour oléfines supérieures repose sur l'élimination des β-hydrures pour produire des α- oléfines qui sont utilisées pour produire des détergents. Illustrant une élimination du β-hydrure parfois indésirable, l'élimination du β-hydrure dans la polymérisation Ziegler – Natta conduit à des polymères de poids moléculaire réduit. Dans le cas du nickel - et palladium catalysé accouplements d'halogénures d'aryle avec des alkyles réactifs de Grignard , l'élimination de β-hydrure peut abaisser le rendement. La production de polymères ramifiés à partir d'éthylène repose sur la marche en chaîne , dont une étape clé est l'élimination du β-hydrure.
Dans certains cas, l'élimination du β-hydrure est la première d'une série d'étapes. Par exemple, dans la synthèse de RuHCl (CO) (PPh 3 ) 3 à partir de trichlorure de ruthénium , de triphénylphosphine et de 2-méthoxyéthanol , un complexe d' alcoxyde intermédiaire subit une élimination de β-hydrure pour former le ligand hydrure et l' aldéhyde à liaison pi qui est alors plus tard converti en ligand carbonyle ( monoxyde de carbone ).
Éviter l'élimination des β-hydrures
Plusieurs stratégies existent pour éviter l'élimination des β-hydrures. La stratégie la plus courante consiste à utiliser des ligands alkyle qui n'ont pas d'atomes d'hydrogène en position β. Les substituants courants comprennent le méthyle et le néopentyle . L'élimination du β-hydrure est également inhibée lorsque la réaction produirait un alcène contraint. Cette situation est illustrée par la stabilité des complexes métalliques contenant des ligands norbornyle, où le produit d'élimination du β-hydrure violerait la règle de Bredt .
Des ligands alkyles volumineux, tels que le tert- butyle ou le triméthylsilyle , peuvent empêcher l'atome d'hydrogène de se rapprocher d'une configuration coplanaire par rapport au métal, et les atomes α et β. Si le centre métallique n'a pas de sites de coordination vides, par exemple par le complexe ayant déjà une configuration à 18 électrons , l'élimination du β-hydrure n'est pas possible également.
Dans certains cas, les coligands peuvent imposer des géométries qui inhibent l'élimination des β-hydrures. Pour l'exemple ci-dessus, l'élimination indésirable du ß-hydrure est empêchée en utilisant une diphosphine où les deux atomes de phosphore sont fixés l'un à l'autre dans l'espace. Une façon de faire est d'utiliser un ligand trans couvrant tel que Xantphos . Comme ces complexes métalliques forment traditionnellement des géométries planes carrées , aucun site vacant cis du groupe alkyle ne peut être formé. Par conséquent, l'élimination du β-hydrure est empêchée. (Voir ligand trans- couvrant .)
Les références
- ^ Elschenbroich, C. (2006). Organométalliques . Weinheim: Wiley-VCH. ISBN 978-3-527-29390-2.
- ^ Bower, Barton K .; Tennent, Howard G. (1972). "Bicyclo [2.2.1] hept-1-yls de métal de transition". Confiture. Chem. Soc. 94 : 2512–2514. doi : 10.1021 / ja00762a056 .