Panbronchiolite diffuse - Diffuse panbronchiolitis
| Panbronchiolite diffuse | |
|---|---|
 | |
| Images de tomodensitométrie haute résolution de la partie inférieure de la poitrine chez un garçon de 16 ans atteint de panbronchiolite diffuse | |
| Spécialité | Pneumologie |
La panbronchiolite diffuse ( DPB ) est une maladie pulmonaire inflammatoire de cause inconnue. Il s'agit d'une forme sévère et progressive de bronchiolite , une affection inflammatoire des bronchioles (petits passages d'air dans les poumons). Le terme diffus signifie que des lésions apparaissent dans les deux poumons, tandis que la panbronchiolite fait référence à une inflammation trouvée dans toutes les couches des bronchioles respiratoires (celles impliquées dans les échanges gazeux ). La DPB provoque une inflammation sévère et des lésions ressemblant à des nodules des bronchioles terminales , une sinusite chronique et une toux intense avec de grandes quantités de crachats .
On pense que la maladie survient lorsqu'il existe une sensibilité, ou un manque de résistance du système immunitaire , aux bactéries ou virus responsables de la DPB , causée par plusieurs gènes qui se trouvent principalement chez les personnes d' origine asiatique . L' incidence la plus élevée se produit chez les Japonais , suivis des Coréens . La DPB survient plus souvent chez les hommes et commence généralement vers 40 ans. Elle a été reconnue comme une nouvelle maladie distincte au début des années 1960 et a été officiellement appelée panbronchiolite diffuse en 1969.
Si elle n'est pas traitée, la DPB évolue vers une bronchectasie , une affection pulmonaire irréversible qui implique une hypertrophie des bronchioles et une accumulation de mucus dans les voies bronchiolaires. Le traitement quotidien de la DPB avec des antibiotiques macrolides tels que l' érythromycine atténue les symptômes et augmente le temps de survie, mais la maladie n'a actuellement aucun remède connu. Le résultat final de la DPB peut être une insuffisance respiratoire et des problèmes cardiaques.
Classification
Le terme «bronchiolite» se réfère généralement à une inflammation des bronchioles. La DPB est classée comme une forme de «bronchiolite primaire», ce qui signifie que la cause sous-jacente de la bronchiolite provient ou est confinée aux bronchioles. En plus de la DPB, d'autres formes de bronchiolite primaire comprennent la bronchiolite oblitérante , la bronchiolite folliculaire, la bronchiolite respiratoire , la maladie des voies respiratoires des poussières minérales et un certain nombre d'autres. Contrairement à la DPB, la bronchiolite qui n'est pas considérée comme «primaire» serait associée à des maladies des voies respiratoires plus larges, comme la bronchite chronique .
Signes et symptômes
Les symptômes de la DPB comprennent la sinusite chronique ( sinus paranasaux enflammés ), une respiration sifflante, des crépitements ( sons respiratoires produits par des obstructions telles que des mucosités et des sécrétions dans les poumons), une dyspnée (essoufflement) et une toux sévère qui produit de grandes quantités de crachats (toux) -up flegme). Il peut y avoir du pus dans les expectorations et les personnes touchées peuvent avoir de la fièvre. Les signes typiques de progression de la DPB comprennent la dilatation (élargissement) des voies bronchiolaires et l' hypoxémie (faibles niveaux d'oxygène dans le sang). Si la DPB n'est pas traitée, une bronchectasie se produira; elle se caractérise par une dilatation et un épaississement des parois des bronchioles, des lésions inflammatoires des bronchioles respiratoires et terminales et une accumulation de mucus dans les poumons. DPB est associée à une progressive insuffisance respiratoire , hypercapnie (augmentation des niveaux de dioxyde de carbone dans le sang), et peut éventuellement conduire à une hypertension artérielle pulmonaire (haute pression du sang dans la veine pulmonaire et l' artère ) et un cœur pulmonaire (dilatation du ventricule droit du coeur ou «insuffisance cardiaque droite»).
Cause
La DPB est idiopathique , ce qui signifie qu'une cause physiologique , environnementale ou pathogène exacte de la maladie est inconnue. Cependant, plusieurs facteurs sont soupçonnés d'être impliqués dans sa pathogenèse (la manière dont la maladie fonctionne).
Le complexe majeur d'histocompatibilité (CMH) est une grande région génomique trouvée chez la plupart des vertébrés et associée au système immunitaire. Il est situé sur le chromosome 6 chez l'homme. Un sous-ensemble du CMH chez l'homme est l'antigène leucocytaire humain (HLA), qui contrôle le système de présentation de l' antigène , dans le cadre de l' immunité adaptative contre les agents pathogènes tels que les bactéries et les virus . Lorsque les cellules humaines sont infectées par un agent pathogène, certaines d'entre elles peuvent présenter des parties des protéines de l'agent pathogène à leur surface; c'est ce qu'on appelle la "présentation de l'antigène". Les cellules infectées deviennent alors des cibles pour les types de cellules T cytotoxiques , qui tuent les cellules infectées afin qu'elles puissent être éliminées du corps.
La prédisposition génétique à la sensibilité au DPB a été localisée à deux haplotypes HLA (une différence de séquence nucléotidique ou génétique entre les chromosomes appariés , qui est plus susceptible de se produire parmi une ethnicité ou un trait commun) commune aux personnes d'origine asiatique. Le HLA-B54 est associé au DPB chez les Japonais, tandis que le HLA-A11 est associé à la maladie chez les Coréens. On pense que plusieurs gènes de cette région du HLA de classe I sont responsables de la DPB, en permettant une sensibilité accrue à la maladie. Le fond génétique commun et les similitudes dans le profil HLA des individus japonais et coréens affectés ont été pris en compte dans la recherche d'un gène DPB. Il a été suggéré qu'une mutation d'un gène suspecté de sensibilité à la maladie situé quelque part entre HLA-B et HLA-A s'était produite sur un chromosome ancestral portant à la fois HLA-B54 et HLA-A11. En outre, il est possible qu'un certain nombre d' événements de recombinaison génétique autour du locus de la maladie (localisation sur un chromosome) aient pu entraîner l'association de la maladie avec HLA-B54 chez les Japonais et HLA-A11 chez les Coréens. Après une étude plus approfondie, il a été conclu qu'un gène de susceptibilité DPB est situé près du locus HLA-B au chromosome 6p21.3. Dans ce domaine, la recherche d'une cause génétique de la maladie s'est poursuivie.
Parce que de nombreux gènes appartenant à HLA restent non identifiés, le clonage positionnel (une méthode utilisée pour identifier un gène spécifique, lorsque seul son emplacement sur un chromosome est connu) a été utilisé pour déterminer qu'un gène de type mucine est associé à la DPB. En outre, des maladies causées par des gènes HLA identifiés dans la région de sensibilité à la DPB ont été étudiées. L'un de ceux-ci, le syndrome des lymphocytes nus I (BLS I), présente un certain nombre de similitudes avec le DPB chez les personnes touchées, notamment la sinusite chronique, l'inflammation et les nodules bronchiolaires et la présence de H. influenzae . Tout comme le DPB, le BLS I répond favorablement au traitement à l'érythromycine en montrant une résolution des symptômes. Les similitudes entre ces deux maladies, le succès correspondant avec le même mode de traitement, et le fait que le gène responsable de BLS I soit situé dans la zone causant la DPB de HLA rétrécit l'établissement d'un gène responsable de la DPB. Les facteurs environnementaux tels que l'inhalation de vapeurs toxiques et le tabagisme ne sont pas censés jouer un rôle dans la DPB, et des causes environnementales inconnues et d'autres causes non génétiques, telles que des bactéries ou des virus non identifiés, n'ont pas été exclues.
La fibrose kystique (FK), une maladie pulmonaire multi-systémique progressive, a été prise en compte dans la recherche d'une cause génétique de DPB. Ceci pour plusieurs raisons. La mucoviscidose, comme la DPB, provoque une inflammation pulmonaire sévère, une production abondante de mucus, une infection et montre une prédominance génétique chez les Caucasiens d'un groupe géographique à la rareté des autres; alors que le DPB domine parmi les Asiatiques de l'Est, la mucoviscidose affecte principalement les personnes d'origine européenne. Bien qu'aucun gène n'ait été impliqué comme cause de la DPB, la mutation d'un gène spécifique - beaucoup plus susceptible de se produire chez les Européens - provoque la mucoviscidose. Cette mutation dans le gène responsable de la mucoviscidose n'est pas un facteur de la DPB, mais un polymorphisme unique (variation) de ce gène est connu pour se produire chez de nombreux Asiatiques qui ne sont pas nécessairement affectés par l'une ou l'autre des maladies. On cherche à savoir si ce gène, dans un état de mutation quelconque, pourrait contribuer à la DPB.
Physiopathologie
L'inflammation fait partie intégrante de la réponse immunitaire humaine, par laquelle les leucocytes (globules blancs), y compris les neutrophiles (globules blancs spécialisés dans l'inflammation), se rassemblent et les chimiokines (protéines libérées par certaines cellules, qui activent ou provoquent une réponse de d'autres cellules) s'accumulent à tout endroit du corps où se produisent des infections bactériennes ou virales. L'inflammation interfère avec l'activité des bactéries et des virus et sert à les éliminer du corps. Dans la DPB, des bactéries telles que Haemophilus influenzae et Pseudomonas aeruginosa peuvent provoquer la prolifération de cellules inflammatoires dans les tissus bronchiolaires. Cependant, lorsqu'aucune bactérie n'est présente avec le DPB, l'inflammation se poursuit pour une raison encore inconnue. Dans les deux cas, l'inflammation de la DPB peut être si grave que des nodules contenant des cellules inflammatoires se forment dans les parois des bronchioles. La présence d'inflammation et d'infection dans les voies respiratoires entraîne également la production d'un excès de mucus, qui doit être craché sous forme d'expectoration. La combinaison de l'inflammation, du développement de nodules, de l'infection, du mucus et de la toux fréquente contribue aux difficultés respiratoires de la DPB.
Le fait que l'inflammation dans la DPB persiste avec ou sans la présence de P. aeruginosa et H. influenzae fournit un moyen de déterminer plusieurs mécanismes de la pathogenèse de la DPB. Les leucotriènes sont des eicosanoïdes , des molécules de signalisation à base d' acides gras essentiels , qui jouent un rôle dans de nombreuses maladies pulmonaires en provoquant la prolifération de cellules inflammatoires et une production excessive de mucus dans les voies respiratoires. Dans la DPB et d'autres maladies pulmonaires, le médiateur prédominant de l'inflammation liée aux neutrophiles est le leucotriène B4 , spécialisé dans la prolifération des neutrophiles par chimiotaxie (mouvement de certains types de cellules vers ou loin de certaines molécules).
L'inflammation dans la DPB est également causée par la chimiokine MIP-1alpha et son implication avec les cellules T CD8 + . Les bêta-défensines , une famille de peptides antimicrobiens trouvés dans les voies respiratoires, sont responsables d'une inflammation supplémentaire de la DPB lorsqu'un agent pathogène tel que P. aeruginosa est présent. S'il est présent avec la DPB, le virus T-lymphotrope humain, type I , un rétrovirus , modifie la pathogenèse de la DPB en infectant les cellules T auxiliaires et en altérant leur efficacité à reconnaître la présence d'agents pathogènes connus ou inconnus impliqués dans la DPB.
Diagnostic
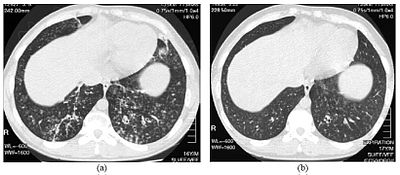
Le diagnostic de DPB nécessite une analyse des poumons et des tissus bronchiolaires, ce qui peut nécessiter une biopsie pulmonaire , ou la tomodensitométrie à haute résolution (HRCT) plus préférée des poumons. Les critères diagnostiques comprennent une inflammation sévère dans toutes les couches des bronchioles respiratoires et des lésions du tissu pulmonaire qui apparaissent sous forme de nodules dans les bronchioles terminales et respiratoires dans les deux poumons. Les nodules dans la DPB apparaissent comme des grumeaux opaques lorsqu'ils sont vus sur les rayons X du poumon, et peuvent provoquer une obstruction des voies respiratoires , qui est évaluée par un test de la fonction pulmonaire , ou PFT. Les radiographies pulmonaires peuvent également révéler une dilatation des voies bronchiolaires, un autre signe de DPB. Les scans HRCT montrent souvent des blocages de certains passages bronchiolaires avec du mucus, ce que l'on appelle le schéma «arbre-dans-bourgeon» . L'hypoxémie, un autre signe de difficulté respiratoire, est révélée en mesurant la teneur en oxygène et en dioxyde de carbone du sang, à l'aide d'un test sanguin appelé gaz du sang artériel . D'autres résultats observés avec la DPB comprennent la prolifération de lymphocytes ( globules blancs qui combattent l'infection), de neutrophiles et d' histiocytes mousseux ( macrophages tissulaires ) dans la muqueuse pulmonaire . Des bactéries telles que H. influenzae et P. aeruginosa sont également détectables, ces dernières devenant plus importantes à mesure que la maladie progresse. Le sang blanc, les bactéries et autres contenus cellulaires du sang peuvent être mesurés en prenant une formule sanguine complète (CBC). Des taux élevés d' IgG et d' IgA (classes d' immunoglobulines ) peuvent être observés, ainsi que la présence de facteur rhumatoïde (un indicateur d' auto - immunité ). Une hémagglutination , une agglutination de globules rouges en réponse à la présence d' anticorps dans le sang, peut également se produire. Les neutrophiles, les bêta-défensines, les leucotriènes et les chimiokines peuvent également être détectés dans le liquide de lavage bronchoalvéolaire injecté puis retiré des voies respiratoires bronchiolaires des personnes atteintes de DPB, pour évaluation.
Diagnostic différentiel
Dans le diagnostic différentiel (trouver le diagnostic correct entre les maladies qui ont des caractéristiques qui se chevauchent) de certaines maladies pulmonaires obstructives, la DPB est souvent prise en compte. Un certain nombre de symptômes de DPB ressemblent à ceux trouvés avec d'autres maladies pulmonaires obstructives telles que l' asthme , la bronchite chronique et l' emphysème . Une respiration sifflante , une toux avec production de crachats et un essoufflement sont des symptômes courants de ces maladies, et une déficience fonctionnelle respiratoire obstructive est constatée lors des tests de la fonction pulmonaire . La fibrose kystique, comme la DPB, provoque une inflammation pulmonaire sévère, une production excessive de mucus et une infection; mais la DPB ne provoque pas de troubles du pancréas ni des électrolytes , comme le fait la mucoviscidose, de sorte que les deux maladies sont différentes et probablement sans rapport. La DPB se distingue par la présence de lésions qui apparaissent sur les rayons X sous forme de nodules dans les bronchioles des deux poumons; inflammation de toutes les couches tissulaires des bronchioles respiratoires; et sa prévalence plus élevée chez les personnes de descendance est-asiatique.
La DPB et la bronchiolite oblitérante sont deux formes de bronchiolite primaire. Les caractéristiques de chevauchement spécifiques des deux maladies comprennent une forte toux avec de grandes quantités d'expectorations souvent remplies de pus; nodules visibles sur les radiographies pulmonaires dans les bronches inférieures et la région bronchiolaire; et la sinusite chronique. En DPB, les nodules sont plus restreints aux bronchioles respiratoires, tandis qu'en OB, ils se trouvent souvent dans les bronchioles membraneuses (la section non cartilagineuse initiale de la bronchiole, qui se sépare de la bronche tertiaire ) jusqu'à la bronche secondaire . L'OB est une maladie bronchiolaire avec une prévalence mondiale, tandis que la DPB a une prévalence plus localisée, principalement au Japon. Avant la reconnaissance clinique de la DPB ces dernières années, elle était souvent diagnostiquée à tort comme une bronchiectasie , une BPCO , une IPF , une phtisie miliaire , une sarcoïdose ou un carcinome alvéolaire .
Traitement
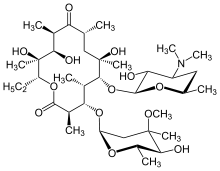
Les antibiotiques macrolides , tels que l' érythromycine , sont un traitement efficace contre la DPB lorsqu'ils sont pris régulièrement sur une période prolongée. La clarithromycine ou la roxithromycine sont également couramment utilisées. Les résultats positifs des macrolides dans la DPB et les maladies pulmonaires similaires proviennent de la gestion de certains symptômes par immunomodulation (ajustement de la réponse immunitaire), ce qui peut être obtenu en prenant les antibiotiques à faibles doses . Le traitement consiste en une administration orale quotidienne d'érythromycine pendant deux à trois ans, une période prolongée dont il a été démontré qu'elle améliore considérablement les effets de la DPB. Cela est apparent lorsqu'une personne subissant un traitement pour DPB, parmi un certain nombre de critères de rémission liés à la maladie, a un nombre normal de neutrophiles détecté dans le liquide BAL et des gaz sanguins (un test sanguin artériel qui mesure la quantité d'oxygène et de dioxyde de carbone dans le sang) montrent que l'oxygène libre dans le sang se situe dans la plage normale. Il a été suggéré de permettre une interruption temporaire du traitement à l'érythromycine dans ces cas, pour réduire la formation de P. aeruginosa résistant aux macrolides . Cependant, les symptômes de la DPB réapparaissent généralement et le traitement doit être repris. Bien que très efficace, l'érythromycine peut ne pas s'avérer efficace chez toutes les personnes atteintes de la maladie, en particulier si P. aeruginosa résistant aux macrolides est présent ou si la DPB non traitée auparavant a progressé au point de provoquer une insuffisance respiratoire.
Avec le traitement à l'érythromycine dans la DPB, une grande réduction de l'inflammation et des dommages bronchiolaires est obtenue grâce à la suppression non seulement de la prolifération des neutrophiles , mais également de l'activité lymphocytaire et des sécrétions obstructives de mucus et d'eau dans les voies respiratoires. Les effets antibiotiques des macrolides ne sont pas impliqués dans leurs effets bénéfiques sur la réduction de l'inflammation dans la DPB. Cela est évident parce que la posologie du traitement est beaucoup trop faible pour combattre l'infection, et dans les cas de DPB avec l'apparition de P. aeruginosa résistant aux macrolides , le traitement à l'érythromycine réduit encore l'inflammation.
Un certain nombre de facteurs sont impliqués dans la suppression de l'inflammation par l'érythromycine et d'autres macrolides. Ils sont particulièrement efficaces pour inhiber la prolifération des neutrophiles, en diminuant la capacité de l' interleukine 8 et du leucotriène B4 à les attirer. Les macrolides réduisent également l'efficacité des molécules d'adhésion qui permettent aux neutrophiles de coller aux revêtements des tissus bronchiolaires. La production de mucus dans les voies respiratoires est l'un des principaux responsables de la morbidité et de la mortalité de la DPB et d'autres maladies respiratoires. La réduction significative de l'inflammation de la DPB attribuée au traitement à l'érythromycine contribue également à inhiber la production d'excès de mucus.
Pronostic
La DPB non traitée entraîne une bronchectasie, une insuffisance respiratoire et la mort. Un rapport de revue de 1983 a indiqué que le DPB non traité avait un taux de survie à cinq ans de 62,1%, tandis que le taux de survie à 10 ans était de 33,2%. Avec le traitement à l'érythromycine, les personnes atteintes de DPB ont désormais une espérance de vie beaucoup plus longue en raison d'une meilleure gestion des symptômes, d'un retard de progression et de la prévention des infections associées telles que P. aeruginosa . Le taux de survie à 10 ans du DPB traité est d'environ 90%. Dans les cas de DPB où le traitement a entraîné une amélioration significative, ce qui se produit parfois après environ deux ans, le traitement a été autorisé à se terminer pendant un certain temps. Cependant, les personnes autorisées à arrêter le traitement pendant cette période sont étroitement surveillées. Comme il a été prouvé que la DPB se reproduit, le traitement par l'érythromycine doit être repris rapidement une fois que les symptômes de la maladie commencent à réapparaître. Malgré l'amélioration du pronostic lors du traitement, la DPB n'a actuellement aucun remède connu.
Épidémiologie
La DPB a sa prévalence la plus élevée parmi les Japonais, à 11 pour 100 000 habitants. Des individus coréens, chinois et thaïlandais atteints de la maladie ont également été signalés. Une prédisposition génétique chez les Asiatiques de l'Est est suggérée. La maladie est plus fréquente chez les hommes, avec un rapport homme / femme de 1,4 à 2: 1 (soit environ 5 hommes pour 3 femmes). L'apparition moyenne de la maladie se situe vers l'âge de 40 ans et les deux tiers des personnes touchées sont des non-fumeurs, bien que le tabagisme ne soit pas considéré comme une cause. La présence de HLA-Bw54 augmente le risque de panbronchiolite diffuse de 13,3 fois.
En Europe et dans les Amériques, un nombre relativement faible de cas de DPB a été signalé chez des immigrants et des résidents asiatiques, ainsi que chez des personnes d'ascendance non asiatique. Des erreurs de diagnostic sont survenues en Occident en raison d'une moindre reconnaissance de la maladie que dans les pays asiatiques. Par rapport au grand nombre d'Asiatiques vivant dans l'ouest, le petit nombre d'entre eux qui seraient affectés par la DPB suggère que des facteurs non génétiques peuvent jouer un rôle dans sa cause. Cette rareté observée chez les Asiatiques occidentaux peut également être en partie associée à un diagnostic erroné.
Histoire
Au début des années 60, une maladie pulmonaire chronique relativement nouvelle était observée et décrite par des médecins au Japon. En 1969, le nom de «panbronchiolite diffuse» a été introduit pour le distinguer de la bronchite chronique, de l'emphysème, de l' alvéolite et d'autres maladies pulmonaires obstructives avec inflammation. Entre 1978 et 1980, les résultats d'une enquête nationale lancée par le ministère de la Santé et du Bien-être du Japon ont révélé plus de 1 000 cas probables de DPB, dont 82 confirmés histologiquement. Dans les années 1980, il était internationalement reconnu comme une maladie distincte des poumons.
Avant les années 1980, le pronostic ou l'issue attendue de la DPB était médiocre, en particulier dans les cas de surinfection (l'apparition d'une nouvelle infection virale ou bactérienne, en plus de l'infection actuellement en cours) par P. aeruginosa . Le DPB a continué à avoir un taux de mortalité très élevé avant que le traitement antibiotique généralisé et l'oxygénothérapie ne commencent à être utilisés en routine dans l'effort de prise en charge des symptômes. Vers 1985, lorsque le traitement à long terme avec l'antibiotique érythromycine est devenu la norme pour la gestion de la DPB, le pronostic s'est considérablement amélioré. En 1990, l'association de DPB avec HLA a été initialement revendiquée.
Les références
Liens externes
| Classification | |
|---|---|
| Ressources externes |