Formylation - Formylation
En biochimie, l'ajout d'un groupe fonctionnel formyle est appelé formylation . Une fonction formyle est constituée d'un carbonyle lié à l'hydrogène. Lorsqu'il est attaché à un groupe R , un groupe formyle est appelé aldéhyde .
La formylation a été identifiée dans plusieurs processus biologiques critiques. La méthionine a été découverte pour la première fois comme étant formylée dans E. coli par Marker et Sanger en 1964 et a ensuite été identifiée comme étant impliquée dans l'initiation de la synthèse des protéines dans les bactéries et les organites. La formation de N- formylméthionine est catalysée par l'enzyme méthionyl-ARNt Met transformylase . De plus, deux réactions de formylation se produisent dans la biosynthèse de novo des purines . Ces réactions sont catalysées par les enzymes glycinamide ribonucléotide (GAR) transformylase et 5-aminoimidazole-4-carboxyamide ribotide (AICAR) transformylase . Plus récemment, la formylation s'est avérée être une modification des histones , qui peut moduler l'expression des gènes.
Réaction générale de formylation
La formylation fait référence à tout processus chimique dans lequel un composé est fonctionnalisé avec un groupe formyle (-CH=O). En chimie organique, le terme est le plus couramment utilisé en ce qui concerne les composés aromatiques (par exemple la conversion du benzène en benzaldéhyde dans la réaction de Gattermann-Koch ). En biochimie, la réaction est catalysée par des enzymes telles que les formyltransférases .
Réactions de formylation en biologie
Méthanogenèse
La formylation du méthanofurane initie le cycle de méthanogenèse . Le groupe formyle est dérivé du dioxyde de carbone et est converti en méthane .

Formylation dans la synthèse des protéines
Dans les bactéries et les organites, l'initiation de la synthèse des protéines est signalée par la formation de formyl-méthionyl-ARNt (ARNt fMet ). Cette réaction dépend du 10-formyltétrahydrofolate et de l'enzyme méthionyl-ARNt formyltransférase. Cette réaction n'est pas utilisée par les eucaryotes ou les archées, car la présence d'ARNt fMet dans les cellules non bactériennes est qualifiée de matière intrusive et rapidement éliminée. Après sa production, l'ARNt fMet est délivré à la sous-unité 30S du ribosome afin de démarrer la synthèse des protéines. fMet possède la même séquence de codons que la méthionine. Cependant, fMet n'est utilisé que pour l'initiation de la synthèse protéique et ne se trouve donc qu'à l'extrémité N de la protéine. La méthionine est utilisée pendant le reste de la traduction. Dans E. coli , l'ARNt fMet est spécifiquement reconnu par le facteur d'initiation IF-2 , car le groupe formyle bloque la formation de liaisons peptidiques à l'extrémité N-terminale de la méthionine.
Une fois que la synthèse des protéines est accomplie, le groupe formyle sur la méthionine peut être éliminé par la peptide déformylase . Le résidu méthionine peut être encore éliminé par l'enzyme méthionine aminopeptidase .
Réactions de formylation dans la biosynthèse des purines
Deux réactions de formylation sont nécessaires dans les onze étapes de la synthèse de novo de l' inosine monophosphate (IMP) , le précurseur des ribonucléotides puriques AMP et GMP. La glycinamide ribonucléotide (GAR) transformylase catalyse la formylation de GAR en formylglycinamidine ribotide (FGAR) dans la quatrième réaction de la voie. Dans l'avant-dernière étape de la biosynthèse de novo purine, le 5-aminoimidazole-4-carboxyamide ribotide (AICAR) est formylé en 5-formaminoimidazole-4-carboxamide ribotide (FAICAR) par l' AICAR transformylase .
GAR transformylase
La PurN GAR transformylase est présente chez les eucaryotes et les procaryotes. Cependant, une seconde transformylase GAR, PurT GAR transformylase a été identifiée dans E. coli . Alors que les deux enzymes n'ont pas de conservation de séquence et nécessitent des donneurs de formyle différents, l'activité spécifique et le Km pour GAR sont les mêmes dans la transformylase PurT et PurN GAR.
PurN GAR transformylase
PurN GAR transformylase 1CDE utilise le coenzyme N10-formyltétrahydrofolate (N10-formyl-THF) comme donneur de formyle pour formyler le groupe -amino de GAR. Chez les eucaryotes, PurN GAR transformylase fait partie d'une grande protéine multifonctionnelle, mais se trouve sous forme de protéine unique chez les procaryotes.
Mécanisme

Il est proposé que la réaction de formylation se produise par une réaction de transfert direct dans laquelle le groupe amine de GAR attaque nucléophile N10-formyl-THF créant un intermédiaire tétraédrique. Comme le groupe -amino de GAR est relativement réactif, il est proposé que la déprotonation du nucléophile se produise par solvant. Dans le site actif, Asn 106, His 108 et Asp 144 sont positionnés pour aider au transfert de formyle. Cependant, des études de mutagenèse ont indiqué que ces résidus ne sont pas individuellement essentiels pour la catalyse, car seules les mutations de deux résidus ou plus inhibent l'enzyme. Sur la base de la structure, on pense que l'Asp144 chargé négativement augmente le pKa de His108, permettant au groupe imidazolium protoné de His108 d'améliorer l'électrophilie du groupe N10-formyl-THF formyle. De plus, on pense que His108 et Asn106 stabilisent l'oxyanion formé dans l'état de transition.
PurT GAR transformylase
PurT GAR transformylase nécessite du formiate comme donneur de formyle et de l'ATP pour la catalyse. Il a été estimé que PurT GAR transformylase effectue 14 à 50 % des formylations de GAR dans E. coli . L'enzyme est un membre de la superfamille des protéines ATP-grasp.
Mécanisme
Un mécanisme séquentiel a été proposé pour la transformylase PurT GAR dans lequel un intermédiaire de phosphate de formyle à courte durée de vie est proposé pour se former en premier. Cet intermédiaire formyl phosphate subit ensuite une attaque nucléophile par l'amine GAR pour le transfert du groupe formyle. Un intermédiaire de phosphate de formyle a été détecté dans des expériences de mutagenèse, dans lesquelles la transforymylase mutante PurT GAR avait une faible affinité pour le formiate. L'incubation de PurT GAR transformylase avec du phosphate de formyle, de l'ADP et du GAR donne à la fois de l'ATP et du FGAR. Ceci indique en outre que le phosphate de formyle peut être un intermédiaire, car il est cinétiquement et chimiquement compétent pour effectuer la réaction de formylation dans l'enzyme. Il a également été proposé de former un intermédiaire phosphate enzymatique précédant l'intermédiaire formylphosphate sur la base d'études d'échange isotopique positionnel. Cependant, les données structurelles indiquent que le formiate peut être positionné pour une attaque directe sur le -phosphate de l'ATP dans le site actif de l'enzyme pour former l'intermédiaire formylphosphate.
AICAR transformylase
La transformylase AICAR nécessite le coenzyme N10-formyltétrahydrofolate (N10-formyl-THF) comme donneur de formyle pour la formylation de l'AICAR en FAICAR. Cependant, la transformylase AICAR et la transformylase GAR ne partagent pas une similitude de séquence élevée ou une homologie structurelle.
Mécanisme
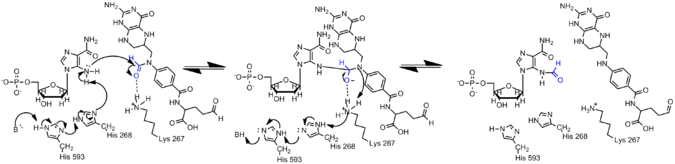
L'amine sur AICAR est beaucoup moins nucléophile que son homologue sur GAR en raison de la délocalisation des électrons dans AICAR par conjugaison. Par conséquent, le nucléophile N5 d'AIRCAR doit être activé pour que la réaction de formylation se produise. L'histidine 268 et la lysine 267 se sont avérées essentielles pour la catalyse et sont conservées dans toutes les AICAR transformylases. L'histidine 268 est impliquée dans la déprotonation du nucléophile N5 de l'AICAR, tandis que la lysine 267 est proposée pour stabiliser l'intermédiaire tétraédrique.
Formylation dans les protéines d'histone
La ε-formylation est l'une des nombreuses modifications post-traductionnelles qui se produisent sur les protéines histones, dont il a été démontré qu'elles modulent les conformations de la chromatine et l'activation des gènes.
La formylation a été identifiée sur le Nε des résidus lysine dans les histones et les protéines. Cette modification a été observée dans les histones de liaison et les protéines du groupe à haute mobilité , elle est très abondante et on pense qu'elle a un rôle dans l'épigénétique de la fonction de la chromatine. Il a été démontré que les lysines formylées jouent un rôle dans la liaison à l'ADN. De plus, une formylation a été détectée sur des lysines d'histone qui sont également connues pour être acétylées et méthylées. Ainsi, la formylation peut bloquer d'autres modifications post-traductionnelles. La formylation est détectée le plus fréquemment sur 19 sites de modification différents sur l'Histone H1. L'expression génétique de la cellule est fortement perturbée par la formylation, ce qui peut provoquer des maladies telles que le cancer. Le développement de ces modifications peut être dû au stress oxydatif.
Dans les protéines histones, la lysine est généralement modifiée par les histones acétyl-transférases (HAT) et les histones désacétylases (HDAC ou KDAC). L'acétylation de la lysine est fondamentale pour la régulation et l'expression de certains gènes. Le stress oxydatif crée un environnement sensiblement différent dans lequel l'acétyl-lysine peut être rapidement supplantée par la formation de formyl-lysine en raison de la forte réactivité des espèces formylphosphate. On pense actuellement que cette situation est causée par des dommages oxydatifs à l'ADN. Un mécanisme pour la formation de formylphosphate a été proposé, qui dépend fortement de l'ADN endommagé par oxydation et principalement entraîné par la chimie radicalaire au sein de la cellule. Le formylphosphate produit peut ensuite être utilisé pour formylate la lysine. On pense que le stress oxydatif joue un rôle dans la disponibilité des résidus de lysine à la surface des protéines et la possibilité d'être formylé.
La formylation en médecine
Réactions de formylation comme cible médicamenteuse
L'inhibition des enzymes impliquées dans la biosynthèse des purines a été exploitée comme cible potentielle de médicaments pour la chimiothérapie.
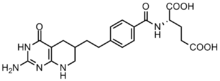
Les cellules cancéreuses nécessitent des concentrations élevées de purines pour faciliter la division et ont tendance à dépendre de la synthèse de novo plutôt que de la voie de récupération des nucléotides . Plusieurs inhibiteurs à base de folate ont été développés pour inhiber les réactions de formylation par la transformylase GAR et la transformylase AICAR. Le premier inhibiteur de la transformylase GAR Lometrexol [(6R)5,10-dideazatetrahydrofolate] a été développé dans les années 1980 grâce à une collaboration entre Eli Lilly et des laboratoires universitaires.
Bien que de structure similaire au N10-formyl-THF, le lométrexol est incapable d'effectuer une réaction de transfert de carbone. De plus, plusieurs inhibiteurs à base de GAR de la transformylase GAR ont également été synthétisés. Le développement d'inhibiteurs à base de folate s'est avéré particulièrement difficile car les inhibiteurs régulent également à la baisse l'enzyme folypolyglutamate synthase , qui ajoute des γ-glutamates supplémentaires aux monoglutamates folates et antifolates après avoir pénétré dans la cellule pour une affinité enzymatique accrue. Cette affinité accrue peut conduire à une résistance aux antifolates.
Syndrome de Leigh
Le syndrome de Leigh est une maladie neurodégénérative qui a été liée à un défaut dans une réaction de formylation enzymatique. Le syndrome de Leigh est généralement associé à des défauts de phosphorylation oxydative, qui se produisent dans les mitochondries. Le séquençage de l'exome a été utilisé pour identifier une mutation dans le gène codant pour la méthionyl-ARNt formyltransférase mitochondriale (MTFMT) chez les patients atteints du syndrome de Leigh. On pense que la mutation c.626C>T identifiée dans la MTFMT produisant des symptômes du syndrome de Leigh altère l'épissage des exons, entraînant une mutation de décalage du cadre de lecture et un codon d'arrêt prématuré. Les individus avec la mutation MTFMT c.626C>T se sont avérés avoir des niveaux de fMet-tRNAMet réduits et des changements dans le niveau de formylation de COX1 traduit par mitochondrie. Ce lien fournit la preuve de la nécessité de la méthionine formylée dans l'initiation de l'expression de certains gènes mitochondriaux.