Force intramoléculaire - Intramolecular force
Une force intramoléculaire (ou forces primaires) est toute force qui lie ensemble les atomes constituant une molécule ou un composé, à ne pas confondre avec les forces intermoléculaires , qui sont les forces présentes entre les molécules. La différence subtile dans le nom vient des racines latines de l'anglais avec une signification inter entre ou parmi et une signification intra à l' intérieur . Les liaisons chimiques sont par exemple considérées comme des forces intramoléculaires. Ces forces sont souvent plus fortes que les forces intermoléculaires , qui sont présentes entre des atomes ou des molécules qui ne sont pas liés.
Les types
Le modèle classique identifie trois principaux types de liaisons chimiques - ioniques, covalentes et métalliques - qui se distinguent par le degré de séparation des charges entre les atomes participants. Les caractéristiques de la liaison formée peuvent être prédites par les propriétés des atomes constitutifs, à savoir l'électronégativité. Ils diffèrent par l'ampleur de leurs enthalpies de liaison , une mesure de la force de liaison, et affectent ainsi les propriétés physiques et chimiques des composés de différentes manières. Le% de caractère ionique est la différence directement proportionnelle d'électronégitivité de l'atome lié.
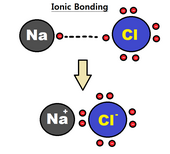
Liaison ionique
Une liaison ionique peut être approximée comme un transfert complet d'un ou plusieurs électrons de valence d'atomes participant à la formation de la liaison, résultant en un ion positif et un ion négatif liés ensemble par des forces électrostatiques. Les électrons dans une liaison ionique ont tendance à être principalement trouvés autour de l'un des deux atomes constituants en raison de la grande différence d' électronégativité entre les deux atomes (une plus grande différence d'électronégativité entraîne une liaison plus forte); ceci est souvent décrit comme un atome donnant des électrons à l'autre. Ce type de liaison est généralement formé entre un métal et un non - métal , tel que le sodium et le chlore dans NaCl . Le sodium donnerait un électron au chlore, formant un ion sodium chargé positivement et un ion chlorure chargé négativement.
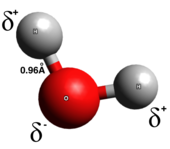
Une liaison covalente
Dans une véritable liaison covalente , les électrons sont répartis uniformément entre les deux atomes de la liaison; il y a peu ou pas de séparation des charges. Des liaisons covalentes sont généralement formées entre deux non-métaux. Il existe plusieurs types de liaisons covalentes: dans les liaisons covalentes polaires , les électrons sont plus susceptibles de se trouver autour de l'un des deux atomes, tandis que dans les liaisons covalentes non polaires, les électrons sont uniformément partagés. Les molécules diatomiques homonucléaires sont purement covalentes. La polarité d'une liaison covalente est déterminée par les électronégativités de chaque atome et ainsi une liaison covalente polaire a un moment dipolaire pointant de l'extrémité positive partielle vers l'extrémité négative partielle. Les liaisons covalentes polaires représentent un type intermédiaire dans lequel les électrons ne sont ni complètement transférés d'un atome à un autre ni uniformément partagés.
Lien métallique
Les liaisons métalliques se forment généralement dans un métal pur ou un alliage métallique . Les électrons métalliques sont généralement délocalisés ; le résultat est un grand nombre d'électrons libres autour des noyaux positifs , parfois appelés mer d'électrons.
Formation de liaison
Les liaisons sont formées par des atomes afin qu'ils puissent atteindre un état d'énergie inférieur. Les atomes libres auront plus d'énergie qu'un atome lié. En effet, une certaine quantité d'énergie est libérée pendant la formation de la liaison, ce qui permet à l'ensemble du système d'atteindre un état d'énergie inférieur. La longueur de liaison, ou la distance de séparation minimale entre deux atomes participant à la formation de la liaison, est déterminée par leurs forces répulsives et attractives le long de la direction internucléaire. À mesure que les deux atomes se rapprochent de plus en plus, les noyaux chargés positivement se repoussent, créant une force qui tente de séparer les atomes. Au fur et à mesure que les deux atomes s'éloignent l'un de l'autre, des forces attractives travaillent pour les rapprocher. Ainsi, une longueur de liaison d'équilibre est atteinte et constitue une bonne mesure de la stabilité de la liaison.
Biochimie
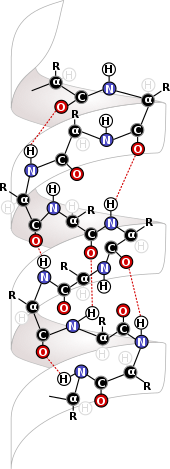
Les forces intramoléculaires sont extrêmement importantes dans le domaine de la biochimie, où elles interviennent aux niveaux les plus élémentaires des structures biologiques. Les forces intramoléculaires telles que les liaisons disulfure donnent aux protéines et à l' ADN leur structure. Les protéines tirent leur structure des forces intramoléculaires qui les façonnent et les maintiennent ensemble. La principale source de structure de ces molécules est l'interaction entre les résidus d' acides aminés qui forment la base des protéines. Les interactions entre les résidus des mêmes protéines forment la structure secondaire de la protéine, permettant la formation de feuillets bêta et d' hélices alpha , qui sont des structures importantes pour les protéines et dans le cas des hélices alpha, pour l'ADN.