Acide jasmonique - Jasmonic acid
|
|

|
|
| Noms | |
|---|---|
|
Nom IUPAC préféré
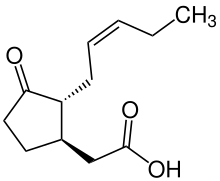
Acide [(1 R ,2 R )-3-Oxo-2-[(2 Z )-pent-2-én-1-yl]cyclopentyl]acétique |
|
| Autres noms
Acide jasmonique
(−)-Acide jasmonique JA, ( 1R,2R )-3-Oxo-2-( 2Z )-2-pentényl-cyclopentyléthane acide {(1R,2R)-3-Oxo-2-[(2Z)- acide 2-pentén-1-yl]cyclopentyl}acétique |
|
| Identifiants | |
|
Modèle 3D ( JSmol )
|
|
| ChEBI | |
| ChemSpider | |
|
CID PubChem
|
|
| UNII | |
|
Tableau de bord CompTox ( EPA )
|
|
|
|
|
|
| Propriétés | |
| C 12 H 18 O 3 | |
| Masse molaire | 210,27 g/mol |
| Densité | 1,1 g / cm 3 |
| Point d'ébullition | 160 °C (320 °F; 433 K) à 0,7 mmHg |
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Références de l'infobox | |
L'acide jasmonique ( JA ) est un composé organique présent dans plusieurs plantes dont le jasmin . La molécule fait partie de la classe des hormones végétales du jasmonate . Il est biosynthétisé à partir de l'acide linolénique par la voie des octadécanoïdes . Il a été isolé pour la première fois en 1957 sous forme d' ester méthylique de l'acide jasmonique par le chimiste suisse Edouard Demole et ses collègues.
Biosynthèse
Sa biosynthèse part de l'acide gras linolénique , qui est oxygéné par la Lipoxygénase (13-LOX), formant un peroxyde. Ce peroxyde se cyclise ensuite en présence d' allène oxyde synthase pour former un allène oxyde . Cet oxyde d'allène se réorganise lorsqu'il est catalysé par l'enzyme oxyde d'allène cyclase pour former de l'acide 12-oxophytodiénoïque et subit une série de -oxydations en acide 7-iso-jasmonique. En l'absence d'enzyme, cet acide iso-jasmonique s'isomérise en acide jasmonique.
Fonction
La fonction principale de l'AJ et de ses divers métabolites est de réguler les réponses des plantes aux stress abiotiques et biotiques ainsi que la croissance et le développement des plantes. Les processus de croissance et de développement RÉGULANT comprennent l' inhibition de la croissance, la sénescence , vrilles lovage, le développement des fleurs et la chute des feuilles. JA est également responsable de la formation de tubercules dans les pommes de terre et les ignames. Il a un rôle important dans la réponse aux blessures des plantes et à la résistance systémique acquise . Le gène Dgl est responsable du maintien des niveaux de JA dans les conditions habituelles de Zea mays ainsi que de la libération préliminaire d'acide jasmonique peu de temps après avoir été nourri. Lorsque les plantes sont attaquées par des insectes, elles réagissent en libérant du JA, qui active l'expression d' inhibiteurs de protéase , parmi de nombreux autres composés de défense anti-herbivores. Ces inhibiteurs de protéase empêchent l'activité protéolytique des protéases digestives ou "protéines salivaires" des insectes, les empêchant ainsi d'acquérir l'azote nécessaire dans la protéine pour leur propre croissance. JA active également l'expression de la Polyphénol oxydase qui favorise la production de Quinoléines . Ceux-ci peuvent interférer avec la production d'enzymes de l'insecte et diminuer le contenu nutritionnel de la plante ingérée.
JA peut jouer un rôle dans la lutte antiparasitaire. En effet, JA a été considéré comme un traitement de semences afin de stimuler les défenses naturelles anti-parasitaires des plantes qui germent à partir des semences traitées. Dans cette application, les jasmonates sont pulvérisés sur des plantes qui ont déjà commencé à pousser. Ces applications stimulent la production d'inhibiteur de protéase dans la plante. Cette production d'inhibiteur de protéase peut protéger la plante des insectes, en diminuant les taux d'infestation et les dommages physiques subis par les herbivores. Cependant, en raison de sa relation antagoniste avec l'acide salicylique (un signal important dans la défense contre les agents pathogènes) chez certaines espèces végétales, cela peut entraîner une sensibilité accrue aux agents viraux et autres agents pathogènes. Chez Zea mays , l'acide salicylique et l' AJ sont médiés par NPR1 (non-expresseur de gènes liés à la pathogenèse1), ce qui est essentiel pour empêcher les herbivores d'exploiter ce système antagoniste. Les chenilles légionnaires ( Spodoptera spp.), par des mécanismes inconnus, sont capables d'augmenter l'activité de la voie de l'acide salicylique dans le maïs, entraînant une diminution de la synthèse de JA, mais grâce à la médiation NPR1 , les niveaux de JA ne sont pas diminués de manière significative.
Dérivés
L' acide jasmonique est également converti en une variété de dérivés , dont l' ester méthyl jasmonate . Cette conversion est catalysée par l'enzyme acide jasmonique carboxyl méthyltransférase. Il peut également être conjugué à des acides aminés dans certains contextes biologiques. La décarboxylation donne le parfum apparenté au jasmone .
Les références
-
^
Demole, E.; Lederer, E.; Mercier, D. (1962). "Isolement et détermination de la structure du jasmonate de méthyle, constituant odorant caractéristique de l'essence de jasmin". Helvetica Chimica Acta (en français). 45 : 675-685. doi : 10.1002/hlca.19620450233 .
- Chapuis, Christian (décembre 2011). "La chimie et l'héritage créatif du jasmonate de méthyle et de l'hédione" . Parfumeur & Aromaticien . 36 : 36-48.
- ^ Dewick, Paul (2009). Produits naturels médicinaux : une approche biosynthétique . Royaume-Uni: John Wiley & Sons, Ltd. pp. 42 -53. ISBN 978-0-470-74168-9.
- ^ Delker, C.; Stenzel, I.; Hause, B. ; Miersch, O.; Feussner, I.; Wasternack, C. (2006). "La biosynthèse du jasmonate chez Arabidopsis thaliana - Enzymes, produits, régulation". Biologie végétale . 8 (3) : 297-306. doi : 10.1055/s-2006-923935 . PMID 16807821 .
- ^ Gális, I.; Gaquerel, E. ; Pandey, SP; Baldwin, INT (2009). « Mécanismes moléculaires sous-jacents à la mémoire des plantes dans les réponses de défense à médiation JA ». Plante, Cellule & Environnement . 32 (6) : 617-27. doi : 10.1111/j.1365-3040.2008.01862.x . PMID 18657055 .
- ^ Lutz, Diane (2012). Élément clé du système de réponse rapide des plantes révélé. Université de Washington à Saint-Louis. http://news.wustl.edu/news/Pages/23979.aspx
- ^ Zavala, JA; Patankar, AG; Gaz, K.; Hui, D.; Baldwin, IT (2004). "La manipulation de la production d'inhibiteurs endogènes de la trypsine protéinase chez Nicotiana attenuata démontre leur fonction en tant que défenses antiherbivores" . Physiologie végétale . 134 (3) : 1181–1190. doi : 10.1104/pp.103.035634 . PMC 389942 . PMID 14976235 .
- ^ Les effets des traitements bactériens et acides jasmoniques sur les insectes du canola . 2008.
- ^ "Succès pour la lutte antiparasitaire des plantes" . Nouvelles de la BBC . 2008-10-07 . Récupéré le 05-05-2010 .
- ^ Worrall, D.; Holroyd, GH; Moore, juge de paix ; Glowacz, M.; Croft, P.; Taylor, JE ; Paul, ND; Roberts, MR (2012). « Le traitement des semences avec des activateurs de défense des plantes génère un amorçage durable de la résistance aux ravageurs et aux agents pathogènes » (PDF) . Nouveau phytologue . 193 (3) : 770-778. doi : 10.1111/j.1469-8137.2011.03987.x . PMID 22142268 .
- ^ Agriculteur, EE; Johnson, RR ; Ryan, Californie (mars 1992). "Régulation de l'expression des gènes inhibiteurs de la protéinase par le jasmonate de méthyle et l'acide jasmonique" . Physiologie végétale . 98 (3) : 995-1002. doi : 10.1104/pp.98.3.995 . ISSN 0032-0889 . PMC 1080300 . PMID 16668777 .
- ^ Fouad, Hany Ahmed; El-Gepaly, Hosam Mohamed Khalil Hammam ; Fouad, Oussama Ahmed (2016-08-26). « La nanosilice et l'acide jasmonique comme méthodes alternatives pour le contrôle de Tuta absoluta (Meyrick) dans la culture de tomates dans des conditions de terrain ». Archives de phytopathologie et de protection des végétaux . 49 (13-14) : 362-370. doi : 10.1080/03235408.2016.1219446 . ISSN 0323-5408 . S2CID 89119004 .
- ^ Lyon, R.; Manners, JM; Kazan, K. (2013). « La biosynthèse et la signalisation du jasmonate chez les monocotylédones : un aperçu comparatif ». Rapports sur les cellules végétales . 32 (6) : 815–27. doi : 10.1007/s00299-013-1400-y . PMID 23455708 . S2CID 10778582 .
- ^ un b Ballaré, Carlos L. (2011). « Défenses induites par le jasmonate : Une histoire d'intelligence, de collaborateurs et de coquins ». Tendances en sciences végétales . 16 (5) : 249-57. doi : 10.1016/j.tplants.2010.12.001 . PMID 21216178 .
- ^ Seo, HS; Chanson, JT; Cheong, JJ; Lee, YH; Lee, YW ; Hwang, I.; Lee, JS ; Choi, YD (2001-04-10). « Acide jasmonique carboxyl méthyltransférase : une enzyme clé pour les réponses des plantes régulées par le jasmonate » . Actes de l'Académie nationale des sciences des États-Unis d'Amérique . 98 (8) : 4788-4793. Bibcode : 2001PNAS ... 98.4788S . doi : 10.1073/pnas.081557298 . ISSN 0027-8424 . PMC 31912 . PMID 11287667 .
- Sankawa, Ushio ; Barton, Derek RH ; Nakanishi, Koji ; Meth-Cohn, Otto, éd. (1999). Chimie complète des produits naturels : polykétides et autres métabolites secondaires, y compris les acides gras et leurs dérivés . Presse de Pergame. ISBN 978-0-08-043153-6.

