Bicarbonate de magnésium - Magnesium bicarbonate
|
|
| Noms | |
|---|---|
|
Nom IUPAC
Hydrogénocarbonate de magnésium
|
|
| Autres noms
Bicarbonate de magnésium
|
|
| Identifiants | |
|
Modèle 3D ( JSmol )
|
|
| ChemSpider | |
| Carte Info ECHA |
100.016.582 |
| Numéro CE | |
| Numéro E | E504 (ii) (régulateurs d'acidité, ...) |
|
PubChem CID
|
|
| UNII | |
|
Tableau de bord CompTox ( EPA )
|
|
|
|
|
|
| Propriétés | |
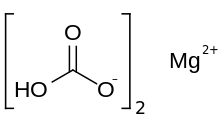
| Mg (HCO 3 ) 2 | |
| Masse molaire | 146,34 g / mol |
| 0,077 g / (100 ml) | |
| Composés apparentés | |
|
Autres cations
|
Bicarbonate de calcium |
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Références Infobox | |
Le bicarbonate de magnésium ou hydrogénocarbonate de magnésium , Mg ( H CO 3 ) 2 , est le sel de bicarbonate de magnésium . Il peut être formé par la réaction de solutions diluées d' acide carbonique (comme l' eau de Seltz ) et d'hydroxyde de magnésium (lait de magnésie).
Il peut être préparé par la synthèse d' acétate de magnésium et de bicarbonate de sodium Mg (CH3COO) 2 + 2NaHCO3 = Mg (HCO3) 2 + 2CH3COONa
Le bicarbonate de magnésium n'existe qu'en solution aqueuse. Le magnésium ne forme pas de bicarbonate solide comme le lithium. Pour le produire, une suspension d'hydroxyde de magnésium est traitée avec du dioxyde de carbone sous pression , produisant une solution de bicarbonate de magnésium:
- Mg (OH) 2 + 2 CO 2 → Mg (HCO 3 ) 2
Le séchage de la solution résultante provoque la décomposition du bicarbonate de magnésium , donnant du carbonate de magnésium , du dioxyde de carbone et de l'eau:
- Mg 2+ + 2 HCO 3 - → MgCO 3 + CO 2 + H 2 O
