Néosaxitoxine - Neosaxitoxin
|
|

|
|
| Noms | |
|---|---|
|
Nom IUPAC
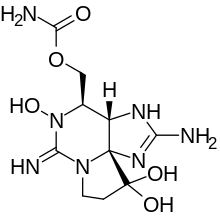
[(3aS,4R,10aS)-5,10,10-Trihydroxy-2,6-diiminooctahydro-1H,8H-pyrrolo[1,2-c]purin-4-yl]méthylcarbamate
|
|
| Autres noms
1H,10H-Pyrrolo(1,2-c)purine-10,10-diol, 2-amino-4-(((aminocarbonyl)oxy)méthyl)-3a,4,5,6,8,9-hexahydro- 5-hydroxy-6-imino-, (3aS,4R,10aS)-; 1H,10H-Pyrrolo(1,2-c)purine-10,10-diol, 2-amino-4-((aminocarbonyl)oxy)méthyl-3a,4,5,6,8,9-hexahydro-5- hydroxy-6-imino-,(3aS,4R,10aS)-; 1H,10H-Pyrrolo(1,2-c)purine-10,10-diol, 2-amino-4-((aminocarbonyl)oxy)méthyl-3a,4,5,6,8,9-hexahydro-5- hydroxy-6-imino-,(3aS-(3aalpha,4alpha,10aR*))-
|
|
| Identifiants | |
|
Modèle 3D ( JSmol )
|
|
| ChEBI | |
| ChemSpider | |
| Carte d'information de l'ECHA |
100.237.662 |
| KEGG | |
|
CID PubChem
|
|
| UNII | |
|
Tableau de bord CompTox ( EPA )
|
|
|
|
|
|
| Propriétés | |
| C 10 H 17 N 7 O 5 | |
| Masse molaire | 315.286 |
| Dangers | |
| Pictogrammes SGH |

|
| Mention d'avertissement SGH | Danger |
| H300 | |
| P264 , P270 , P301+310 , P321 , P330 , P405 , P501 | |
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa). |
|
| Références de l'infobox | |
La néosaxitoxine (NSTX) est incluse, comme d'autres analogues de la saxitoxine , dans un large groupe d'alcaloïdes neurotoxiques naturels, communément appelés toxines paralysantes des mollusques (PST). Le composé parent des PST, la saxitoxine (STX), est un alcaloïde perhydropurine tricyclique, qui peut être substitué à diverses positions, conduisant à plus de 30 analogues STX naturels. Tous sont des dérivés d'imidazoline guanidinium apparentés.
Sources
Le NSTX et d'autres PST sont produits par plusieurs espèces de dinoflagellés marins (eucaryotes) et de cyanobactéries d'eau douce, d'algues bleu-vert (procaryotes), qui peuvent former de vastes proliférations dans le monde entier. Dans des conditions particulières, pendant les proliférations d'algues nuisibles (HAB) ou la marée rouge , toutes ces toxines peuvent s'accumuler dans les mollusques filtreurs, tels que les moules, les palourdes et les huîtres, et peuvent provoquer une épidémie d' empoisonnement paralysant des mollusques (PSP).
Les analogues de la saxitoxine associés à la PSP peuvent être divisés en trois catégories :
- Composés de carbamate , y compris la saxitoxine, la néosaxitoxine et les gonyautoxines 1–4.
- Composés N-sulfocarbamoyle , y compris les toxines C et B.
- Composés décarbamoyle en ce qui concerne la présence ou l'absence de substitutions 1-N-hydroxyle, 11-hydroxysulfate et 21-N-sulfocarbamoyle ainsi que l'épimérisation en position C-11.
Structure et propriétés
La NSTX est assez similaire à la saxitoxine, comme toutes les neurotoxines associées à la PSP, la seule différence est que la NSTX présente un groupe hydroxyle lié à l'azote "1", où la saxitoxyne contient un hydrogène.
Cette purine est hautement hydrophile et thermostable, elle n'est pas détruite par la cuisson. De plus, est très stable dans le stockage habituel, spécialement dans des conditions acides.
Mécanisme d'action
NSTX bloque la partie extracellulaire, le vestibule externe, de certains canaux sodiques voltage-dépendants d'une manière très puissante et réversible, sans affecter les autres canaux ioniques.
Les canaux sodium « dépendants de la tension », également appelés « sensibles à la tension » et « dépendants de la tension » , également appelés « VGSC » ou « canal Nav » sont des éléments cruciaux de la physiologie normale chez une variété d'animaux, y compris les mouches, les sangsues, les calmars et les méduses, ainsi que les vertébrés mammifères et non mammifères. Cette grande protéine membranaire intégrale joue un rôle essentiel dans l'initiation et la propagation des potentiels d'action dans les neurones, les myocytes et autres cellules excitables.
Les canaux Nav forment la base de l'excitabilité électrique chez les animaux. Les canaux Nav ont évolué à partir des canaux Ca 2+ et étaient présents chez l'ancêtre commun des choanoflagellés et des animaux, bien que ce canal soit probablement perméable à la fois au Na + et au Ca 2+ . Ainsi, comme de nombreux autres canaux et récepteurs neuronaux, les canaux Nav ont précédé les neurones. Les invertébrés possèdent deux canaux Nav (Nav1 et Nav2), tandis que les canaux Nav des vertébrés appartiennent à la famille Nav1.
Les protéines des canaux sodiques dans le cerveau des mammifères sont composées d'une association qui comprend une sous-unité alpha et une ou plusieurs sous-unités bêta auxiliaires. Neuf types de sous-unités alpha ont été décrits (Na v 1.1 à Na v 1.9) et une dixième isoforme apparentée (Na x ) peut également jouer un certain rôle en tant que canal Nav. Sur la base de ces informations, dix classes Nav peuvent être décrites : Na v 1.1 à Na v 1.9 et Na x .
Cinq anciens, mais plus récemment, six sites récepteurs de neurotoxines ont été reconnus entre les sept sites récepteurs situés dans la sous-unité alpha du récepteur des canaux sodiques des vertébrés :
- Le site 1 lie les bloqueurs des canaux sodiques tétrodotoxine et saxitoxine.
- Le site 2 se lie aux activateurs des canaux sodiques liposolubles tels que la vératridine.
- Le site 3 se lie aux toxines alpha-scorpion et anémone de mer, qui ralentissent l'inactivation des canaux sodiques.
- Le site 4 se lie aux toxines bêta-scorpion, qui affectent l'activation des canaux sodiques.
- Le site 5 lie les brévétoxines et la ciguatoxine de l'échelle polyéther.
- Le site 6 se lie à la delta-conotoxine.
- Le site récepteur de l'anesthésique local se lie aux anesthésiques locaux, aux antiarythmiques et aux antiépileptiques
NSTX et d'autres bloqueurs du site 1 ont une affinité élevée (constante de dissociation très faible) et une spécificité élevée pour les canaux Nav. L'action de NSTX produit un effet minimal sur Nav cardiaque, où il présente une affinité environ 20 à 60 fois moindre que dans les canaux Nav du muscle squelettique et du cerveau du rat. La plupart des données mettent l'accent sur le rôle du canal Na v 1.5 "résistant à STX" dans le cœur humain.
Les toxines telles que la néosaxitoxine et la tétrodotoxine ont moins d'affinité pour la plupart des canaux Nav cardiaques que pour la plupart des canaux Nav dans le tissu nerveux. De plus, le NSTX est tellement actif sur le canal nerveux Nav qu'il est environ un million de fois plus puissant que la lidocaïne.
Effets sur les humains
Ce mécanisme d'action peut produire deux types d'effets bien connus chez l'homme :
Effet toxique, associé aux taux plasmatiques de NSTX
Elle peut être approximativement décrite en utilisant l'un des modèles classiques de maladie neurotoxique, connue depuis l'Antiquité sous le nom de marée rouge, la prolifération d'algues la plus nocive (HAB). Ce modèle clinique bien connu est l'"intoxication paralysante par les mollusques".
Bien sûr, il existe de grandes différences entre les différentes proliférations d'algues, en raison du mélange d'espèces incluses dans chaque HAB, généralement lié aux conditions environnementales ; en raison des niveaux et de la qualité des PST produits dans chaque HAB, qui peuvent être modulés par des micro-organismes concurrents ; et, last but not least, en raison des propriétés spécifiques de chaque type de PST, par exemple :
- Les brévétoxines sont des toxines marines polyéthers liposolubles (hydrophobes); leur effet prédominant est excitateur (bloqué par la tétrodotoxine), médié par l'augmentation de l' influx cellulaire de Na + ; et se lient au site 5 sur Nav (comme la ciguatoxine).
- La toxicité de la tétrodotoxine (TTX) est associée à des effets cardiovasculaires marqués et surprenants (c'est-à-dire : hypotension et bradycardie). Ces effets sont inattendus en raison de la résistance notoire à la TTX observée dans le canal Nav cardiaque des vertébrés. De plus, cette caractéristique du canal Nav cardiaque des mammifères est attribuée à la prédominance cardiaque de l'isoforme du canal Nav résistant à la TTX (Na v 1.5). Au contraire, comme on le suppose sur des bases physiologiques, la NSTX ne produit que des anomalies cardiovasculaires légères et transitoires lors d'une intoxication expérimentale (il n'y a pas de données sur la toxicité clinique pure de la NSTX).
- STX a deux charges positives, contrairement à la charge unique de TTX et à GTX2/3, un congénère STX naturel avec une charge nette de +1. Compte tenu de leurs structures assez différentes, il n'est pas surprenant que STX et TTX se lient de manière différente aux VGSC. En fait, lorsque Phe 385 près du filtre de sélectivité de Na v 1.2 est muté en Cys, l'affinité du canal pour TTX est réduite de 3000 fois, alors que celle pour STX est réduite (seulement) de 340 fois.
- Il existe très peu de données sur la puissance relative des différents PST, et il est urgent de développer des méthodes alternatives aux essais biologiques sur les animaux pour la détection des toxines marines.
Malgré son épidémiologie hétérogène et mal connue, le tableau clinique de la PSP pourrait être utile pour anticiper les effets cliniques de la NSTX systémique.
- Dans la situation la plus fréquente et la plus bénigne, le patient ne souffre que de paresthésies légères et de courte durée de la bouche ou des extrémités.
- Dans les cas modérés, des picotements péribuccaux évoluant vers un engourdissement s'étendant au visage et au cou peuvent être observés.
- Dans les cas graves, le patient peut souffrir d'apnée secondaire à un bloc moteur, nécessitant une ventilation mécanique.
Habituellement, les victimes d'intoxications aiguës légères et graves éliminent la toxine dans les urines au cours des 24 premières heures suivant l'ingestion et se rétablissent complètement dès le premier jour de soins intra-hospitaliers (lorsqu'un soutien vital est fourni en temps opportun).
Lorsque des épidémies de PSP surviennent dans des régions éloignées, où l'assistance médicale est limitée, la létalité signalée est inférieure à 10 % chez les adultes, mais peut atteindre 50 % chez les enfants de moins de six ans. Cette différence pourrait être secondaire à des doses et à une composition différentes des mélanges impliqués de PST ; retard dans le soutien médical; ou une sorte de susceptibilité des enfants. Des informations plus récentes suggèrent que la létalité pourrait être d'environ 1% des patients symptomatiques, y compris les cas où le transport aérien était nécessaire depuis des endroits éloignés de l'Alaska.
Les observations électrophysiologiques ont démontré des anomalies subcliniques durant quelques jours ou semaines après la guérison clinique.
Certaines preuves suggèrent la présence de voies métaboliques pour l'oxydation séquentielle et la glucuronidation de la PST in vitro, les deux étant les réactions de détoxication initiales pour l'excrétion de ces toxines chez l'homme.
L'analyse médico-légale des décès après des cas graves conclut que les toxines PSP sont métaboliquement transformées par l'homme et qu'elles sont éliminées du corps par excrétion dans l'urine et les fèces comme tout autre composé xénobiotique.
Compte tenu de la nature hétérogène des mélanges de toxines contenus dans les mollusques bivalves contaminés, la limite de sécurité de la teneur en toxines dans les coquillages adéquats pour l'ingestion humaine est exprimée en « équivalents saxitoxines ». Selon l'Organisation des Nations Unies pour l'alimentation et l'agriculture (FAO) et le Parlement européen, cette limite est de 80 microgrammes d'équivalent saxitoxine pour 100 grammes de chair de moule (chaque moule pèse environ 23 g). La Food and Drug Administration des États-Unis étend la même définition à la qualité du "poisson", mais le terme "poisson" fait référence aux poissons à nageoires d'eau douce ou salée, aux crustacés, à d'autres formes d'animaux aquatiques autres que les oiseaux ou les mammifères, et à tous les mollusques ; et incorporer l'utilisation de « ppm » comme autre mesure de la concentration équivalente de saxitoxine dans les aliments mentionnés.
Paradoxalement, l'exposition chronique et/ou répétée aux toxines marines des produits de la mer, qui est un phénomène beaucoup plus réaliste, n'a pas été complètement étudiée. Une étude chez des rats exposés à une administration chronique (12 semaines) de NSTX a démontré une certaine réduction de la consommation d'eau et de nourriture, et un léger degré de cholestase transitoire, probablement associée au jeûne, sans autres anomalies.
Effet anesthésique, produit par l'infiltration locale de NSTX
Cette action a été démontrée chez l'animal et l'homme.
L'utilisation médicale de l'effet anesthésique NSTX est soutenue par trois raisons :
- Durée de l'anesthésie NSTX :
- Tout anesthésique local actuellement disponible produit à peine des effets cliniques 12 heures après une seule injection. Ensuite, en cas de douleur intense ou prolongée, certains patients ont besoin d'injections répétées, de cathéters, de pompes et d'opioïdes pour se sentir à l'aise, avec différents types d'effets secondaires, de coûts et de risques.
- D'autre part, l'infiltration locale de NSTX produit une anesthésie de longue durée, bien supérieure à tous les anesthésiques locaux actuellement disponibles. Certaines investigations ont démontré un effet anesthésique durant plus d'une semaine après une seule injection chez les rongeurs, en utilisant une formulation à libération prolongée, sans séquelles histologiques ou fonctionnelles.
- De plus, deux rapports humains ont démontré une forte potentialisation entre l'effet anesthésique du NSTX, la bupivacaïne et l' épinéphrine .
- Sécurité locale NSTX :
- Tous les anesthésiques locaux disponibles sont associés à des dommages locaux dans différents modèles. Cet effet indésirable pourrait être renforcé par des formulations à libération prolongée.
- Au contraire, plusieurs investigations montrent l'innocuité locale des neurotoxines liées à la saxitoxine, y compris des modèles très sensibles, et il n'y a aucune raison de présumer le contraire pour la NSTX.
- Sécurité systémique NSTX :
- Malgré les progrès des injections guidées par ultrasons, la toxicité aiguë des anesthésiques locaux systémiques reste un problème clinique non résolu et peut avoir des conséquences dévastatrices, liées aux effets neurologiques et cardiovasculaires de tous les anesthésiques locaux disponibles.
- Sinon, l'expérience clinique et les modèles animaux montrent la sécurité relative de l'intoxication accidentelle et expérimentale au NSTX (lorsqu'un traitement de soutien approprié est fourni en temps opportun).
- Une étude récente chez le mouton montre une limite de sécurité, due au bloc moteur, supérieure à 1 µg/kg pour l'injection intraveineuse de NSTX, avec une récupération complète après un bref cycle de ventilation mécanique.
- En ce qui concerne la sécurité systémique, les saxitoxines diffusent à travers la barrière hémato-encéphalique , mais, en raison de la spécificité des canaux Nav, la toxicité aiguë est associée à un très faible risque de convulsions. Ceci établit une différence importante avec la toxicité actuelle des anesthésiques locaux.
- Comme on pouvait le prédire à partir de sa sélectivité des canaux ioniques, le tableau clinique de l'intoxication au NSTX est presque dépourvu d'arythmies, établissant une autre différence avec les nombreux effets cardiaques de l'anesthésique local disponible.
- Et enfin, un certain degré d'amélioration de l'index thérapeutique du NSTX peut être observé lorsqu'il est mélangé avec de la bupivacaïne et/ou de l'épinéphrine.
En conclusion, la NSTX est une molécule bien définie avec une relation durable et parfois dangereuse avec les sujets humains. Des recherches récentes suggèrent une application clinique en tant que nouvel anesthésique local qui semble « trop beau pour être vrai », mais une enquête plus approfondie est nécessaire.
