Organisation nucléaire - Nuclear organization
L'organisation nucléaire fait référence à la distribution spatiale de la chromatine au sein d'un noyau cellulaire . Il existe de nombreux niveaux et échelles d'organisation nucléaire. La chromatine est une structure d'ordre supérieur de l'ADN.
À la plus petite échelle, l' ADN est conditionné en unités appelées nucléosomes . La quantité et l'organisation de ces nucléosomes peuvent affecter l'accessibilité de la chromatine locale. Cela a un effet d' entraînement sur l'expression des gènes voisins , déterminant en outre s'ils peuvent ou non être régulés par des facteurs de transcription .
À des échelles légèrement plus grandes, la boucle d'ADN peut physiquement rassembler des éléments d'ADN qui seraient autrement séparés par de grandes distances. Ces interactions permettent aux signaux de régulation de traverser de grandes distances génomiques, par exemple, des amplificateurs aux promoteurs .
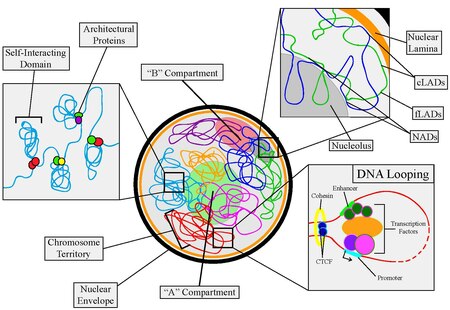
En revanche, à grande échelle, la disposition des chromosomes peut déterminer leurs propriétés. Les chromosomes sont organisés en deux compartiments étiquetés A ("actif") et B ("inactif"), chacun ayant des propriétés distinctes. De plus, des chromosomes entiers se séparent en régions distinctes appelées territoires chromosomiques .
Importance
Chaque cellule humaine contient environ deux mètres d' ADN , qui doit être étroitement replié pour s'adapter à l'intérieur du noyau de la cellule . Cependant, pour que la cellule fonctionne, les protéines doivent pouvoir accéder à l'information de séquence contenue dans l'ADN, malgré sa nature compacte. Par conséquent, la cellule dispose d'un certain nombre de mécanismes pour contrôler l'organisation de l'ADN.
De plus, l'organisation nucléaire peut jouer un rôle dans l'établissement de l'identité cellulaire. Les cellules d'un organisme ont des séquences d'acides nucléiques presque identiques , mais présentent souvent des phénotypes différents . Une façon dont cette individualité se produit est par des changements dans l' architecture du génome , qui peuvent modifier l' expression de différents ensembles de gènes . Ces altérations peuvent avoir un effet en aval sur les fonctions cellulaires telles que la facilitation du cycle cellulaire , la réplication de l'ADN , le transport nucléaire et l'altération de la structure nucléaire . Des changements contrôlés dans l'organisation nucléaire sont essentiels au bon fonctionnement cellulaire.
Histoire et méthodologie
L'organisation des chromosomes en régions distinctes au sein du noyau a été proposée pour la première fois en 1885 par Carl Rabl . Plus tard en 1909, avec l'aide de la technologie de microscopie de l'époque, Theodor Boveri a inventé les territoires chromosomiques après avoir observé que les chromosomes occupent des régions nucléaires distinctes individuellement. Depuis lors, la cartographie de l'architecture du génome est devenue un sujet d'intérêt majeur.
Au cours des dix dernières années, des développements méthodologiques rapides ont considérablement fait progresser la compréhension dans ce domaine. L'organisation de l'ADN à grande échelle peut être évaluée avec l'imagerie de l'ADN à l'aide d'étiquettes fluorescentes, telles que l'hybridation in situ par fluorescence de l'ADN (FISH) et des microscopes spécialisés. De plus, les technologies de séquençage à haut débit telles que les méthodes basées sur la capture de la conformation chromosomique peuvent mesurer la fréquence à laquelle les régions d'ADN sont à proximité immédiate. Dans le même temps, les progrès des techniques d' édition du génome (telles que CRISPR/Cas9 , ZFN et TALEN ) ont facilité le test de la fonction organisationnelle de régions d'ADN et de protéines spécifiques. On s'intéresse également de plus en plus aux propriétés rhéologiques de l'espace interchromosomique, étudiées au moyen de la spectroscopie de corrélation de fluorescence et de ses variantes.
Protéines architecturales
Les protéines architecturales régulent la structure de la chromatine en établissant des interactions physiques entre les éléments de l'ADN. Ces protéines ont tendance à être hautement conservées chez une majorité d'espèces eucaryotes.
Chez les mammifères, les protéines architecturales clés comprennent :
- Histones : l'ADN est enroulé autour des histones pour former des nucléosomes , qui sont des unités de base de la structure de la chromatine. Chaque nucléosome se compose de 8 sous-unités de protéines histones, autour desquelles environ 147 paires de bases d'ADN sont enroulées en 1,67 tours gauchers. Au total, les nucléosomes emballent environ 2 mètres d'ADN double brin dans un noyau de 10 µm de diamètre. La concentration et la composition spécifique des histones utilisées peuvent déterminer la structure locale de la chromatine. Par exemple, l' euchromatine est une forme de chromatine avec une faible concentration de nucléosomes - ici, l'ADN est exposé, favorisant les interactions avec l'expression des gènes, la réplication et la machinerie organisationnelle. En revanche, l' hétérochromatine a une concentration élevée en nucléosomes et est associée à la répression de l'expression et de la réplication des gènes, car les protéines nécessaires ne peuvent pas interagir avec l'ADN.
- Enzymes de remodelage de la chromatine : ces enzymes sont responsables de la promotion de la formation d'euchromatine ou d'hétérochromatine par un certain nombre de processus, en particulier la modification des queues d'histone ou le déplacement physique des nucléosomes. Cela aide à son tour à réguler l'expression des gènes, la réplication et la façon dont la chromatine interagit avec les facteurs architecturaux. La liste des enzymes de remodelage de la chromatine est longue et nombre d'entre elles ont des rôles spécifiques au sein du noyau. Par exemple, en 2016, Wiechens et al. ont identifié deux enzymes humaines, SNF2H et SNF2L, qui sont actives dans la régulation de la liaison au CTCF et affectent donc l'organisation du génome et la transcription de nombreux gènes.
- Le facteur de liaison CCCTC (CTCF) , ou protéine à doigt 11-zinc, est considéré comme l'acteur le plus important pour lier l'organisation du génome à l'expression des gènes. CTCF interagit avec des séquences d'ADN spécifiques et une variété d'autres protéines architecturales, principalement la cohésine - ces comportements lui permettent de médier la boucle de l'ADN, agissant ainsi comme répresseur, activateur et isolant transcriptionnel . De plus, le CTCF se trouve souvent aux limites des domaines à interaction automatique et peut ancrer la chromatine à la lame nucléaire. Le CTCF est également impliqué dans la recombinaison V(D)J .
- Cohésine : Le complexe de cohésine a été initialement découvert comme un acteur clé de la mitose , liant les chromatides sœurs ensemble pour assurer une ségrégation appropriée. Cependant, la cohésine a depuis été liée à de nombreuses autres fonctions au sein de la cellule. Il s'est avéré qu'il aidait à faciliter la réparation et la recombinaison de l'ADN, l'appariement et l'orientation des chromosomes méiotiques, la condensation des chromosomes, la réplication de l'ADN, l'expression des gènes et l'architecture du génome. La cohésine est un hétérodimère composé des protéines SMC1 et SMC3 en combinaison avec les protéines SCC1 et SCC3. Le complexe entier est chargé sur l'ADN par le complexe NIPBL-MAU2 à la manière d'un anneau.
Niveaux d'organisation nucléaire
ADN linéaire et bases chromosomiques
Le premier niveau d'organisation du génome concerne la façon dont l'ADN est arrangé linéairement et comment il est emballé dans les chromosomes . L'ADN est composé de deux brins antiparallèles d'acides nucléiques, avec deux acides nucléiques liés et opposés appelés paires de bases d'ADN. Pour que l'ADN se tasse à l'intérieur du noyau cellulaire minuscule, chaque brin est enroulé autour des histones , formant des structures de nucléosomes . Ces nucléosomes se regroupent pour former des chromosomes . Selon l'eucaryote, il existe plusieurs chromosomes indépendants de tailles variables dans chaque noyau - par exemple, les humains en ont 46 tandis que les girafes en ont 30.
Dans les régions du chromosome, l'ordre des paires de bases d'ADN constitue des éléments spécifiques pour l'expression des gènes et la réplication de l'ADN. Certains des éléments les plus courants incluent les gènes codant pour les protéines (contenant des exons et des introns), l'ADN non codant, les amplificateurs, les promoteurs, les opérateurs, les origines de réplication, les télomères et les centromères. Pour l'instant, il n'y a pas beaucoup de preuves de l'importance de l'ordre spécifique de ces éléments le long ou entre les chromosomes individuels. Par exemple, la distance entre un amplificateur et un promoteur, éléments en interaction qui forment une base de l'expression génique, peut aller de quelques centaines de paires de bases à des centaines de kb. De même, des amplificateurs individuels peuvent interagir avec un certain nombre de promoteurs différents et il en va de même pour un seul promoteur interagissant avec plusieurs amplificateurs différents.
Cependant, à plus grande échelle, les chromosomes sont hétérogènes dans le contexte de la composition de l'euchromatine et de l'hétérochromatine. De plus, il existe des preuves de régions riches et pauvres en gènes et de divers domaines associés à la différenciation cellulaire, à l'expression génique active ou réprimée, à la réplication de l'ADN et à la recombinaison et à la réparation de l'ADN. Tous ces éléments aident à déterminer les territoires chromosomiques.
boucle d'ADN
La boucle d'ADN est le premier niveau d'organisation nucléaire qui implique le repliement chromosomique. Dans un événement de bouclage de l'ADN, la chromatine forme des boucles physiques, mettant les régions de l'ADN en contact étroit. Ainsi, même des régions très éloignées le long du chromosome linéaire peuvent être réunies dans un espace tridimensionnel. Le processus est facilité par un certain nombre de facteurs, notamment les protéines architecturales (principalement le CTCF et la cohésine), les facteurs de transcription, les co-activateurs et les ARNnc. Il est important de noter que le bouclage de l'ADN peut être utilisé pour réguler l'expression des gènes - les événements de bouclage peuvent réprimer ou activer les gènes, selon les éléments impliqués. On pense qu'environ 50 % des gènes humains sont impliqués dans les interactions à longue distance de la chromatine par le biais du processus de bouclage de l'ADN.
Le bouclage a été observé pour la première fois par Walther Flemming en 1878 alors qu'il étudiait les ovocytes d'amphibiens. Ce n'est qu'à la fin du 20e siècle que la boucle de l'ADN a été corrélée à l'expression des gènes. Par exemple, en 1990, Mandal et ses collègues ont montré l'importance de la boucle d'ADN dans la répression des opérons galactose et lactose dans E coli . En présence de galactose ou de lactose, les protéines répresseurs forment des interactions protéine-protéine et protéine-ADN pour boucler l'ADN. Cela relie à son tour les promoteurs de gènes aux opérateurs en amont et en aval, réprimant efficacement l'expression des gènes en bloquant l' assemblage du complexe de pré-initiation de la transcription (PIC) au niveau du promoteur et empêchant ainsi l'initiation de la transcription.
Dans l'activation des gènes, la boucle d'ADN rassemble généralement des promoteurs et des amplificateurs de gènes distaux. Les activateurs peuvent recruter un grand complexe de protéines, telles que le complexe médiateur , PIC et d'autres facteurs de transcription spécifiques à la cellule, impliqués dans l'initiation de la transcription d'un gène.
Domaines chromosomiques
Domaines à interaction automatique
Les domaines d'auto-interaction (ou d'auto-association) se trouvent dans de nombreux organismes - chez les bactéries, ils sont appelés domaines d'interaction chromosomique (CID), tandis que dans les cellules de mammifères, ils sont appelés domaines d'association topologique (TAD). Les domaines d'auto-interaction peuvent aller de l'échelle de 1 à 2 mb dans les organismes plus grands à 10 s de kb dans les organismes unicellulaires. Ce qui caractérise un domaine auto-interactif est un ensemble de caractéristiques communes. La première est que les domaines à interaction automatique ont un rapport plus élevé de contacts chromosomiques à l'intérieur du domaine qu'à l'extérieur. Ils sont formés à l'aide de protéines architecturales et contiennent en leur sein de nombreuses boucles de chromatine. Cette caractéristique a été découverte en utilisant des techniques Hi-C. Deuxièmement, les domaines d'auto-interaction sont en corrélation avec la régulation de l'expression des gènes. Il existe des domaines spécifiques associés à la transcription active et d'autres domaines qui répriment la transcription. Ce qui distingue si un domaine prend une forme particulière dépend des gènes associés qui doivent être actifs/inactifs pendant une phase particulière de croissance, une étape du cycle cellulaire ou au sein d'un type cellulaire spécifique. La différenciation cellulaire est déterminée par des ensembles particuliers de gènes activés ou désactivés, correspondant à la composition unique des domaines d'auto-interaction d'une cellule individuelle. Enfin, les limites extérieures de ces domaines contiennent une fréquence plus élevée de sites de liaison aux protéines architecturales, de régions et de marques épigénétiques corrélées à la transcription active, aux gènes d'entretien et aux éléments nucléaires à espacement court (SINE).
Un exemple d'un sous-ensemble de domaines d'auto-interaction est les hubs de chromatine actifs (ACH). Ces hubs ont été découverts lors de l'observation de loci activés pour l'alpha- et la bêta-globine. Les ACHs sont formées par une boucle d'ADN étendue pour former un "hub" d'éléments régulateurs afin de coordonner l'expression d'un sous-ensemble de gènes.
Domaines d'association lamina et domaines d'association nucléolaire
Les domaines d'association à la lamina (LAD) et les domaines d'association nucléolaire (NAD) sont des régions du chromosome qui interagissent avec la lamina nucléaire et le nucléole, respectivement.
Constituant environ 40 % du génome, les LAD se composent principalement de régions pauvres en gènes et ont une taille comprise entre 40 Ko et 30 Mb. Il existe deux types de LAD connus : les LAD constitutifs (cLAD) et les LAD facultatifs (fLAD). Les cLAD sont des régions d'hétérochromatine riches en AT qui restent sur la lame et sont observées dans de nombreux types de cellules et d'espèces. Il existe des preuves que ces régions sont importantes pour la formation structurelle du chromosome d'interphase. D'autre part, les fLAD ont des interactions de lamina variables et contiennent des gènes qui sont soit activés soit réprimés entre les cellules individuelles, indiquant une spécificité de type cellulaire. Les limites des LAD, comme les domaines d'auto-interaction, sont enrichies en éléments transcriptionnels et en sites de liaison aux protéines architecturales.
Les NAD, qui constituent 4 % du génome, partagent presque toutes les mêmes caractéristiques physiques que les LAD. En fait, l'analyse de l'ADN de ces deux types de domaines a montré que de nombreuses séquences se chevauchent, indiquant que certaines régions peuvent basculer entre la liaison à la lame et la liaison au nucléole. Les NAD sont associés à la fonction nucléole. Le nucléole est le plus grand sous-organite du noyau et est le site principal de la transcription de l'ARNr. Il agit également dans la biosynthèse des particules de reconnaissance du signal, la séquestration des protéines et la réplication virale. Le nucléole se forme autour des gènes d'ADNr de différents chromosomes. Cependant, seul un sous-ensemble de gènes d'ADNr est transcrit à la fois et le fait en boucle à l'intérieur du nucléole. Le reste des gènes se trouve à la périphérie de l'organite subnucléaire à l'état d'hétérochromatine silencieuse.
Compartiments A/B
Les compartiments A/B ont été découverts pour la première fois dans les premières études Hi-C . Les chercheurs ont remarqué que l'ensemble du génome pouvait être divisé en deux compartiments spatiaux, étiquetés « A » et « B », où les régions du compartiment A ont tendance à interagir préférentiellement avec les régions associées au compartiment A qu'avec celles associées au compartiment B. De même, les régions du compartiment B ont tendance à s'associer à d'autres régions associées au compartiment B.
Les régions associées aux compartiments A/B sont sur l'échelle multi-Mb et sont en corrélation avec la chromatine ouverte et active pour l'expression (compartiments "A") ou la chromatine fermée et inactive pour l'expression (compartiments "B"). Les compartiments A ont tendance à être riches en gènes, ont une teneur élevée en GC, contiennent des marqueurs histones pour la transcription active et déplacent généralement l'intérieur du noyau. De plus, ils sont généralement constitués de domaines à interaction automatique et contiennent des origines de réplication précoces. Les compartiments B, d'autre part, ont tendance à être pauvres en gènes, compacts, contiennent des marqueurs histones pour le silençage génique et se situent à la périphérie nucléaire. Ils se composent principalement de LAD et contiennent des origines de réplication tardives. De plus, une haute résolution Hi-C couplée à des méthodes d'apprentissage automatique a révélé que les compartiments A/B peuvent être affinés en sous-compartiments.
Le fait que les compartiments interagissent eux-mêmes est cohérent avec l'idée que le noyau localise les protéines et d'autres facteurs tels que l' ARN long non codant (lncRNA) dans des régions adaptées à leurs rôles individuels. Un exemple de ceci est la présence de multiples usines de transcription dans tout l'intérieur du nucléaire. Ces usines sont associées à des niveaux élevés de transcription en raison de la forte concentration de facteurs de transcription (tels que la machinerie des protéines de transcription, les gènes actifs, les éléments régulateurs et l'ARN naissant). Environ 95% des gènes actifs sont transcrits au sein d'usines de transcription. Chaque usine peut transcrire plusieurs gènes - ces gènes n'ont pas besoin d'avoir des fonctions de produit similaires, ni de se trouver sur le même chromosome. Enfin, la colocalisation des gènes au sein des usines de transcription est connue pour dépendre du type cellulaire.
Territoires chromosomiques

Le dernier niveau d'organisation concerne le positionnement distinct des chromosomes individuels au sein du noyau. La région occupée par un chromosome est appelée territoire chromosomique (CT). Chez les eucaryotes, les CT ont plusieurs propriétés communes. Premièrement, bien que les emplacements chromosomiques ne soient pas les mêmes d'une cellule à l'autre d'une population, il existe une certaine préférence parmi les chromosomes individuels pour des régions particulières. Par exemple, les grands chromosomes pauvres en gènes sont généralement situés à la périphérie près de la lame nucléaire, tandis que les chromosomes plus petits et riches en gènes se regroupent plus près du centre du noyau. Deuxièmement, la préférence chromosomique individuelle est variable selon les différents types de cellules. Par exemple, le chromosome X a montré qu'il se localisait plus souvent à la périphérie dans les cellules hépatiques que dans les cellules rénales. Une autre propriété conservée des territoires chromosomiques est que les chromosomes homologues ont tendance à être éloignés les uns des autres pendant l'interphase cellulaire. La dernière caractéristique est que la position des chromosomes individuels au cours de chaque cycle cellulaire reste relativement la même jusqu'au début de la mitose. Les mécanismes et les raisons derrière les caractéristiques du territoire chromosomique sont encore inconnus et des expérimentations supplémentaires sont nécessaires.
Les références
Liens externes
-
 Médias liés à l'organisation nucléaire à Wikimedia Commons
Médias liés à l'organisation nucléaire à Wikimedia Commons