Oléfination de Peterson - Peterson olefination
| Oléfination de Peterson | |
|---|---|
| Nommé après | Donald John Peterson |
| Type de réaction | Réaction de couplage |
| Identifiants | |
| Portail de la chimie organique | peterson-oléfination |
| ID d'ontologie RSC | RXNO: 0000080 |
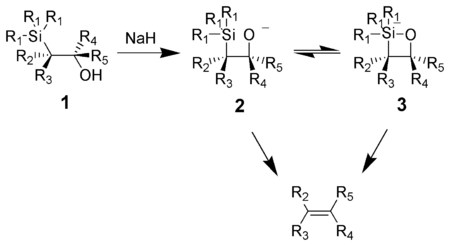
L' oléfination de Peterson (également appelée réaction de Peterson ) est la réaction chimique des α-silyl carbanions ( 1 dans le diagramme ci-dessous) avec des cétones (ou aldéhydes ) pour former un β-hydroxysilane ( 2 ) qui élimine pour former des alcènes ( 3 ).
Plusieurs revues ont été publiées.
Mécanisme de réaction
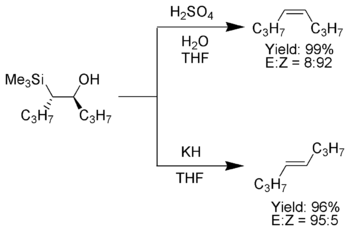
Une caractéristique intéressante de l'oléfination de Peterson est qu'elle peut être utilisée pour préparer des alcènes cis ou trans à partir du même ß-hydroxysilane. Le traitement du ß-hydroxysilane avec un acide donnera un alcène, tandis que le traitement du même ß-hydroxysilane avec une base donnera l'alcène de stéréochimie opposée.
Élimination de base
L'action de la base sur un ß-hydroxysilane ( 1 ) conduit à une élimination syn concertée de ( 2 ) ou ( 3 ) pour former l'alcène souhaité. L' intermédiaire silicate penta-coordonné ( 3 ) est postulé, mais aucune preuve n'existe à ce jour.
Les alcoolates de potassium éliminent rapidement, tandis que les alcoolates de sodium nécessitent généralement un chauffage. Les alcoxydes de magnésium ne sont éliminés que dans des conditions extrêmes. L'ordre de réactivité des alcoxydes, K> Na >> Mg, est cohérent avec une densité d'électrons plus élevée sur l' oxygène , augmentant ainsi la nucléophilie des alcoxydes.
Élimination acide
Le traitement du β-hydroxysilane ( 1 ) avec de l'acide entraîne une protonation et une anti- élimination pour former l'alcène souhaité.
Substituants alkyle
Lorsque l'α-silyl carbanion ne contient que des substituants alkyle , hydrogène ou donneurs d'électrons , le résultat stéréochimique de l'oléfination de Peterson peut être contrôlé, car à basse température, l'élimination est lente et le β-hydroxysilane intermédiaire peut être isolé.
Une fois isolés, les β-hydroxysilanes diastéréoisomères sont séparés. Un diastéréoisomère est traité avec de l'acide, tandis que l'autre est traité avec une base, convertissant ainsi le matériau en un alcène avec la stéréochimie requise.
Substituants attracteurs d'électrons
Lorsque l'a-silyl carbanion contient des substituants attracteurs d'électrons, l'oléfination de Peterson forme directement l'alcène. Le β-hydroxysilane intermédiaire ne peut pas être isolé car il est éliminé in situ . La voie d'élimination de base a été postulée dans ces cas.
Variations
Les conditions d'élimination acide ne sont parfois pas réalisables car l'acide favorise également l' isomérisation de la double liaison . De plus, l'élimination à l' aide d' hydrure de sodium ou de potassium peut ne pas être possible en raison de groupes fonctionnels incompatibles . Chan et coll. ont trouvé que l'acylation du silylcarbinol intermédiaire avec du chlorure d'acétyle ou du chlorure de thionyle donne un ester ß-silylique qui s'élimine spontanément à 25 ° C en donnant l'alcène souhaité. Corey et ses collègues ont développé une méthode (parfois appelée oléfination Corey-Peterson ) utilisant une imine silylée pour produire un aldéhyde α, β-insaturé à partir d'un composé carbonyle en une seule étape. Pour un exemple de son utilisation en synthèse totale, voir: Synthèse totale Kuwajima Taxol