Sodium tert - butylate -Sodium tert-butoxide

|
|
| Noms | |
|---|---|
|
Nom IUPAC préféré
Sodium tert - butylate |
|
| Autres noms | |
| Identifiants | |
|
Modèle 3D ( JSmol )
|
|
| ChemSpider | |
| Carte d'information de l'ECHA |
100.011.584 |
|
CID PubChem
|
|
|
Tableau de bord CompTox ( EPA )
|
|
|
|
|
|
| Propriétés | |
| C 4 H 9 Na O | |
| Masse molaire | 96,105 g·mol -1 |
| Densité | 1,025 g / cm 3 |
| Acidité (p K a ) | 19 |
| Dangers | |
| Fiche de données de sécurité | [1] |
| point de rupture | 14 °C (57 °F; 287 K) |
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Références de l'infobox | |
Le tert- butoxyde de sodium est le composé chimique de formule (CH 3 ) 3 CONa. C'est une base forte et une base non nucléophile . Il est inflammable et sensible à l'humidité. Il est parfois écrit dans la littérature chimique sous le nom de t- butoxyde de sodium . Sa réactivité est similaire au tert- butoxyde de potassium plus courant .
Le composé peut être produit en traitant l' alcool tert- butylique avec de l'hydrure de sodium .
Réactions
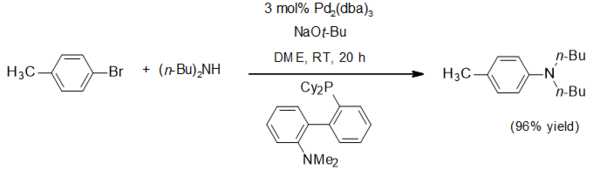
Une application pour le tert- butoxyde de sodium est en tant que base non nucléophile. Il a été largement utilisé dans l' amination Buchwald-Hartwig , comme dans cet exemple typique :
Le tert-butoxyde de sodium est utilisé pour préparer des complexes de tert-butoxyde. Par exemple l' hexa(tert-butoxy)ditungstène(III) est ainsi converti par la réaction de métathèse du sel à partir d'un heptachorure de ditungstène :
- NaW 2 Cl 7 (THF) 5 + 6 NaOBu-t → W 2 (OBu-t) 6 + 7 NaCl + 5 THF
Structure
Le tert- butoxyde de sodium forme des amas à l'état solide, à la fois des hexamères et des nonamères.
 |

|
| hexamère | non-amer |
Composés apparentés
Les références
- ^ Dewick, Paul M. (2013-03-20). Fondamentaux de la chimie organique : pour les étudiants en pharmacie, chimie médicinale et chimie biologique . ISBN 9781118681961.
- ^ http://www.sigmaaldrich.com/catalog/ProductDetail.do?lang=en&N4=359270%7CALDRICH&N5=SEARCH_CONCAT_PNO%7CBRAND_KEY&F=SPEC}
- ^ MP. Dewick, 2013. Essentials of Organic Chemistry: Pour les étudiants en pharmacie, chimie médicinale et chimie biologique. John Wiley & Fils; p. 157. ISBN 978-1-118-68196-1
- ^ Yang, Bryant H.; Buchwald, Stephen L. (1999). « Amination catalysée par le palladium d'halogénures d'aryle et de sulfonates ». Journal de chimie organométallique . 576 (1–2) : 125–146. doi : 10.1016/S0022-328X(98)01054-7 .
- ^ Broderick, Erin M.; Browne, Samuel C.; Johnson, Marc JA (2014). "Dimolybdène et Ditungsten Hexa (Alcoxydes)". Synthèses inorganiques . 36 : 95-102. doi : 10.1002/9781118744994.ch18 . ISBN 9781118744994.
- ^ E. Østreng, HH Sønsteby, S. Øien, O. Nilsen, H. Fjellvåg (2014). "Dépôt en couche atomique d'oxydes de sodium et de potassium : évaluation de précurseurs et dépôt de couches minces" . Dalton Trans. 43 : 16666–16672. doi : 10.1039/C4DT01930J .CS1 maint : utilise le paramètre auteurs ( lien )
- ^ H. Nekola, F. Olbrich, U. Behrens (2002). "Kristall‐ und Molekülstrukturen von Lithium‐ und Natrium‐ tert ‐butoxid". Z. Anorg. Allg. Chem. 628 (9-10) : 2067-2070. doi : 10.1002/1521-3749(200209)628:9/10<2067::AID-ZAAC2067>3.0.CO;2-N .CS1 maint : utilise le paramètre auteurs ( lien )