Liaison hydrogène symétrique - Symmetric hydrogen bond
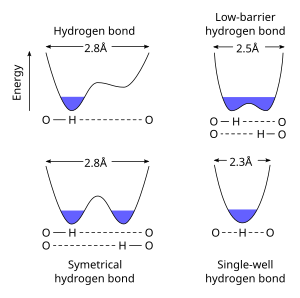
Une liaison hydrogène symétrique est un type spécial de liaison hydrogène dans lequel le proton est espacé exactement à mi-chemin entre deux atomes identiques. La force de la liaison à chacun de ces atomes est égale. C'est un exemple de liaison à 4 électrons à 3 centres . Ce type de liaison est beaucoup plus fort que les liaisons hydrogène «normales», en fait, sa force est comparable à une liaison covalente . On le voit dans la glace à haute pression ( Ice X ), ainsi que dans la phase solide de nombreux acides anhydres tels que l'acide fluorhydrique et l'acide formique à haute pression. On le voit également dans l' ion bifluorure [F − H − F] - . Beaucoup a été fait pour expliquer la liaison hydrogène symétrique quantique-mécaniquement, car elle semble violer la règle du duo pour la première couche: le proton est effectivement entouré de quatre électrons . En raison de ce problème, certains considèrent qu'il s'agit d'une liaison ionique .
Les références
- Steiner, Thomas (2002). "La liaison hydrogène à l'état solide". Édition internationale d'Angewandte Chemie . 41 : 48. doi : 10.1002 / 1521-3773 (20020104) 41: 1 <48 :: AID-ANIE48> 3.0.CO; 2-U .
