Variante glycoprotéine de surface - Variant surface glycoprotein
| Glycoprotéine de surface variable | |
|---|---|
| Identifiants | |
| Organisme | |
| symbole | Tb927.5.4730 |
| Alt. symboles | Tb05.26C7.380 |
| Entrez | 3657576 |
| Autre informations | |
| Chromosome | 5: 1,41 - 1,41 Mo |
| Variante glycoprotéine de surface MITAT 1.2 | |||||||
|---|---|---|---|---|---|---|---|
| Identifiants | |||||||
| Organisme | |||||||
| symbole | N / A | ||||||
| Alt. symboles | VSG 221 | ||||||
| UniProt | P26332 | ||||||
| |||||||
La glycoprotéine variant de surface ( VSG ) est une protéine d' environ 60 kDa qui embaume de manière dense la surface cellulaire des parasites protozoaires appartenant au genre Trypanosoma . Ce genre est remarquable pour ses protéines de surface cellulaire. Ils ont été isolés pour la première fois de Trypanosoma brucei en 1975 par George Cross . La VSG permet aux parasites trypanosomatides d'échapper au système immunitaire de l'hôte mammifère par une variation antigénique étendue . Ils forment une couche superficielle de 12 à 15 nm. Dimères VSG, ~ 90% de toutes les protéines de surface cellulaire. Il représente également environ 10% des protéines cellulaires totales. Pour cette raison, ces protéines sont hautement immunogènes et une réponse immunitaire déclenchée contre une couche de VSG spécifique tuera rapidement les trypanosomes exprimant ce variant. Cependant, à chaque division cellulaire, il est possible que la descendance change d'expression pour changer la VSG qui est exprimée. VSG n'a pas d' activité biochimique prescrite .
Le parasite possède un vaste répertoire cellulaire de VSG antigéniquement distinctes (~ 1500/2000 complètes et partielles ( pseudogènes )) situées dans des matrices télomériques et subtélomériques (sur des chromosomes mégabases ou des minichromosomes ). Les VSG sont exprimées à partir d'un site d'expression sanguin (BES, ES) dans un polycistron par l' ARN polymérase I (recrutée dans un promoteur de type ribosomique ) avec d'autres gènes associés aux ES (ESAG), dont le récepteur de la transferrine (Tfr : ESAG6, ESAG7) est une. Un seul gène VSG est exprimé à la fois, car un seul des ~ 15 ES est actif dans une cellule. L'expression de VSG est « commutée » par recombinaison homologue d'un gène de copie de base silencieux d'un réseau (dirigé par homologie) dans le site d'expression actif situé de manière télomérique. Pendant cette transition, les trypanosomes affichent simultanément les VSG pré- et post-commutation sur leur surface. Ce processus de remplacement de la couche est essentiel pour la survie des cellules récemment commutées, car les VSG initiaux restent des cibles pour l'escalade de la réponse Ab de l'hôte. Les gènes VSG mosaïques peuvent être créés par recombinaison homologue d'un gène VSG partiel à partir d'une puce. Ce gène partiel peut remplacer n'importe quelle partie du gène VSG résidant, créant une nouvelle mosaïque VSG. Les mesures de la demi-vie des VSG suggèrent que les VSG initiales peuvent persister à la surface des trypanosomes génétiquement modifiés pendant plusieurs jours. Il reste difficile de savoir si la régulation de la commutation VSG est purement stochastique ou si les stimuli environnementaux affectent la fréquence de commutation. Le fait que la commutation se produise in vitro suggère qu'il existe au moins un élément stochastique indépendant de l'hôte dans le processus.
La variation antigénique provoque des vagues cycliques de parasitémie, qui est l'une des caractéristiques de la trypanosomose humaine africaine . Le processus cyclique prend 5 à 8 jours. Cela se produit parce qu'une gamme variée de couches exprimées par la population de trypanosomes signifie que le système immunitaire a toujours une longueur de retard : il faut plusieurs jours pour qu'une réponse immunitaire contre une VSG donnée se développe, ce qui donne à la population le temps de se diversifier à mesure que les individus subissent d'autres changements. événements. La répétition de ce processus empêche l'extinction de la population de trypanosomes infectants, permettant la persistance chronique des parasites dans l'hôte et augmentant les possibilités de transmission.
Chez Trypanosoma brucei
Chez Trypanosoma brucei , la surface cellulaire est recouverte d'une couche dense d'environ 5 x 10 6 dimères de VSG , environ 90 % de toutes les protéines de surface cellulaire. Il représente également environ 10% des protéines cellulaires totales.
Les propriétés de la couche VSG qui permettent l'évasion immunitaire sont :
- Blindage - la nature dense de la couche de VSG (protéines de VSG Pack d' épaule à épaule) empêche le système immunitaire de l'hôte de mammifère d'accéder à la membrane plasmatique ou toute autre surface invariant parasites epitopes (tels que les canaux ioniques , les transporteurs , les récepteurs , etc. ). Le pelage est uniforme, composé de millions de copies d'une même molécule ; par conséquent, la VSG est la seule partie du trypanosome que le système immunitaire peut reconnaître.
- Variation antigénique périodique – la couche de VSG subit de fréquentes modifications génétiques stochastiques – « commutation » – permettant aux variants exprimant une nouvelle couche de VSG d'échapper à la réponse immunitaire spécifique déclenchée contre la couche précédente. Cette variation antigénique crée des vagues cycliques de parasitémie caractéristiques de la trypanosomose humaine africaine.
- « nettoyage » de l'antigène et recyclage des VSG : les VSG sont recyclées efficacement à travers la poche flagellaire des trypanosomes, ce qui permet aux anticorps d'être « nettoyés » des VSG avant leur réincorporation dans la membrane cellulaire. Il est important de noter que les VSG reconnues et liées par des anticorps sont sélectivement poussées vers la poche flagellaire à un rythme plus rapide que les VSG non identifiées ; dans ce scénario, l'anticorps agit comme une « voile », ce qui accélère le processus de VSG amené à la zone de recyclage.
Les VSG de T. brucei sont attachées à la membrane plasmique via une fixation covalente à deux ancres glycosyl-phosphatidylinositol (GPI) (une par monomère ), qui dirige son trafic vers l'avant du RE vers la poche flagellaire pour incorporation dans la membrane, comme prédit par l'hypothèse de valence GPI.
Les VSG sont remplacées par une couche tout aussi dense de procyclines lorsque le parasite se différencie en la forme procyclique dans l' intestin moyen des glossines . Il y a une inhibition très rapide de la transcription du gène VSG qui se produit dès que la température est abaissée.
Expression
La source de la variabilité des VSG au cours de l'infection est une grande « archive » de gènes VSG présents dans le génome de T. brucei . Certains d'entre eux sont des gènes intacts de pleine longueur ; d'autres sont des pseudogènes (généralement avec des mutations de décalage du cadre de lecture , des codons d'arrêt prématurés ou une fragmentation). L'expression d'une VSG antigéniquement différente peut se produire en passant simplement à un gène VSG de pleine longueur différent par commutation de site d'expression (changement de quel ES est actif). De plus, des gènes VSG chimériques ou « mosaïques » peuvent être générés en combinant des segments de plus d'un gène VSG silencieux . La formation de VSG mosaïques permet l'expression (partielle) de VSG pseudogéniques , qui peuvent constituer la majeure partie de l' archive VSG , et peuvent contribuer directement à la variation antigénique, augmentant considérablement la capacité du trypanosome à échapper au système immunitaire et posant un problème majeur pour développement de vaccins .
Les gènes VSG peuvent être gardés silencieux et activés à tout moment. La VSG exprimée est toujours située dans un site d'expression (ES), qui sont des loci d' expression spécialisés trouvés au niveau des télomères de certains des grands chromosomes et intermédiaires. Chaque SE est une unité polycistronique, contenant un certain nombre de gènes associés au site d'expression (ESAG) tous exprimés avec la VSG active. Bien qu'il existe plusieurs SE, un seul est toujours actif à la fois. Un certain nombre de mécanismes semblent être impliqués dans ce processus, mais la nature exacte du silence n'est toujours pas claire.
La VSG exprimée peut être commutée soit en activant un site d'expression différent (et donc en changeant pour exprimer la VSG dans ce site), soit en changeant le gène VSG dans le site actif en un variant différent. Le génome contient de nombreuses copies des gènes VSG, à la fois sur les minichromosomes et dans des sections répétées à l'intérieur des chromosomes. Ceux-ci sont généralement silencieux, généralement avec des sections omises ou des codons d'arrêt prématurés, mais sont importants dans l'évolution de nouveaux gènes VSG. On estime que jusqu'à 10 % du génome de T.brucei peut être constitué de gènes ou de pseudogènes VSG . N'importe lequel de ces gènes peut être déplacé dans le site actif par recombinaison pour l'expression. Encore une fois, les mécanismes exacts qui contrôlent cela ne sont pas clairs, mais le processus semble reposer sur des machines de réparation de l'ADN et un processus de recombinaison homologue .
Le site d'expression de la circulation sanguine (BES), ou site d'expression télomérique, est utilisé pour échanger des glycoprotéines de surface variantes lorsqu'elles se trouvent dans la circulation sanguine de l'hôte pour échapper au système du complément . Les BES sont polymorphes en taille et en structure, mais révèlent une architecture étonnamment conservée dans le contexte d'une recombinaison extensive. De très petits BES existent et de nombreux BES fonctionnels ne contiennent pas l'intégralité des gènes associés aux sites d'expression (ESAG). Il existe une collection d'environ 20 à 30 sites, chacun étant actif à la fois. Les sites d'expression actifs des VSG sont dépourvus de nucléosomes .
Les répertoires de gènes de T. brucei ont divergé pour devenir spécifiques de la souche.
Les gènes variants des glycoprotéines de surface de T. brucei ont été classés en deux groupes selon qu'une duplication des gènes est observée ou non lorsqu'ils sont exprimés.
Trafic sécrétoire
Trypanosoma possède un système de transport membranaire simple et polarisé constitué d'un seul ER , lysosome et appareil de Golgi .
La VSG est d'abord transcrite sous forme de polycistron, puis subit une polyadénylation et un trans-épissage spécifiques aux trypanosomatides dirigés par des faisceaux de polypyrimidine . Parce qu'il n'y a pas de contrôle transcriptionnel, le VSG 3'UTR est important pour la stabilité de son ARN (le plus important, le 8mer et le 14mer). La VSG est ensuite transcrite sur des polysomes liés à la membrane , et l'apparition de la séquence signal N-terminale dirige la VSG vers le RE. La VSG est ainsi co-traductionnellement transportée dans la lumière du RE, rapidement N-glycosylée (sur les sites asn-x-ser/thr) et GPI ancrée au site ω par une réaction de transamination (élimination du C-term hydrophobe 17 ou 23 aa séquence d'ancrage GPI). Le site est toujours Ser (habituellement dans 17 peptides de séquence signal aa), Asp (habituellement dans 23 peptides de séquence signal aa) ou Asn. De plus, le nombre de sites de N-glycosylation par VSG peut varier (habituellement 1 à 3 N-glycanes). VSG MITat.1.5 est glycosylé au niveau des trois sites potentiels de N-glycosylation.
La VSG subit ensuite le cycle de repliement calréticuline / calnexine (la calnexine est absente chez Trypanosoma brucei ), où elle est transitoirement monoglucosylée et déglucosylée, et interagit avec diverses protéines chaperons du RE, telles que BiP, afin de se replier correctement. Le VSG se replie et se dimérise efficacement (suggérant un repliement intrinsèquement favorable) et est transporté à travers l'appareil de Golgi jusqu'à la poche flagellaire pour incorporation dans la membrane cellulaire.
Il est important de noter qu'après incorporation dans la membrane cellulaire, la VSG peut ensuite être recyclée à travers la poche flagellaire et triée à la surface de la cellule. La VSG n'est pas retournée par les voies de dégradation canoniques lysosomales ou protéasomiques, mais est à la place perdue de la cellule par clivage spécifique de son ancre GPI par le PLC spécifique de GPI .
Structure
Les gènes VSG sont extrêmement variables au niveau de la séquence (primaire), mais on pense que les variantes ont des caractéristiques structurelles (tertiaires) fortement conservées , basées sur deux structures tridimensionnelles déterminées et la conservation des motifs de séquence bidimensionnels (hélices alpha descendantes et ascendantes qui composent l'interface de dimérisation), leur permettant de remplir une fonction de blindage similaire. Les VSG sont constitués d' un domaine N terminal d'environ 300 à 350 acides aminés avec une faible homologie de séquence (13 à 30 % d'identité) et d'un domaine C terminal plus conservé d'environ 100 acides aminés. Les domaines N-terminaux sont regroupés en classes AC en fonction de leurs modèles de cystéine. Les domaines C-term sont regroupés par homologie de séquence dans les classes I-III, sans aucune restriction apparente sur les classes N-term avec lesquelles ils peuvent s'apparier pour former un VSG complet. Pour se dimériser, les domaines N-terminaux de VSG forment un faisceau de quatre hélices alpha dirigées par des interactions hydrophobes, autour desquelles pendent des caractéristiques structurelles plus petites (cinq hélices plus petites et trois feuillets bêta).
La VSG est ancrée à la membrane cellulaire via une ancre glycophosphatidylinositol (GPI) - une liaison non covalente de l'extrémité C-terminale qui dirige son trafic vers l'avant du RE vers la membrane. Cette ancre GPI est spécifiquement clivée par la GPI Phospholipase C, clivant la VSG sous forme membranaire et permettant à la protéine VSG et à une partie de l'ancre GPI d'être perdues dans le milieu extracellulaire en tant que VSG soluble (sVSG, qui peut être reconnue comme une réaction croisée Déterminant, ou CRD), tout en conservant les deux chaînes 1,2-dimyristolglycérol dans la membrane.
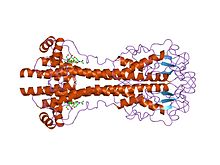
Variation antigénique
La VSG est hautement immunogène , et une réponse immunitaire déclenchée contre une couche de VSG spécifique tuera rapidement les trypanosomes exprimant cette variante. La destruction des trypanosomes médiée par les anticorps peut également être observée in vitro par un essai de lyse médiée par le complément . Cependant, à chaque division cellulaire, il est possible que l'un ou les deux descendants changent d'expression pour changer la VSG qui est exprimée. La fréquence de commutation VSG a été mesurée à environ 0,1% par division, bien que les taux de commutation diffèrent en culture par rapport à in vivo . Comme les populations de T. brucei peuvent culminer à une taille de 10 11 au sein d'un hôte, ce taux de commutation rapide garantit que la population de parasites est constamment diversifiée. Une gamme variée de manteaux exprimée par la population de trypanosomes signifie que le système immunitaire a toujours une longueur de retard : il faut plusieurs jours pour qu'une réponse immunitaire contre un VSG donné se développe, donnant à la population le temps de se diversifier à mesure que les individus subissent d'autres événements de commutation. La réitération de ce processus empêche l'extinction de la population de trypanosomes infectants, permettant la persistance chronique des parasites dans l'hôte, augmentant les opportunités de transmission. L'effet clinique de ce cycle est des « vagues » successives de parasitémie (trypanosomes dans le sang).
Dans d'autres trypanosomes
Des glycoprotéines de surface variables sont également trouvées dans d'autres espèces de Trypanosoma ,
Chez Trypanosoma equiperdum , un parasite causant la maladie de la couverture chez les chevaux, ces protéines permettent au parasite d'échapper efficacement au système immunitaire de l'animal hôte. Ces VSG permettent à l'organisme de manipuler et de modifier constamment la structure de surface de ses protéines, ce qui signifie qu'il est constamment présenté au système immunitaire comme un nouvel organisme étranger, ce qui empêche le corps de développer une réponse immunitaire suffisamment importante pour éradiquer la maladie. En ce sens, Trypanosoma equiperdum est un organisme très efficace ; il peut infecter moins d'espèces que d'autres maladies, mais il infecte et survit très efficacement au sein de ses hôtes spécifiés. Les protéines VSG de T. equiperdum sont également phosphorylées .
Un gène VSG de Trypanosoma evansi , un parasite qui provoque une forme de surra chez les animaux, a été cloné dans Escherichia coli . La protéine exprimée est immunoréactive avec toutes les combinaisons de sérums. Les animaux immunisés avec un lysat de cellules entières ou une protéine recombinante présentent des réactions d'anticorps similaires en ELISA (Enzyme-linked immunosorbent assay) et CATT ( test d'agglutination sur carte pour la trypanosomose ). La glycoprotéine de surface variable RoTat 1.2 PCR peut être utilisée comme outil de diagnostic spécifique pour la détection des infections à T. evansi .
La plus petite protéine VSG (40 kDa) à ce jour (1996) a été trouvée chez Trypanosoma vivax , qui contient peu de glucides.
Chez Trypanosoma congolense , des analyses in vitro des sucres incorporés après hydrolyse de la glycoprotéine ont montré que la glucosamine et le mannose sont utilisés dans la biosynthèse de la fraction glucidique directement alors que le galactose a été converti éventuellement en d'autres intermédiaires avant d'être incorporé dans l'antigène. La VSG non glycosylée avec un poids moléculaire de 47 kDa avait complètement perdu son hétérogénéité de taille.
Voir également
- Protéine d'enveloppe (homonymie)
- Glycocalyx
- Liste des codes MeSH (D23)
- Liste des codes MeSH (D12.776.395)
- Liste des codes MeSH (D12.776.543)
- Amastine , une autre glycoprotéine de surface ( transmembranaire ) chez les parasites trypanosomatidés
Les références
Liens externes
- Glycoprotéines de surface variantes, Trypanosoma à la National Library of Medicine Medical Subject Headings (MeSH) des États-Unis
- www.icp.ucl.ac.be


