Maladie de von Willebrand - Von Willebrand disease
| maladie de von Willebrand | |
|---|---|
 | |
| Les maladies de von Willebrand de types I et II sont héritées selon un mode autosomique dominant . | |
| Prononciation | |
| Spécialité | Hématologie |
La maladie de von Willebrand ( MVW ) est le trouble héréditaire de la coagulation sanguine le plus courant chez l'homme. Une forme acquise peut parfois résulter d'autres conditions médicales. Elle résulte d'une déficience de la qualité ou de la quantité du facteur de von Willebrand (VWF), une protéine multimère nécessaire à l' adhésion plaquettaire . Il est connu pour affecter plusieurs races de chiens ainsi que les humains. Les trois formes de VWD sont héréditaires, acquises et de type pseudo ou plaquettaire. Les trois types de VWD héréditaires sont le VWD de type 1, le VWD de type 2 et le VWD de type 3. Le type 2 contient divers sous-types. Le type plaquettaire VWD est également une maladie héréditaire.
En 2008, une nouvelle catégorie de diagnostic de « VWF faible » a été proposée pour inclure les personnes dont les niveaux de facteur de von Willebrand étaient inférieurs à la plage de référence normale mais pas suffisamment bas pour être la maladie de von Willebrand (niveaux dans la plage de 30 à 50 UI/dL). Les patients avec un faible VWF peuvent présenter des saignements, malgré de légères réductions des taux de VWF.
La maladie de von Willebrand de type 1 est le type le plus courant de la maladie, avec des symptômes hémorragiques légers tels que des saignements de nez , bien que des symptômes plus graves puissent parfois survenir. Le groupe sanguin peut affecter la présentation et la gravité des symptômes de la maladie de von Willebrand.
La maladie de von Willebrand de type 2 est le deuxième type de trouble le plus courant et présente des symptômes légers à modérés.
Le facteur porte le nom du médecin finlandais Erik Adolf von Willebrand qui a décrit la maladie pour la première fois en 1926. Les directives pour le diagnostic et la gestion de la maladie de von Willebrand ont été mises à jour en 2021.
Signes et symptômes
Les divers types de MvW présentent des degrés variables de tendance aux saignements , généralement sous la forme d' ecchymoses , de saignements de nez et de saignements des gencives faciles . Les personnes peuvent avoir des menstruations abondantes et des pertes de sang pendant l' accouchement.
Les hémorragies internes graves et les saignements dans les articulations sont rares dans tous les types sauf le plus grave, la maladie de von Willebrand de type 3.
La génétique
Le gène VWF est situé sur le bras court p du chromosome 12 (12p13.2). Il possède 52 exons couvrant 178 kpb . Les types 1 et 2 sont hérités en tant que traits autosomiques dominants . Parfois, le type 2 hérite également de manière récessive. Le type 3 est hérité comme autosomique récessif . Cependant, certaines personnes hétérozygotes pour le type 3 peuvent être diagnostiquées avec la maladie de von Willebrand de type 1, indiquant une transmission intermédiaire dans ces cas. La maladie de von Willebrand survient chez environ 1 % de la population et affecte autant les hommes que les femmes.
Les tests génétiques ne font généralement pas partie du bilan initial de la maladie de von Willebrand et ne sont pas nécessaires pour les personnes diagnostiquées avec une MDC de type 1 sur la base des antécédents cliniques et des tests de laboratoire. Il est principalement utile pour :
- Évaluer les membres de la famille des individus qui ont des variantes connues.
- Différenciation entre la VWD de type 2B et la VWD de type plaquettaire, ainsi qu'entre la VWD de type 2N et l' hémophilie A .
Physiopathologie
Le facteur de von Willebrand est principalement actif dans des conditions de flux sanguin élevé et de cisaillement . Par conséquent, la déficience en VWF se manifeste principalement dans les organes dotés de petits vaisseaux étendus , tels que la peau , le tractus gastro-intestinal et l' utérus . Dans l' angiodysplasie , une forme de télangiectasie du côlon , la contrainte de cisaillement est beaucoup plus élevée que dans les capillaires moyens , et le risque de saignement est augmenté de façon concomitante.
Dans les cas plus graves de la maladie de von Willebrand de type 1, les modifications génétiques sont courantes au sein du gène VWF et sont hautement pénétrantes . Dans les cas plus bénins de VWD de type 1, un spectre complexe de pathologie moléculaire peut exister en plus des polymorphismes du gène VWF seul.
Le groupe sanguin ABO de l'individu peut influencer la présentation et la pathologie de la maladie de von Willebrand. Les individus du groupe sanguin O ont un niveau moyen inférieur à celui des individus des autres groupes sanguins. À moins que des plages de référence d'antigène spécifiques au groupe ABO ne soient utilisées, les individus normaux du groupe O peuvent être diagnostiqués comme étant de type I VWD, et certains individus du groupe sanguin AB avec une anomalie génétique du VWF peuvent avoir le diagnostic négligé parce que les taux de VWF sont élevés en raison de groupe sanguin.
Diagnostic
Les tests de base effectués chez tout patient présentant des problèmes de saignement sont une numération formule sanguine complète -CBC (en particulier la numération plaquettaire ), le temps de céphaline activée -APTT, le temps de Quick avec le rapport international normalisé-PTINR, le temps de thrombine -TT et le niveau de fibrinogène . Les patients présentant des tests anormaux subissent généralement d'autres tests de dépistage de l'hémophilie. D'autres dosages de facteurs de coagulation peuvent être effectués en fonction des résultats d'un test de coagulation. Les patients atteints de la maladie de von Willebrand présentent généralement un temps de Quick normal et un allongement variable du temps de céphaline.
En cas de suspicion de maladie de von Willebrand, le plasma sanguin d'un patient doit être recherché pour détecter les déficiences quantitatives et qualitatives du VWF. Ceci est réalisé en mesurant la quantité de VWF dans un test d'antigène VWF et la fonctionnalité du VWF avec un test de liaison à la glycoprotéine (GP)Ib, un test de liaison au collagène ou une activité de cofacteur de la ristocétine (RiCof) ou l'agglutination plaquettaire induite par la ristocétine (RIPA ) dosages. Les niveaux de facteur VIII sont également effectués parce que le facteur VIII est lié au VWF qui protège le facteur VIII d'une dégradation rapide dans le sang. Le déficit en VWF peut alors conduire à une diminution des taux de facteur VIII, ce qui explique l'élévation du PTT. Les taux normaux n'excluent pas toutes les formes de la maladie de von Willebrand, en particulier le type 2, qui ne peut être révélée qu'en étudiant l'interaction plaquettaire avec le sous-endothélium sous flux, une étude de coagulation hautement spécialisée qui n'est pas systématiquement réalisée dans la plupart des laboratoires médicaux . Un test d'agrégation plaquettaire montrera une réponse anormale à la ristocétine avec des réponses normales aux autres agonistes utilisés :
| ADP | Épinéphrine | Collagène | ristocétine | |
|---|---|---|---|---|
| Inhibiteur ou défaut du récepteur P2Y | Diminué | Normal | Normal | Normal |
| Défaut des récepteurs adrénergiques | Normal | Diminué | Normal | Normal |
| Défaut des récepteurs de collagène | Normal | Normal | Diminué ou absent | Normal |
| Normal | Normal | Normal | Diminué ou absent | |
| Diminué | Diminué | Diminué | Normal ou diminué |
Un test de la fonction plaquettaire peut donner un temps de fermeture collagène/ épinéphrine anormal et, dans la plupart des cas, un temps collagène/ ADP normal . Le type 2N peut être envisagé si les taux de facteur VIII sont disproportionnellement bas, mais la confirmation nécessite un test de « liaison au facteur VIII ». Des tests de laboratoire supplémentaires qui aident à classer les sous-types de VWD comprennent l'analyse multimère de von-willebrand, le test d'agrégation plaquettaire induite par la ristocétine modifiée et le rapport propeptide VWF sur propeptide antigène VWF. En cas de suspicion de syndrome de von-Willebrand acquis, une étude de mélange (analyse du plasma du patient avec un pool de plasma normal/PNP et un mélange des deux testé immédiatement, à une heure et à deux heures) doit être réalisée. La détection de la maladie de von Willebrand est compliquée par le fait que le VWF est un réactif de phase aiguë avec des niveaux croissants d'infection, de grossesse et de stress.
Le dépistage de la maladie de von Willebrand peut être influencé par les procédures de laboratoire. De nombreuses variables existent dans la procédure de test qui peuvent affecter la validité des résultats du test et peuvent entraîner un diagnostic manqué ou erroné. Le risque d'erreurs de procédure est généralement le plus élevé pendant la phase pré-analytique (pendant le stockage, le prélèvement et le transport de l'échantillon), en particulier lorsque le test est confié à une installation extérieure et que l'échantillon est congelé et transporté sur de longues distances. Les erreurs de diagnostic ne sont pas rares et le taux de maîtrise des tests varie selon les laboratoires, avec des taux d'erreur allant de 7 à 22 % dans certaines études jusqu'à 60 % en cas de classification erronée du sous-type de la maladie de von Willebrand. Pour augmenter la probabilité d'un diagnostic correct, les tests doivent être effectués dans une installation avec un traitement immédiat sur place dans un laboratoire de coagulation spécialisé.
Les types
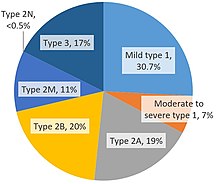
Les quatre types héréditaires de la maladie de von Willebrand décrits sont le type 1, le type 2, le type 3 et le type pseudo ou plaquettaire. La plupart des cas sont héréditaires, mais des formes acquises de la maladie de von Willebrand ont été décrites. La classification de la Société internationale de thrombose et d'hémostase dépend de la définition des défauts qualitatifs et quantitatifs.

Type 1
La VWD de type 1 (40 à 80 % de tous les cas de VWD) est un défaut quantitatif hétérozygote pour le gène défectueux. Il peut provenir d'une incapacité à sécréter le VWF dans la circulation ou d'une élimination du VWF plus rapide que la normale. Des niveaux réduits de VWF sont détectés à 20-50% de la normale, c'est-à-dire 20-50 UI.
De nombreux patients sont asymptomatiques ou peuvent présenter des symptômes bénins et ne pas avoir de coagulation clairement altérée , ce qui pourrait suggérer un trouble de la coagulation. Souvent, la découverte de la maladie de von Willebrand survient incidemment à d'autres procédures médicales nécessitant un bilan sanguin. La plupart des cas de MvW de type 1 ne sont jamais diagnostiqués en raison de la présentation asymptomatique ou légère du type I et la plupart des gens finissent généralement par mener une vie normale sans complications, beaucoup ignorant qu'ils ont le trouble.
Des problèmes peuvent cependant survenir chez certains patients sous la forme de saignements après une intervention chirurgicale (y compris les procédures dentaires), des ecchymoses faciles visibles ou des ménorragies (règles abondantes). La minorité des cas de type 1 peut présenter des symptômes hémorragiques sévères.
Type 2
La maladie de von Willebrand de type 2 (15-50% des cas) est un défaut qualitatif et la tendance hémorragique peut varier d'un individu à l'autre. Quatre sous-types existent : 2A, 2B, 2M et 2N. Ces sous-types dépendent de la présence et du comportement des multimères sous-jacents.
Type 2A
La capacité des facteurs de von Willebrand qualitativement défectueux à fusionner et à former de gros multimères de VWF est altérée, ce qui entraîne une diminution de la quantité de gros multimères de VWF et une faible activité RCoF. Seules de petites unités multimères sont détectées dans la circulation. Le dosage de l'antigène du facteur von Willebrand (VWF:Ag) est faible ou normal.
Type 2B
Il s'agit d'un défaut de " gain de fonction ". La capacité du VWF qualitativement défectueux à se lier au récepteur de la glycoprotéine Ib (GPIb) sur la membrane plaquettaire est anormalement améliorée, ce qui conduit à sa liaison spontanée aux plaquettes et à la clairance rapide subséquente des plaquettes liées et des grands multimères du VWF. Une thrombopénie peut survenir. Les grands multimères de VWF sont réduits ou absents de la circulation.
L'activité du cofacteur de la ristocétine est faible lorsque le plasma pauvre en plaquettes du patient est dosé contre des plaquettes de donneur normales fixées au formol. Cependant, lorsque le dosage est effectué avec les propres plaquettes du patient (plasma riche en plaquettes), une quantité de ristocétine inférieure à la normale provoque une agrégation. Cela est dû au fait que les grands multimères du VWF restent liés aux plaquettes du patient. Les patients atteints de ce sous-type sont incapables d'utiliser la desmopressine comme traitement des saignements, car elle peut entraîner une agrégation plaquettaire indésirable et une aggravation de la thrombocytopénie.
Type 2M
La VWD de type 2M est un défaut qualitatif du VWF caractérisé par sa capacité réduite à se lier au récepteur GPIb sur la membrane plaquettaire et sa capacité normale à la multimérisation. Les niveaux d'antigène VWF sont normaux. L'activité du cofacteur de la ristocétine est diminuée et des multimères de VWF de haut poids moléculaire sont présents dans la circulation.
Type 2N (Normandie)
Il s'agit d'une déficience de la liaison du VWF au facteur VIII de coagulation. Le test de l'antigène VWF est normal, indiquant une quantité normale de VWF. Le dosage du cofacteur ristocétine est normal. Le dosage du facteur VIII de coagulation montrera une diminution quantitative marquée, équivalente aux niveaux observés dans l'hémophilie A. Cela a conduit à un diagnostic erroné de certains patients atteints de la maladie de von Willebrand de type A.
Type 3
Le type 3 est la forme la plus sévère de la maladie de von Willebrand (homozygote pour le gène défectueux) et se caractérise par une absence totale de production de VWF. Le facteur von Willebrand est indétectable dans le dosage de l'antigène VWF. Étant donné que le VWF protège le facteur VIII de coagulation de la dégradation protéolytique, l'absence totale de VWF conduit à un taux de facteur VIII extrêmement bas, équivalent à celui observé dans l'hémophilie A sévère avec ses manifestations cliniques d'hémorragies externes et internes potentiellement mortelles. Le mode de transmission de la maladie de von Willebrand de type 3 est autosomique récessif, tandis que le mode de transmission de l'hémophilie A est récessif lié à l'X .
Comparaison
| autosomique héritage | activité vWF | RIPA | quantité de Multimère | ||
|---|---|---|---|---|---|
| Type 1 | Dominant | Diminué | Normal ou diminué | Diminution similaire parmi les types de multimères | |
| Type 2 | UNE | Dominant ou récessif | Diminué | Souvent diminué à des concentrations élevées de ristocétine | Diminution des gros multimères |
| B | Dominant | Diminué | Augmenté | Diminution des gros multimères | |
| M | Dominant ou récessif | Diminué | Diminution à des concentrations élevées de ristocétine | Diminution similaire parmi les types de multimères | |
| N | Récessif | Normal | Normal | Normal | |
| Type 3 | Récessif | Absent ou nettement diminué | Absent ou nettement diminué | Généralement indétectable | |
Type plaquettaire
La VWD de type plaquettaire (également connue sous le nom de pseudo-VWD) est une anomalie génétique autosomique dominante des plaquettes. Le VWF est qualitativement normal et les tests génétiques du gène von Willebrand et de la protéine VWF ne révèlent aucune altération mutationnelle. Le défaut réside dans le récepteur GPIb qualitativement altéré sur la membrane plaquettaire qui augmente son affinité pour se lier au VWF. Les gros agrégats plaquettaires et les multimères de VWF de poids moléculaire élevé sont éliminés de la circulation, ce qui entraîne une thrombocytopénie et une diminution ou l'absence de gros multimères de VWF. L'activité du cofacteur de la ristocétine et la perte de grands multimères du VWF sont similaires à celles de la VWD de type 2B.
Acquis
La maladie de von Willebrand acquise peut survenir chez les patients porteurs d' auto-anticorps . Dans ce cas, la fonction du VWF n'est pas inhibée, mais le complexe VWF-anticorps est rapidement éliminé de la circulation.
Une forme de MvW survient chez les patients présentant une sténose valvulaire aortique , entraînant une hémorragie gastro-intestinale ( syndrome de Heyde ). Cette forme de MvW acquise peut être plus répandue qu'on ne le pense actuellement. En 2003, Vincentelli et al. ont noté que les patients atteints de MvW acquis et de sténose aortique qui ont subi un remplacement valvulaire ont connu une correction de leurs anomalies hémostatiques, mais que les anomalies hémostatiques peuvent réapparaître après 6 mois lorsque la prothèse valvulaire correspond mal au patient. De même, la VWD acquise contribue à la tendance aux saignements chez les personnes ayant un implant d'un dispositif d'assistance ventriculaire gauche (une pompe qui pompe le sang du ventricule gauche du cœur vers l'aorte).
Traitement
Pour les patients atteints de VWD de type 1 et de VWD de type 2A, la desmopressine est disponible sous différentes préparations, recommandées pour une utilisation en cas de traumatisme mineur, ou en préparation d'interventions dentaires ou chirurgicales mineures. La desmopressine stimule la libération de VWF par les corps de Weibel-Palade des cellules endothéliales , augmentant ainsi les niveaux de VWF (ainsi que de facteur coagulant VIII ) de trois à cinq fois. La desmopressine est également disponible sous forme de préparation pour administration intranasale (Stimate) et de préparation pour administration intraveineuse. La desmopressine est contre-indiquée dans la maladie de von Willebrand de type 2b en raison du risque de thrombopénie aggravée et de complications thrombotiques. La desmopressine n'est probablement pas efficace dans la VWD de type 2M et est rarement efficace dans la VWD de type 2N. Il est totalement inefficace en VWD type 3.
Pour les femmes ayant des saignements menstruels abondants, les contraceptifs oraux contenant des œstrogènes sont efficaces pour réduire la fréquence et la durée des périodes menstruelles. Les composés d'œstrogène et de progestérone disponibles pour une utilisation dans la correction de la ménorragie sont l' éthinylestradiol et le lévonorgestrel (Levona, Nordette, Lutera, Trivora). L'administration d'éthinylestradiol diminue la sécrétion d'hormone lutéinisante et d'hormone folliculo-stimulante par l'hypophyse, entraînant une stabilisation de la surface endométriale de l'utérus.
La desmopressine est un analogue synthétique de la vasopressine, une hormone antidiurétique naturelle . Son utilisation excessive peut entraîner une rétention d'eau et une hyponatrémie par dilution avec pour conséquence des convulsions.
Pour les patients atteints de la maladie de von Willebrand devant subir une intervention chirurgicale et les cas de maladie de la maladie de Willebrand compliquée par une hémorragie cliniquement significative, des concentrés de facteur VIII d'origine humaine de pureté moyenne, qui contiennent également des facteurs de von Willebrand, sont disponibles pour la prophylaxie et le traitement. Humate P, Alphanate, Wilate et Koate HP sont disponibles dans le commerce pour la prophylaxie et le traitement de la maladie de von Willebrand. Les concentrés de facteur VIII purifiés de manière monoclonale et les concentrés de facteur VIII recombinant contiennent une quantité insignifiante de VWF et ne sont donc pas cliniquement utiles.
Le développement d'alloanticorps survient chez 10 à 15 % des patients recevant des concentrés de facteur VIII d'origine humaine de pureté moyenne et le risque de réactions allergiques, y compris l'anaphylaxie, doit être pris en compte lors de l'administration de ces préparations. L'administration de ce dernier est également associée à un risque accru de complications thromboemboliques veineuses.
Des transfusions sanguines sont administrées au besoin pour corriger l'anémie et l'hypotension secondaire à l'hypovolémie. La perfusion de concentrés plaquettaires est recommandée pour la correction de l'hémorragie associée à la MvW de type plaquettaire.
Vonicog alfa est un facteur de von Willebrand recombinant qui a été approuvé pour une utilisation aux États-Unis en décembre 2015 et pour une utilisation dans l'Union européenne en août 2018.
Épidémiologie
La prévalence de la maladie de von Willebrand est d'environ un individu sur 100. Cependant, la majorité de ces personnes ne présentent pas de symptômes. La prévalence des cas cliniquement significatifs est de un pour 10 000. Parce que la plupart des formes sont plutôt bénignes, elles sont détectées plus souvent chez les femmes, dont la tendance aux saignements se manifeste pendant la menstruation . Elle peut être plus grave ou apparente chez les personnes de groupe sanguin O.
Histoire
En 1924, une fillette de 5 ans de Föglö , land , Finlande, a été emmenée à l'hôpital des diaconesses d'Helsinki, où elle a été vue par le médecin finlandais Erik Adolf von Willebrand . Il a finalement évalué 66 membres de sa famille et a signalé dans un article en suédois de 1926 qu'il s'agissait d'un trouble de la coagulation non décrit auparavant qui différait de l'hémophilie. Il a publié un autre article sur la maladie en 1931, en langue allemande, qui a attiré l'attention internationale sur la maladie. Le nom éponyme a été attribué à la maladie entre la fin des années 1930 et le début des années 1940, en reconnaissance des recherches approfondies de Von Willebrand.
Dans les années 1950, il est devenu évident qu'un "facteur plasmatique", le facteur VIII , était diminué chez ces personnes et que la fraction de Cohn I-0 pouvait corriger à la fois le déficit plasmatique en FVIII et l'allongement du temps de saignement. Depuis cette époque, le facteur à l'origine du long temps de saignement a été appelé le "facteur von Willebrand" en l'honneur d'Erik Adolf von Willebrand.
Des formes variantes de VWF ont été reconnues dans les années 1970, et ces variations sont maintenant reconnues comme le résultat de la synthèse d'une protéine anormale. Au cours des années 1980, des études moléculaires et cellulaires distinguaient plus précisément l'hémophilie A et la maladie de von Willebrand. Les personnes atteintes de la maladie de von Willebrand avaient un gène FVIII normal sur le chromosome X, et certaines avaient un gène VWF anormal sur le chromosome 12. Le séquençage génétique a identifié plusieurs de ces personnes comme ayant une mutation du gène VWF. Les causes génétiques des formes plus légères de faible VWF sont encore à l'étude, et ces formes peuvent ne pas toujours être causées par un gène anormal du VWF.
Autres animaux
La maladie de von Willebrand peut également affecter les chiens, les porcs et les souris. De plus, des cas ont été rapportés chez des chats, des chevaux, des bovins et des lapins.
La mutation causale de la VWD de type 1 a été identifiée chez les chiens des races Doberman Pinscher , German Pinscher , Bernese Mountain Dog , Manchester Terrier , Kerry Blue Terrier , Cardigan Welsh Corgi , Poodle , Coton de Tulear , Drentse Patrijshond , Papillon et Stabyhoun . Mutations causales de type 2 ont été identifiés chez les chiens des races Drahthaar , braque allemand et chinois à crête ; et pour le type 3 chez les chiens des races Kooikerhondje , Scottish Terrier et Shetland Sheepdog . Chez les chiens atteints de la maladie de von Willebrand de type 1, la mutation causale était la même dans toutes les races et la même mutation a également été détectée chez certains patients humains de la maladie de von Willebrand de type 1. En revanche, les mutations à l'origine de la maladie de von Willebrand de type 3 chez le chien sont spécifiques à chaque race. Le dépistage génétique est offert pour les races connues.
Chez le porc, la mutation causale de la maladie de von Willebrand de type 3 a également été identifiée. Il s'agit d'une duplication importante au sein du gène VWF et provoque de graves dommages à la fonction du gène, de sorte que pratiquement aucune protéine VWF n'est produite. Le tableau clinique chez les porcs est le plus similaire à celui des humains atteints de la maladie de von Willebrand de type 3. Par conséquent, ces porcs sont des modèles précieux pour la recherche clinique et pharmacologique.
Des souris atteintes de la maladie de von Willebrand de type 3 ont été produites par génie génétique pour obtenir un modèle de petite taille pour la maladie humaine. Dans ces souches, le gène VWF a été désactivé.
Chez les animaux d'autres espèces affectées par la maladie de von Willebrand, les mutations causales n'ont pas encore été identifiées.
Manifestations orales
En cas de carence sévère, il peut y avoir des saignements gingivaux spontanés, des ecchymoses et des épistaxis . Les symptômes de la maladie de von Willebrand comprennent des saignements postopératoires, des saignements après extraction dentaire, des saignements gingivaux, des épistaxis et des ecchymoses faciles. La prise de contraceptifs oraux comme traitement de première intention de la ménorragie peut entraîner une hypertrophie gingivale et des saignements chez la femme.
Des troubles plaquettaires ou de la coagulation avec une hémostase sévèrement altérée peuvent provoquer des saignements gingivaux spontanés, comme on le voit en conjonction avec des hypertrophies gingivales hyperplasiques et hyperémiques chez les patients leucémiques. Le dépôt d' hémosidérine et d'autres produits de dégradation du sang sur les surfaces dentaires, les rendant brunes, peut se produire avec des saignements buccaux continus sur de longues périodes.
La localisation des saignements buccaux était la suivante : frein labial, 60 % ; langue, 23 % ; muqueuse buccale, 17 % et gencive et palais, 0,5 %. L'hémophilie grave aura les saignements les plus fréquents, suivis de l'hémophilie modérée puis légère. Ils proviennent principalement de blessures traumatiques. Les saignements seront également induits par des facteurs iatrogènes et de mauvaises pratiques d'hygiène bucco-dentaire. La fréquence des hémorragies buccales par localisation chez les personnes présentant un déficit en F VIII et F IX est de : gencive, 64 % ; pulpe dentaire, 13%; langue, 7,5%; lèvre, 7 % ; palais, 2% et muqueuse buccale, 1%.
Considérations dentaires
Les protocoles suggèrent l'utilisation de concentré de facteur ainsi que l'utilisation de techniques hémostatiques locales, telles que la suture, et des mesures locales, telles que l'utilisation de cellulose oxydée, par exemple, Surgicel ou de la colle de fibrine en conjonction avec des agents antifibrinolytiques administrés après l'opération où approprié.
L'utilisation de tout anti-inflammatoire non stéroïdien (AINS) doit être préalablement discutée avec l'hématologue du patient en raison de son effet sur l'agrégation plaquettaire. Il n'y a aucune restriction concernant le type d'agent anesthésique local utilisé bien que ceux avec des vasoconstricteurs puissent fournir une hémostase locale supplémentaire.
Voir également
- Syndrome de Bernard-Soulier , causé par une déficience du récepteur VWF, GPIb
- Liste des conditions hématologiques
- Purpura
Les références
Lectures complémentaires
- Manuel de médecine interne de Harrison , chapitre 177.
- Sadler JE (1998). « Biochimie et génétique du facteur von Willebrand » . Revue annuelle de biochimie . 67 : 395-424. doi : 10.1146/annurev.biochem.67.1.395 . PMID 9759493 .
- Mannucci PM (août 2004). "Traitement de la maladie de von Willebrand". Le Journal de médecine de la Nouvelle-Angleterre . 351 (7) : 683–94. doi : 10.1056/NEJMra040403 . PMID 15306670 .
- Laffan M, Brown SA, Collins PW, Cumming AM, Hill FG, Keeling D, Peake IR, Pasi KJ (mai 2004). « Le diagnostic de la maladie de von Willebrand : une directive de l'organisation britannique des médecins du centre de l'hémophilie ». L'hémophilie . 10 (3) : 199-217. doi : 10.1111/j.1365-2516.2004.00894.x . PMID 15086318 . S2CID 731315 .
- Williams Hematology, 7e édition, Grune et Stratton, chapitres 112 (p. 1806) et 118 (p. 1937)
Liens externes
- Entrée GeneReviews/NCBI/NIH/UW sur la maladie de von Willebrand
- Groupe d'experts sur la maladie du NHLBI von Willebrand (janvier 2008). Le diagnostic, l'évaluation et la gestion de la maladie de von Willebrand . Institut national du cœur, du poumon et du sang (rapport).
| Classification | |
|---|---|
| Ressources externes |
